下载高清试卷
【2019年广东省广州市中考化学试卷】-第1页
试卷格式:2019年广东省广州市中考化学试卷.PDF
试卷热词:最新试卷、2019年、广东试卷、广州市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.做好垃圾分类,为绿色发展做贡献.下列可回收垃圾主要成分为有机合成材料的是( )
- A. 旧报纸
- B. 塑料瓶
- C. 铝制易拉罐
- D. 玻璃瓶
2."食在广州",下列广州美食中富含蛋白质的是( )
- A. 增城迟菜心
- B. 从化荔枝
- C. 沙湾姜撞奶
- D. 沙河粉
3.空气是一种宝贵的资源,下列生产、生活中用到的气体,不是来自空气的是( )
- A. 作为燃料电池燃料的H2
- B. 用于生产氮肥的N2
- C. 用于医疗急救的O2
- D. 用于飞艇的He
4.下列过程中,发生了化学变化的是( )
- A. 干冰变成CO2气体
- B. 从含SiO2的沙子中提炼高纯Si
- C. 海水晒盐
- D. 从潮湿空气中分离出水
5.下列实验操正确的是( )
- A.
将蒸发皿直接加热
- B.
取液后的胶头滴管平放在桌面上
- C.
用燃着的酒精灯点燃酒精灯
- D.
将混合液倒入过滤器过滤
6.下图为某反应的微观示意图," "、"
"、" "各表示一种原子,下列说法不正确的是( )
"各表示一种原子,下列说法不正确的是( )
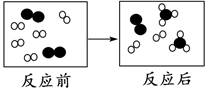
 "、"
"、" "各表示一种原子,下列说法不正确的是( )
"各表示一种原子,下列说法不正确的是( )
- A. 反应物是两种单质
- B. 反应物有剩余
- C. 该反应为化合反应
- D. 该反应生成了多种产物
7.下列物质的使用能够达到目的的是( )
- A. 用明矾对水进行杀菌消毒
- B. 用碱液清洗水垢
- C. 用生石灰和水作为"自热米饭"的热源
- D. 用活性炭将硬水软化
8.超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气:2KO2+2H2O=2KOH+X+O2↑,关于此反应的说法不正确的是( )
- A. X的化学式为H2O2
- B. 反应前后元素种类发生变化
- C. 反应前后氧元素化合价发生变化
- D. 反应前后物质状态发生变化
9.下列物质的性质与用途均正确并相对应的是( )
| 性质 | 用途 | |
| A | 铝在空气中与氧气反应生成致密氧化膜 | 铝合金用于制作卫生间的置物架 |
| B | 钨的导电性好 | 钨用于制作灯泡里的灯丝 |
| C | CO2水溶液显酸性 | CO2用作大棚蔬菜的气体肥料 |
| D | 氢氧化钠能够与酸反应 | 氢氧化钠用于改良酸性土壤 |
- A.
10.下列关于氯化钠的认识,正确的是( )
- A. 组成:含有钠和氯两种单质
- B. 性质:与盐酸类似,能与碳酸盐反应
- C. 用途:可用于生产金属钠
- D. 生产:常用钠与氯气通过化合反应获得
11.中国古代诗句中蕴含有很多化学原理,下列诗句的解释不正确的是( )
| 诗句 | 解释 | |
| A | 吴山开,越溪涸,三金合冶成宝锷 | "宝锷"的成分为合金 |
| B | 遥知不是雪,为有暗香来 | 分子在不停地运动 |
| C | 千淘万漉虽辛苦,吹尽狂沙始到金 | 金的密度比沙大 |
| D | 千锤万凿出深山,烈火焚烧若等闲 | 煅烧生石灰得到熟石灰 |
- A. A

- B. B

- C. C

- D. D
12.燃料和能源与生活息息相关,下列说法正确的是( )
- A. 石油是一种清洁能源,也是一种可再生能源
- B. 炒菜时油锅着火,应立即用水浇灭
- C. "钻木取火"的原理是通过摩擦生热提高木材的着火点
- D. 燃气灶火焰出现黄色,锅底出现黑色时,可增大灶具进风口
13.25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( )
| 编号 | ① | ② | ③ | ④ |
| 水的质量/g | 50 | 50 | 50 | 50 |
| 加入固体质量/g | 5 | 10 | 15 | 20 |
| 现象 | 固体 完全溶解 | 固体 完全溶解 | 剩余 少量固体 | 剩余 较多固体 |
- A. 实验①所得溶液质量分数为10%
- B. 实验说明25℃时该物质的溶解度是20g
- C. 实验③④所得溶液质量分数相同
- D. 实验④所得溶液中含溶质20g
14.从地沟油中提炼生物柴油是垃圾资源化的方法之一。生物柴油主要成分是硬脂酸甲酯(C19H38O2),下列有关硬脂酸甲酯的说法正确的是( )
- A. C、H、O三种元素的质量比为19:38:2
- B. 相对分子质量为(12×19+1×38+16×2)
- C. C、H、O三种原子的个数比为12:1:16
- D. 氧元素的质量分数为×100%
16 12+1+16
15.煤和燃油的燃烧是造成空气污染的重婴原因,下列排放物能形成酸雨的是( )
- A. SO2、NO2
- B. CO、CO2
- C. 烟尘
- D. 未充分燃烧的汽油
16.下列物质混合后能够反应,且有明显现象的是( )
- A. 向氧化铁粉末中滴入氢氧化钠溶液
- B. 向和硫酸中滴入稀氢氧化钾溶液
- C. 将硫酸铵与熟石灰混合研磨
- D. 向澄清石灰水中滴入氯化钡溶液
17.某微粒M的结构示意图如下,关于该微粒的说法正确的是( )
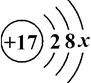

- A. M的原子易失电子
- B. x只能为7
- C. M为金属元素
- D. x为8时,M为阴离子
18.下列物质与空气充分混合后,遇明火不会发生爆炸的是( )
- A. P2O5
- B. 面粉
- C. 镁粉
- D. CH4
19.除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是:( )
- A. Zn粉(Fe):用ZnCl2溶液浸泡,过滤
- B. 碳粉(MnO2):滴入H2O2溶液,过滤
- C. NaCl溶液(Na2SO4):加入适量MgCl2溶液过滤
- D. CO2(H2O):通过盛有浓硫酸的洗气瓶
20.下列实验中,现象正确且可得到相应结论的是( )
| 实验操作 | 现象 | 结论 | |
| A | 把硫在空气中点燃,再伸进充满氧气的集气瓶里 | 硫在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰 | 硫在空气中燃烧生成SO2,在氧气中燃烧生成SO3 |
| B | 在电解器的玻璃管中加满水,接通直流电源 | 两极玻璃管中有气体生成,体积比是1:2 | 水是化合物,可分解 |
| C | 高温条件下,将CO通入Fe2O3粉末 | 黑色粉末变为红色 | 可利用CO的还原性来炼铁 |
| D | 将带火星的木条置于一瓶盛有氧气的集气瓶口上方 | 木条不复燃 | O2能支持燃烧 |
- A. A

- B. B

- C. C

- D. D
21.地球大气中存在氧气(O2)和臭氧(O3)两种含氧元素的单质,其中臭氧氧主要存在于15000-30000米的高空,能减弱高能量紫外线对地球表面的辐射。
(1)O3表示一个 (填"原子"、"分子"或"离子")
(2)高空中可发生转化:2O3
3O2,该变化属于 (填"物理"或"化学")变化。
(3)镁在氧气中燃烧的化学方程式是 。
(1)O3表示一个 (填"原子"、"分子"或"离子")
(2)高空中可发生转化:2O3
| 紫外线 |
(3)镁在氧气中燃烧的化学方程式是 。
22.氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。
(1)在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是 。
(2)向盛有NaHCO3粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是 ,发生反应的化学方程式是 。
(3)画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注(水分子不用画出)。

(1)在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是 。
(2)向盛有NaHCO3粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是 ,发生反应的化学方程式是 。
(3)画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注(水分子不用画出)。

23.有一包白色固体样品,可能含有NaOH、Na2CO3、K2SO4、BaCl2中的一种或几种,为确定其组成,进行如下实验:
步骤I:取少量样品于烧杯中,加足量水,充分搅拌,静置,有固体剩余。
步骤II:取步骤I所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色;再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液。
步骤III:取步骤II所得溶液于试管中,滴入过量Ba(NO3)2溶液,无明显现象。
根据上述实验,回答下列问题:
(1)步骤II中溶液的红色褪去,发生反应的化学方程式是 。
(2)分析上述实验过程,关于样品的组成,可以得到的结论是 。
(3)若要进一步确定样品的组成,还需进行的实验操作是 。
步骤I:取少量样品于烧杯中,加足量水,充分搅拌,静置,有固体剩余。
步骤II:取步骤I所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色;再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液。
步骤III:取步骤II所得溶液于试管中,滴入过量Ba(NO3)2溶液,无明显现象。
根据上述实验,回答下列问题:
(1)步骤II中溶液的红色褪去,发生反应的化学方程式是 。
(2)分析上述实验过程,关于样品的组成,可以得到的结论是 。
(3)若要进一步确定样品的组成,还需进行的实验操作是 。
24.俄国化学家门捷列夫在公布元素周期表时,就预言了当时还未发现的相对原子质量约为68的元素的存在,且性质与铝相似,称为“类铝”。如图是元素周期表中“类铝”元素镓的相关信息,请回答下列问题:

(1)镓原子核外电子数为 。
(2)金属镓与稀硫酸反应,产物中Ga的化合价为+3,反应的化学方程式是 。
(3)高纯氧化镓广泛用于生产半导体材料,其中一种制备方法如下:
步骤I:向含有硫酸的硫酸镓溶液中通入氨气(NH3),冷却,生成Ga(NH4)(SO4)2固体。
步骤II:在一定条件下灼烧Ga(NH4)(SO4)2固体,制得高纯氧化镓。
①Ga(NH4)(SO4)2中含有的带电的原子团(根)是 (填化学符号)。
②步骤I反应的化学方程式是 。

(1)镓原子核外电子数为 。
(2)金属镓与稀硫酸反应,产物中Ga的化合价为+3,反应的化学方程式是 。
(3)高纯氧化镓广泛用于生产半导体材料,其中一种制备方法如下:
步骤I:向含有硫酸的硫酸镓溶液中通入氨气(NH3),冷却,生成Ga(NH4)(SO4)2固体。
步骤II:在一定条件下灼烧Ga(NH4)(SO4)2固体,制得高纯氧化镓。
①Ga(NH4)(SO4)2中含有的带电的原子团(根)是 (填化学符号)。
②步骤I反应的化学方程式是 。
25.稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物 (Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的工艺如下:

(1)氧化钇(Y2O3)中,Y元素的化合价为 。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是 。
(3)“分离提纯”是为了除去滤液1中的 (填化学式)。
(4)“调pH”时加入碱液使溶液的pH (填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是 。
(6)为了获得大颗粒氧化钇,某小组研究了条件对产品直径的影响,相关数据如下(D50表示颗粒直径):
分析上表数据,其他条件不变时,若将灼烧温度均升高至1400℃,预期所得氧化钇D50最大的是 (填实验编号)。

(1)氧化钇(Y2O3)中,Y元素的化合价为 。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是 。
(3)“分离提纯”是为了除去滤液1中的 (填化学式)。
(4)“调pH”时加入碱液使溶液的pH (填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是 。
(6)为了获得大颗粒氧化钇,某小组研究了条件对产品直径的影响,相关数据如下(D50表示颗粒直径):
| 实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 沉淀反应温度/℃ | 60 | 80 | 85 | 93 | 93 | 93 |
| 料液浓度Kg/L | 30 | 30 | 30 | 30 | 40 | 40 |
| 灼烧温度/℃ | 1100 | 1100 | 1100 | 1100 | 1100 | 1400 |
| 氧化钇D50/um | 6.00 | 21.65 | 35.99 | 38.56 | 35.99 | 61.54 |
分析上表数据,其他条件不变时,若将灼烧温度均升高至1400℃,预期所得氧化钇D50最大的是 (填实验编号)。
26.实验室有如图所示装置,回答下列问题:

(1)连接装置时,需根据导管的高度调节 处的高度,再确定 处的高度。(填"甲"或"乙")
(2)结束实验的操作是:先 ,再 。

(1)连接装置时,需根据导管的高度调节 处的高度,再确定 处的高度。(填"甲"或"乙")
(2)结束实验的操作是:先 ,再 。
27.下图是实验室制取CO2及进行性质实验的部分装置。
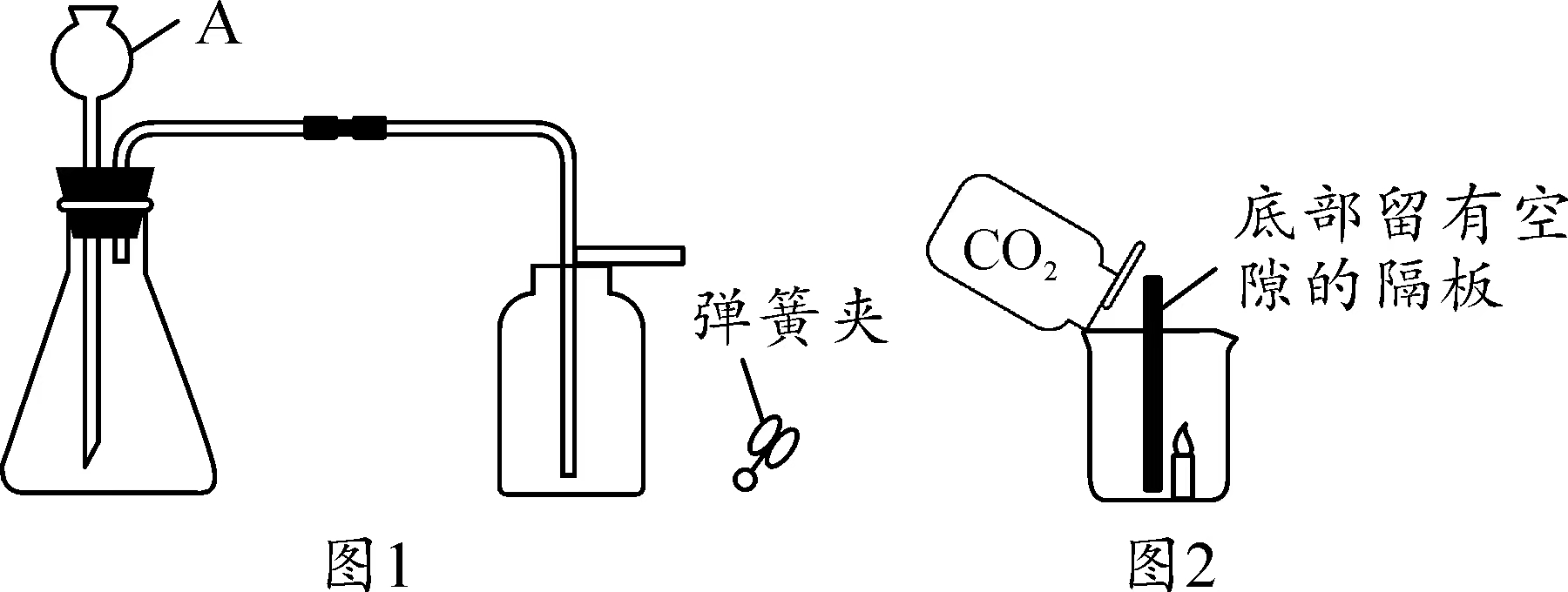
(1)CaCO3固体与稀盐酸反应生成CO2气体的化学方程式是 。
(2)检验装置气密性,按图1连接装置,先 ,再加水至A下端形成一段水柱,静置,若观察到 ,说明气密性良好。
(3)加入药品。添加块状CaCO3固体时,为避免打破锥形瓶,应将锥形瓶 ,再放入固体。添加盐酸时,将稀盐酸从 (填仪器A的名称)倒入锥形瓶至 。
(4)如图2所示,向放置有燃着的蜡烛的烧杯中倒入CO2,观察到的现象是 。

(1)CaCO3固体与稀盐酸反应生成CO2气体的化学方程式是 。
(2)检验装置气密性,按图1连接装置,先 ,再加水至A下端形成一段水柱,静置,若观察到 ,说明气密性良好。
(3)加入药品。添加块状CaCO3固体时,为避免打破锥形瓶,应将锥形瓶 ,再放入固体。添加盐酸时,将稀盐酸从 (填仪器A的名称)倒入锥形瓶至 。
(4)如图2所示,向放置有燃着的蜡烛的烧杯中倒入CO2,观察到的现象是 。
28.实验室配制饱和澄清石灰水和质量分数为10%的氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
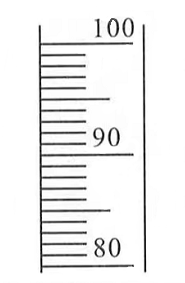
(1)配制溶液。其中配制100g10%氢氧化钠溶液的基本步骤是:称取氢氧化钠固体-量取水-溶解-装瓶贴标签。
①称取氢氧化钠固体的质量 g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,请在上图中画出水的液面 。
③装瓶后贴标签,在标签上填写: 。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是 。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是 。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为 g,或需10%氢氧化钠溶液的质量至少为 g。(计算结果精确到个位)
下表是20℃时部分物质的溶解度数据。
| 物质 | Ca(OH)2 | NaOH | CaCO3 | Ca(HCO3)2 | Na2CO3 | NaHCO3 |
| 溶解度/g | 0.16 | 109 | 0.0065 | 16.6 | 21.8 | 9.6 |

(1)配制溶液。其中配制100g10%氢氧化钠溶液的基本步骤是:称取氢氧化钠固体-量取水-溶解-装瓶贴标签。
①称取氢氧化钠固体的质量 g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,请在上图中画出水的液面 。
③装瓶后贴标签,在标签上填写: 。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是 。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是 。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为 g,或需10%氢氧化钠溶液的质量至少为 g。(计算结果精确到个位)
29.已知金属钻(Co)的活动性与铁相似,请预测氯化钻(CoCl2)的化学性质,说明预测的依据,并设计实验验证。经查阅资料,钴的化合物相关性质如下:
限选试剂:CoCl2溶液、(NH4)2CO3溶液、Na2SO4溶液、AgNO3溶液、NaOH溶液、稀硫酸、镁条、铜片。
(1)取少量CoCl2溶液于试管中, ,如果观察到 ,则预测成立;
(2)①能够与 (填物质类别)反应;
②预测的依据: ;
③取少量CoCl2溶液于试管中, ,如果观察到 ,则预测成立;
(3)①能够与 (填物质类别)反应;
②预测的依据: ;
③取少量CoCl2溶液于试管中, ,如果观察到 ,则预测成立。
| 物质 | CoO | Co(OH)2 | CoCl2 | CoSO4 | Co(NO3)2 | CoCO3 |
| 在水中溶的溶解性 | 难溶于水的灰绿色固体 | 难溶于水的粉红色固体 | 易溶于水形成粉红色溶液 | 易溶于水形成粉红色溶液 | 易溶于水形成粉红色溶液 | 难溶于水的粉红色固体 |
限选试剂:CoCl2溶液、(NH4)2CO3溶液、Na2SO4溶液、AgNO3溶液、NaOH溶液、稀硫酸、镁条、铜片。
| 预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
| 能够与含Ag+的可溶性盐反应 | CoCl2溶液中含Cl-,AgCl难溶于水. | (1)取少量CoCl2溶液于试管中,________,如果观察到________,则预测成立. |
| (2)①能够与________(填物质类别)反应 | ②________ | ③取少量CoCl2溶液于试管中,________,如果观察到________,则预测成立. |
| (3)①能够与________(填物质类别)反应 | ②________ | ③取少量CoCl2溶液于试管中,________,如果观察到________,则预测成立. |
(1)取少量CoCl2溶液于试管中, ,如果观察到 ,则预测成立;
(2)①能够与 (填物质类别)反应;
②预测的依据: ;
③取少量CoCl2溶液于试管中, ,如果观察到 ,则预测成立;
(3)①能够与 (填物质类别)反应;
②预测的依据: ;
③取少量CoCl2溶液于试管中, ,如果观察到 ,则预测成立。
查看全部题目