下载高清试卷
【2019年贵州省黔西南州中考化学试卷】-第1页
试卷格式:2019年贵州省黔西南州中考化学试卷.PDF
试卷热词:最新试卷、2019年、贵州试卷、黔西南布依族苗族自治州试卷、化学试卷、九年级试卷、中考试卷、初中试卷
扫码查看解析
试卷题目
1.中国古诗词既蕴含人文思想,又闪耀理性光辉。对下列古诗词划线部分隐含的化学现象解释不合理的是( )
- A. 千锤万凿出深山,烈火焚烧若等闲--煅烧石灰石,不发生化学变化
- B. 花气袭人知骤暖,鹊声穿树喜新晴--温度升高,分子运动加快
- C. 何意百炼钢,化为绕指柔--生铁经不断煅烧捶打氧化,降低碳的含量后变成钢
- D. 美人首饰侯王印,尽是沙中浪底来--金的化学性质稳定,在自然界中以单质形态存在
2.下列实验操作错误的是( )
- A.
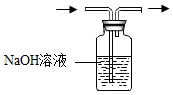 除去O2中的CO2
除去O2中的CO2 - B.
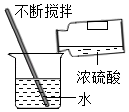 稀释浓硫酸
稀释浓硫酸 - C.
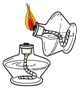 点燃酒精灯
点燃酒精灯 - D.
 检查装置的气密性
检查装置的气密性
3.化学反应前后肯定没有发生变化的是( )
①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量。
①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量。
- A. ①④⑥

- B. ①③⑤⑥
- C. ①②⑥
- D. ②③⑤
4.H1N1流感疫情曾在我国大面积爆发。实践表明,出现这种疫情时可用过氧乙酸(C2H4O3)消毒杀菌。下列有关过氧乙酸的叙述错误的是( )
- A. 由碳、氢、氧三种元素组成
- B. 其分子中含有臭氧(O3)
- C. 既是纯净物,也是化合物
- D. 碳、氢、氧元素的质量比为6:1:12
5.下列各实验方案能达到其实验目的的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 鉴别氢氧化钠溶液和稀盐酸 | 分别取样滴加紫色石蕊溶液 |
| B | 除去NaOH溶液中混有的Na2CO3 | 加入足量稀盐酸 |
| C | 除去CO2中混有的少量CO | 在足量的氧气中点燃 |
| D | 鉴别氮气和二氧化碳 | 将燃着的木条分别伸入气体中 |
- A. A
- B. B
- C. C
- D. D
6.下列各组离子在溶液中能大量共存的是( )
- A. Na+、H+、Cl-、OH-
- B. Ag+、K+、Cl-、NO3-
- C. Na+、H+、NO
、CO- 3 2- 3 - D. H+、Mg2+、SO
、Cl-2- 4
7.用化学用语填空:
(1)3个二氧化硫分子: 。
(2)保持氩气化学性质的最小粒子 。
(3)空气中含量最多的气体: 。
(4)氧化铁中铁元素的化合价: 。
(5)13号元素原子的结构示意图: 。
(1)3个二氧化硫分子: 。
(2)保持氩气化学性质的最小粒子 。
(3)空气中含量最多的气体: 。
(4)氧化铁中铁元素的化合价: 。
(5)13号元素原子的结构示意图: 。
8.化学与人类生活、生产活动息息相关。根据所学化学知识回答下列问题:
(1)生活中常用 来区分硬水和软水。
(2)人的胃液里含有适量的 (填名称),可以帮助消化。
(3)食用"加铁酱油"可预防贫血,其中的"铁"是指 (填"元素"或"原子")。
(4)厨房油锅着火,盖上锅盖可以立即灭火,其原理是 。
(5)将少量某塑料样品在密闭容器中与足量的O2反应,生成了CO2和H2O,由此可知该塑料中一定含有 元素。
(6)稀土有"工业的维生素"的美誉。稀土元素Tm在元素周期表中的信息如图,下列有关Tm的判断错误的是 (填序号)。
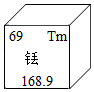
①原子的质子数为69 ②属于金属元素 ③原子的中子数为69 ④相对原子质量为168.9
(1)生活中常用 来区分硬水和软水。
(2)人的胃液里含有适量的 (填名称),可以帮助消化。
(3)食用"加铁酱油"可预防贫血,其中的"铁"是指 (填"元素"或"原子")。
(4)厨房油锅着火,盖上锅盖可以立即灭火,其原理是 。
(5)将少量某塑料样品在密闭容器中与足量的O2反应,生成了CO2和H2O,由此可知该塑料中一定含有 元素。
(6)稀土有"工业的维生素"的美誉。稀土元素Tm在元素周期表中的信息如图,下列有关Tm的判断错误的是 (填序号)。

①原子的质子数为69 ②属于金属元素 ③原子的中子数为69 ④相对原子质量为168.9
9.如图所示为①KNO3②NaCl③H3BO3的溶解度曲线,由图可知:

(1)当温度为10℃时,KNO3、NaCl和H3BO3三种物质的溶解度由大到小的顺序为 (用序号作答)。
(2)当温度为t℃时,在三种物质的饱和溶液中溶质的质量分数由大到小的顺序为 (用序号作答)。
(3)要将P点处的KNO3溶液变成饱和溶液,可采取的措施有:加入KNO3固体、 等(任写一条)。

(1)当温度为10℃时,KNO3、NaCl和H3BO3三种物质的溶解度由大到小的顺序为 (用序号作答)。
(2)当温度为t℃时,在三种物质的饱和溶液中溶质的质量分数由大到小的顺序为 (用序号作答)。
(3)要将P点处的KNO3溶液变成饱和溶液,可采取的措施有:加入KNO3固体、 等(任写一条)。
10.工业上使用一种国产低温催化剂生产氢气的反应过程如图所示
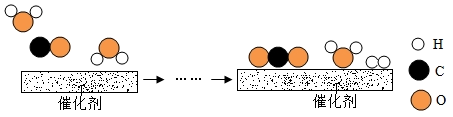
(1)该微观反应过程中出现了 种氧化物。
(2)参加反应的 与
与 分子个数之比为 。
分子个数之比为 。
(3)该反应的化学方程式为 。

(1)该微观反应过程中出现了 种氧化物。
(2)参加反应的
 与
与 分子个数之比为 。
分子个数之比为 。(3)该反应的化学方程式为 。
11.下列A~H都是初中化学中常见的物质。已知A是沼气、可燃冰的重要成分,F可用于改良酸性土壤,它们之间的转化关系如下图所示。

回答下列问题:
(1)A的化学式为 ,G俗称 。
(2)大气中D的含量过高会产生 ,从而导致全球气候变暖。
(3)反应③的化学方程式为 ,该反应过程中 (填“吸收”或“放出”)热量。
(4)反应④的化学方程式为 ,其基本反应类型为 反应。

回答下列问题:
(1)A的化学式为 ,G俗称 。
(2)大气中D的含量过高会产生 ,从而导致全球气候变暖。
(3)反应③的化学方程式为 ,该反应过程中 (填“吸收”或“放出”)热量。
(4)反应④的化学方程式为 ,其基本反应类型为 反应。
12.实验室利用下图所示装置进行相关实验。
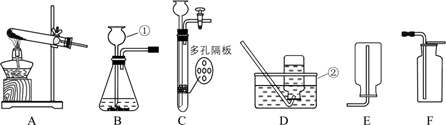
回答下列问题:
(1)写出装置图中标号仪器的名称:① ,② 。
(2)用高锰酸钾制氧气,应选用的发生装置是 (填字母序号),该反应的化学方程式为 ,其中转化为氧气的氧元素与高锰酸钾中氧元素的质量之比是 。
(3)常温下,用锌和稀硫酸反应制取氢气,若要随时控制反应的发生和停止,应选用的发生装置是 (填字母序号),反应的化学方程式为 ;点燃氢气前必须验纯,为确保安全,最好选用装置 (填字母序号)所示方法收集氢气。

回答下列问题:
(1)写出装置图中标号仪器的名称:① ,② 。
(2)用高锰酸钾制氧气,应选用的发生装置是 (填字母序号),该反应的化学方程式为 ,其中转化为氧气的氧元素与高锰酸钾中氧元素的质量之比是 。
(3)常温下,用锌和稀硫酸反应制取氢气,若要随时控制反应的发生和停止,应选用的发生装置是 (填字母序号),反应的化学方程式为 ;点燃氢气前必须验纯,为确保安全,最好选用装置 (填字母序号)所示方法收集氢气。
13.某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
【查阅资料】
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为 。
【对比实验】
(1)比较实验乙和实验 (填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为 ,据此可知金属活动性Al比Cu (填强”或“弱”)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是 。
【猜测与探究】
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
【结论与反思】
得出结论:前述猜测 (填“正确”或“不正确”)。
总结反思:本次探究充分运用了比较法和控制变量法
【查阅资料】
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为 。
【对比实验】
| 编号 | 操作 | 现象 |
| 甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 |
| 乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 |
| 丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出红色固体 |
(1)比较实验乙和实验 (填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为 ,据此可知金属活动性Al比Cu (填强”或“弱”)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是 。
【猜测与探究】
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
| 操作 | 现象 | 结论 | 推论 |
| (1)向一支试管中再加入NaCl固体 | 铝丝表面析出红色固体 | 氧化铝薄膜被破坏 | Na+或① 能破坏氧化铝薄膜 |
| (2)向另一支试管中再加入Na2SO4固体 | ② | 氧化铝薄膜未被破坏 | Na+和SO42-都不能破坏氧化铝薄膜 |
【结论与反思】
得出结论:前述猜测 (填“正确”或“不正确”)。
总结反思:本次探究充分运用了比较法和控制变量法
14.为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20g固体混合物置于烧杯中,将100g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
回答下列问题:
(1)原固体混合物中,氧化铜的质量分数为 。
(2)上表中,a的值为 ,实验③所得溶液中的溶质是 (填化学式)。
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
| 次序 | ① | ② | ③ | ④ |
| 加入稀硫酸的质量/g | 25 | 25 | 25 | 25 |
| 剩余固体的质量/g | 16 | a | 10 | 10 |
回答下列问题:
(1)原固体混合物中,氧化铜的质量分数为 。
(2)上表中,a的值为 ,实验③所得溶液中的溶质是 (填化学式)。
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
查看全部题目