下载高清试卷
【2018年山东省莱芜市中考化学试卷】-第1页
试卷格式:2018年山东省莱芜市中考化学试卷.PDF
试卷热词:最新试卷、2018年、山东试卷、莱芜市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.化学改变世界的途径是使物质发生化学变化。下列属于化学变化的是( )
- A. 利用半透膜法从海水中获得淡水
- B. 从石油中分离出汽油、柴油
- C. 煤焦化得到焦炭、煤焦油
- D. 工业上从空气中分离出氧气
2.用分子的观点解释下列现象,错误的是( )
- A. 蜡炬成灰﹣﹣﹣﹣分子种类发生改变
- B. 花香四溢﹣﹣﹣﹣分子在不断运动
- C. 滴水成冰﹣﹣﹣﹣分子间间隔发生改变
- D. 热胀冷缩﹣﹣﹣﹣分子的大小发生改变
3.分类是研究物质的常用方法。如图是纯净物、单质、化合物、氧化物之间关系的形象表示,若整个大圈表示纯净物,则下列物质属于Z范围的是( )
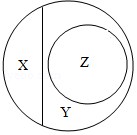

- A. 水银
- B. 干冰
- C. 火碱
- D. 铁锈
4.规范的实验操作是确保实验成功的前提。下列实验操作中正确的是( )
- A. 稀释浓硫酸时,将水沿玻璃棒慢慢注入浓硫酸中,并不断搅拌
- B. 测定pH时,用玻璃棒蘸取待测液,滴在湿润的pH试纸上,颜色变化后与标准比色卡比较
- C. 排水法收集气体时,当导管口开始有气泡冒出时,立即收集
- D. 蒸发操作时,当有大量晶体析出时停止加热,用余热使水蒸发
5.下列说法不正确的是( )
- A. H﹣﹣既表示宏观元素,又表示微观原子
- B. H2﹣﹣"2"的意义表示2个氢原子
- C. H2O保持水的化学性质的最小粒子
- D.
 ﹣﹣由原子结构示意图可知,该元素在其化合物中显+2价
﹣﹣由原子结构示意图可知,该元素在其化合物中显+2价
6.某同学模拟自来水厂将黄泥水净化,并最终制得蒸馏水。实验流程如图所示,下列说法不正确的是( )
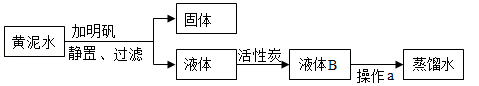

- A. 明矾在实验中的作用是促进悬浮杂质的沉降
- B. 加活性炭是利用了它具有吸附性的化学性质
- C. 证明液体B是硬水可采用加肥皂水的方法
- D. 操作a是利用了水与其他物质的沸点不同
7.如图为医用一次性注射器和药瓶的结构示意图。下列说法正确的是( )
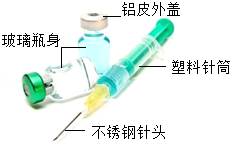

- A. 图中所示的材料包括两种金属材料和两种有机合成材料
- B. 药瓶的金属外盖通常采用铝制而不用铁制,是因为铝的活动性比铁强
- C. 用铝皮制外盖,体现了铝具有良好的延展性
- D. 制作针头的不锈钢是一种合金,属于纯争物
8.化学源于生活,服务于生活。以下说法不合理的是( )
- A. 铁、锌、磷、碘都是人体必需的微量元素
- B. 重金属中毒,可饮用大量牛奶、蛋清等缓解毒性
- C. 乙醇和氢气都是可再生能源
- D. 化学电池是一种将化学能直接转化为电能的装置
9.一种新型环保材料被塑胶跑道工程广泛应用,合成这种新材料的原料是二甲苯烷二异氰酸酯(其分子式为C15H10N2O2)。下列对该原料的说法正确的是( )
- A. 该物质中共含有29个原子,且氢、氧原子的个数比为5:1
- B. 物质中碳、氢、氮、氧元素的质量比为15:10:2:2
- C. 二甲苯烷二异氰酸酯属于有机高分子化合物
- D. 50g二甲苯烷二异氰酸酯中含氮元素的质量为5.6g
10.下列操作或做法不正确的是( )
- A. 油锅着火,立即用锅盖盖灭
- B. 点燃甲烷之前,要先检验气体的纯度
- C. 燃着的酒精灯不慎碰倒着火,应立即用湿布盖灭
- D. 不小心将少量浓硫酸溅到手上,应立即用大量水冲洗,再涂少量氢氧化钠溶液
11.甲醛(CH2O)是室内主要的空气污染物,打开人造板家具门时,闻到的刺激性气味就是甲醛的气味。硅藻泥因其粒子表面有无数微小的孔穴,可以净化空气。纳米级TiO2是一种新型光触媒材料,光照射下,其自身不变,却能促使甲醛转化为CO2和H2O。下列说法不正确的是( )
- A. 由上述材料可以归纳出甲醛的物理性质有:易挥发、有刺激性气味、有毒
- B. 硅藻泥净化空气的原理是:通过吸附污染物净化空气,与活性炭功能相似
- C. 纳米级TiO2作为光触媒材料净化空气的原理是:催化分解甲醛生成CO2和H2O
- D. 吸收、转化、降低室内污染物的浓度都可以改善室内空气质量
12.下列物质的用途与化学原理相符且化学方程式书写正确的是( )
- A. 用小苏打治疗胃酸过多:Na2CO3+2HCl=2NaC1+H2O+CO2↑
- B. 用稀盐酸除铁锈:6HCl+Fe2O3=2FeCl3+H2O
- C. 工业上用氨碱法制纯碱:2NaCl+2NH3+CO2+H2O=Na2CO3↓+2NH4C1
- D. 用食醋除水垢:2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑
13.下列实验利用提供的方案,能达到目的是( )
- A. 除去氯化钠溶液中的少量碳酸钠:加入过量的氯化钙溶液,过滤
- B. 鉴别氮气和氧气:将带火星的木条插入集气瓶中,看是否复燃
- C. 测定某溶液的酸碱度:滴入酚酞试液,观察溶液颜色变化
- D. 比较Fe、Cu、Ag的金属活动性:用AgNO3溶液分别与Fe、Cu反应,观察现象
14.我国古代科技十分发达,表中对古文献的解释不正确的是( )
| 序号 | 古文献 | 解释 |
| A | 曾青得铁则化为铜 | 可以用铁来冶炼铜 |
| B | 烧酒非古法也,自元时创始,其法用浓酒和糟入甑(指蒸锅),蒸令气上,用器承滴露 | 白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯 |
| C | 初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之 | 蔗糖的分离提纯采用了黄泥来吸附红糖中的色素 |
| D | 丹砂(HgS)烧之成水银,积变又成丹砂 | 加热时HgS熔融成液态,冷却时重新结晶为HgS晶体 |
- A. A
- B. B
- C. C
- D. D
15.海水晒盐可得到大量粗盐,某氯碱厂用电解精制饱和食盐水法制取NaOH,H2和Cl2还可用于制盐酸,工艺流程如图所示。下列说法不正确的是( )
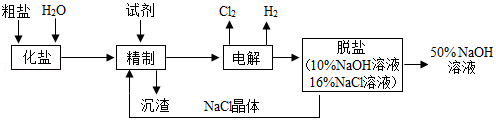

- A. H2和C12制盐酸,发生的化学反应为:H2+Cl22HCl
点燃 - B. 精制时去除粗盐中的Ca2+、Mg2+、SO
,依次加入的试剂顺序为:NaOH、Na2CO3、BaCl2、HCl2﹣ 4 - C. 电解时的反应为2NaC1+2H2O2NaOH+H2↑+Cl2↑,该过程电能转化为化学能
通电 - D. 脱盐工序是利用NaC1和NaOH在溶解度上的差异,通过蒸发结晶、趁热过滤分离得到NaC1晶体和NaOH溶液
16.可持续发展战略的重要内容之一是保护资源。下列关于金属资源的锈蚀与保护的说法中不正确的是( )
- A. 金属易被腐蚀,从结构看是因为最外层电子数少于4个,易失电子
- B. 在金属活动性顺序表中,位置越靠前的金属就越容易被锈蚀
- C. 铁制品表面涂油漆能防锈蚀的原因是隔绝了氧气和水
- D. 生铁制品在潮湿的空气中比在干燥空气中更容易生锈
17.如图装置(夹持装置已略)是利用铁生锈的原理测定空气中氧气的含量的实验。下列说法不
正确的是( )
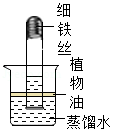
正确的是( )

- A. 实验得出的结论是氧气约占空气体积的
1 5 - B. 实验观察到的现象之一是铁丝表面生成一层红棕色的物质
- C. 实验中植物油的作用是防止试管外空气中的某些成分对实验的影响
- D. 本实验也可将细铁丝换成足量的细铜丝
18.比较、推理是化学学习中常用的方法。下表是根据一些事实推导出的结论,其中推导不合理的是( )
| 序号 | 事实 | 结论 |
| A | 碳的化学性质较稳定,氧气的化学性质较活泼 | 物质的组成和结构不同,其化学性质不同 |
| B | 相同大小的镁片和铁片分别与相同浓度的盐酸反应,镁产生气泡的速度快 | 参加反应的物质的性质是决定化学反应快慢的重要因素 |
| C | 4g氢氧化钠固体溶于46g水中得到50g溶液,溶液温度升高 | 物质发生化学反应有新物质生成,符合质量守恒定律,且伴随能量变化 |
| D | 常温下过氧化氢分解速率缓慢,加入二氧化锰后迅速分解 | 化学反应有快有慢,通过改变条件可以调控反应的快慢 |
- A. A
- B. B
- C. C
- D. D
19.向一定量盐酸和氯化铁溶液的混合物中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是( )
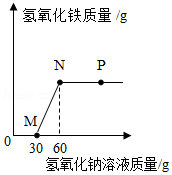

- A. M点表示的溶液中只含有一种溶质
- B. N点表示的溶液pH=7
- C. P点和N点表示的溶液中,NaC1的质量分数相同
- D. 从M点到N点溶液质量增加30g
20.为测定某化肥[(NH4)2SO4和NH4Cl组成]的含氮量,取5.6g于研钵中,向其中加入氢氧化钙充分反应,当加入3.7g氢氧化钙时恰好完全反应,此化肥中氮元素的质量分数为( )
- A. 25%
- B. 12.5%
- C. 30.4%
- D. 24%
21.化学不仅与公民的日常生活密切相关,也是推进社会文明和科学技术进步的重要力量。
(1)"智能蒸汽熨斗"可以定时加热,自动停止,自动调控蒸汽量大小,减少了向水槽中注水的次数。从微观角度看,水槽中水逐渐减少的原因是 ,据此推测可能影响微粒运动的快慢的因素是 。
(2)我国科学家研究表明,某种虫子以塑料为食,能将聚乙烯、聚苯乙烯等降解矿化为CO2。聚乙烯、聚苯乙烯属于 材料;昆虫降解塑料属于 变化,它可有效解决的环境问题是 。
(3)氢能是一种极具发展潜力的清洁能源。分解水制氢的一种原理如图所示:
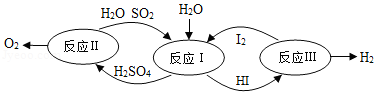
①反应I中,反应前后化合价发生改变的元素有 。
②反应Ⅲ的反应类型为 。
③理论上,每生成32gO2能得到 gH2。
(1)"智能蒸汽熨斗"可以定时加热,自动停止,自动调控蒸汽量大小,减少了向水槽中注水的次数。从微观角度看,水槽中水逐渐减少的原因是 ,据此推测可能影响微粒运动的快慢的因素是 。
(2)我国科学家研究表明,某种虫子以塑料为食,能将聚乙烯、聚苯乙烯等降解矿化为CO2。聚乙烯、聚苯乙烯属于 材料;昆虫降解塑料属于 变化,它可有效解决的环境问题是 。
(3)氢能是一种极具发展潜力的清洁能源。分解水制氢的一种原理如图所示:

①反应I中,反应前后化合价发生改变的元素有 。
②反应Ⅲ的反应类型为 。
③理论上,每生成32gO2能得到 gH2。
22.下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
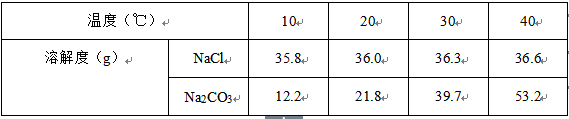
(1)氯化钠与碳酸钠溶解度相等的温度范围是 ;40℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较大的物质是 。
(2)写出一种将碳酸钠的不饱和溶液转化为饱和溶液的方法 。
(3)碳酸钠固体中混有少量的氯化钠,提纯碳酸钠的操作是:加水溶解→ → →过滤、洗涤、烘干。
(4)20℃时,取1.8g碳酸钠粉末加入试管中,先滴入几滴水,观察到粉末结块;再继续加入10mL水,振荡,用手触摸试管壁,感觉到发烫。下列有关说法正确的是 (填序号)。
A、滴入几滴水,粉末结块是由于生成了晶体(Na2CO3•10H2O),该晶体属于混合物
B、碳酸钠溶于水时放热
C、加入10mL水,振荡,会观察到固体部分溶解
D、向所得的溶液中加入几滴酚酞试液,溶液呈红色

(1)氯化钠与碳酸钠溶解度相等的温度范围是 ;40℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较大的物质是 。
(2)写出一种将碳酸钠的不饱和溶液转化为饱和溶液的方法 。
(3)碳酸钠固体中混有少量的氯化钠,提纯碳酸钠的操作是:加水溶解→ → →过滤、洗涤、烘干。
(4)20℃时,取1.8g碳酸钠粉末加入试管中,先滴入几滴水,观察到粉末结块;再继续加入10mL水,振荡,用手触摸试管壁,感觉到发烫。下列有关说法正确的是 (填序号)。
A、滴入几滴水,粉末结块是由于生成了晶体(Na2CO3•10H2O),该晶体属于混合物
B、碳酸钠溶于水时放热
C、加入10mL水,振荡,会观察到固体部分溶解
D、向所得的溶液中加入几滴酚酞试液,溶液呈红色
23.在宏观、微观、符号之间建立联系,是化学学科的特点。下表(图1)为元素周期表中的一部分。请参考元素①~⑦在表中的位置,回答问题:
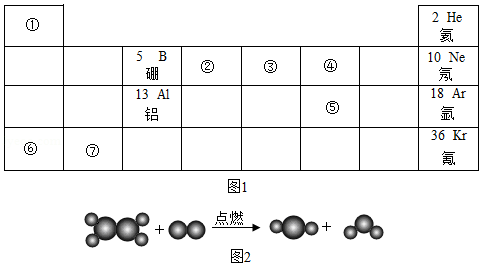
(1)根据④和⑤元素在周期表中的位置,得出两元素的原子具有相同的 。
(2)核磁共振(NMR)技术已广泛应用于医学领域。已知只有质子数为奇数的原子才有NMR现象。表中①~⑦元素的原子能产生NMR现象的有 (用元素符号表示)。
(3)甲、乙、丙、丁是由表中①~⑦元素中的两种或三种元素组成的化合物。
①甲是一种盐,在农业生产上常用作复合肥,该盐的化学式为 。
②乙是一种氧化物,常用作某些食品包装袋中的干燥剂。乙的俗称为 ,用化学方程式表示作干燥剂的原因 。
③丙是由两种元素组成的有机物,且两元素的质量比为6:1。如图2是丙在氧气中燃烧的微观示意图,该反应的化学方程式为 。
④丁是一种酸,常温下不稳定,容易发生如下分解反应:3 =HNO3+2NO↑+H2O,丁的化学式为 。

(1)根据④和⑤元素在周期表中的位置,得出两元素的原子具有相同的 。
(2)核磁共振(NMR)技术已广泛应用于医学领域。已知只有质子数为奇数的原子才有NMR现象。表中①~⑦元素的原子能产生NMR现象的有 (用元素符号表示)。
(3)甲、乙、丙、丁是由表中①~⑦元素中的两种或三种元素组成的化合物。
①甲是一种盐,在农业生产上常用作复合肥,该盐的化学式为 。
②乙是一种氧化物,常用作某些食品包装袋中的干燥剂。乙的俗称为 ,用化学方程式表示作干燥剂的原因 。
③丙是由两种元素组成的有机物,且两元素的质量比为6:1。如图2是丙在氧气中燃烧的微观示意图,该反应的化学方程式为 。
④丁是一种酸,常温下不稳定,容易发生如下分解反应:3 =HNO3+2NO↑+H2O,丁的化学式为 。
24.碳酸亚铁(FeCO3)是制取补血剂的原料,以下是用黄铜矿废液[溶质成份为Fe2(SO4)3、CuSO4及H2SO4]为原料,制备碳酸亚铁并回收铜的生产流程示意图:

已知:①Fe与Fe2(SO4)3溶液能发生反应生成FeSO4②溶液B中只有一种溶质
(1)步骤1中,试剂A为 ,加入过量A的目的是 ;反应过程中观察到的现象之一是有红色固体析出,写出该反应的化学方程式 。
(2)操作a的名称: 。
(3)步骤Ⅱ中,试剂C的化学式可能为 。
(4)步骤Ⅲ的目的是:除去“不溶物”中的另一种金属,回收得到纯净、干燥的铜。用化学方法回收铜的操作步骤为:加入过量的 、过滤、 、干燥;回收铜的物理方法为 。

已知:①Fe与Fe2(SO4)3溶液能发生反应生成FeSO4②溶液B中只有一种溶质
(1)步骤1中,试剂A为 ,加入过量A的目的是 ;反应过程中观察到的现象之一是有红色固体析出,写出该反应的化学方程式 。
(2)操作a的名称: 。
(3)步骤Ⅱ中,试剂C的化学式可能为 。
(4)步骤Ⅲ的目的是:除去“不溶物”中的另一种金属,回收得到纯净、干燥的铜。用化学方法回收铜的操作步骤为:加入过量的 、过滤、 、干燥;回收铜的物理方法为 。
25.某实验小组利用如图装置进行"燃烧条件的实验探究"。回答下列问题:
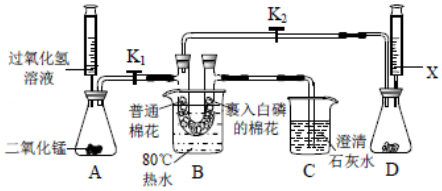
(1)实验前,检验装置A气密性的操作为 ;装置A中发生反应的化学方程式为 。
(2)实验1:将U形管放在盛有80℃热水的烧杯中,关闭K2、打开K1,从U形管左端管口鼓入O2。现象:右端裹有白磷的棉花先冒白烟,片刻后开始燃烧,另一端的普通棉花没有变化。实验1可以得出的燃烧条件为 。
(3)实验2:在上述实验1燃烧过程中,关闭K1、打开K2,从U形管左端管口鼓入气体Y。现象:燃烧着的棉花团很快熄灭,停止燃烧:继续鼓入气体Y,装置C中澄淸石灰水变浑浊。写出C中反应的化学方程式 ;装置D中注射器内盛放的试剂X可能为 。
(4)实验3:关闭K2、打开K1,再次鼓入O2,发现右端剩余的裹有白磷的棉花又能燃烧。对比实验2和3,可以得出的燃烧条件为 ;实验2同时能证明气体Y的性质为 ,利用该性质可用于 。
(5)该实验的优点为 。

(1)实验前,检验装置A气密性的操作为 ;装置A中发生反应的化学方程式为 。
(2)实验1:将U形管放在盛有80℃热水的烧杯中,关闭K2、打开K1,从U形管左端管口鼓入O2。现象:右端裹有白磷的棉花先冒白烟,片刻后开始燃烧,另一端的普通棉花没有变化。实验1可以得出的燃烧条件为 。
(3)实验2:在上述实验1燃烧过程中,关闭K1、打开K2,从U形管左端管口鼓入气体Y。现象:燃烧着的棉花团很快熄灭,停止燃烧:继续鼓入气体Y,装置C中澄淸石灰水变浑浊。写出C中反应的化学方程式 ;装置D中注射器内盛放的试剂X可能为 。
(4)实验3:关闭K2、打开K1,再次鼓入O2,发现右端剩余的裹有白磷的棉花又能燃烧。对比实验2和3,可以得出的燃烧条件为 ;实验2同时能证明气体Y的性质为 ,利用该性质可用于 。
(5)该实验的优点为 。
26.向Na2CO3溶液中加入一定量MgCl2溶液,出现白色沉淀。某同学经过过滤、洗涤、低温烘干得白色固体,并进行如下探究:
【猜测】白色固体可能是:①MgCO3;②Mg(OH)2;③ 。
【资料】MgCO3、Mg(OH)2加热易分解,生成对应的两种氧化物。
【实验1】(1)取适量白色固体,充分加热,将产生的气体通过装有无水硫酸铜的U形管,观察到现象为 ,则猜测①不成立。
(2)另取适量白色固体于试管中,加入 ,产生大量气泡,则猜测②不成立。有同学查阅资料得知上述固体应为碱式碳酸镁[aMgCO3•bMg(OH)2•4H2O],其不溶于水,加热易分解,工业上常用作阻燃剂。
【实验2】(3)为进一步确定白色固体的组成,该同学取适量白色固体,充分加热至质量不再改变,并使产生的气体全部缓缓通过如图所示装置,测定生成气体的质量。
实验中浓硫酸的作用 ,浓NaOH溶液的作用 。
实验数据:
①加热后剩余固体质量2.0g:②浓硫酸增重0.9g:③浓NaOH溶液增重1.76g。则a:b= 。
【拓展】(4)如果将甲、乙装置顺序颠倒,则a:b的值会 (填"变大"、"变小"或"不确定")。
(5)写出该碱式碳酸镁受热分解的化学方程式 。
(6)工业上用碱式碳酸镁作阻燃剂,其可能的原因有:①分解时吸热,降低了燃烧物的温度;②生成的二氧化碳、水等非可燃性气体,稀释了可燃物周围的氧气浓度;③ 。

【猜测】白色固体可能是:①MgCO3;②Mg(OH)2;③ 。
【资料】MgCO3、Mg(OH)2加热易分解,生成对应的两种氧化物。
【实验1】(1)取适量白色固体,充分加热,将产生的气体通过装有无水硫酸铜的U形管,观察到现象为 ,则猜测①不成立。
(2)另取适量白色固体于试管中,加入 ,产生大量气泡,则猜测②不成立。有同学查阅资料得知上述固体应为碱式碳酸镁[aMgCO3•bMg(OH)2•4H2O],其不溶于水,加热易分解,工业上常用作阻燃剂。
【实验2】(3)为进一步确定白色固体的组成,该同学取适量白色固体,充分加热至质量不再改变,并使产生的气体全部缓缓通过如图所示装置,测定生成气体的质量。
实验中浓硫酸的作用 ,浓NaOH溶液的作用 。
实验数据:
①加热后剩余固体质量2.0g:②浓硫酸增重0.9g:③浓NaOH溶液增重1.76g。则a:b= 。
【拓展】(4)如果将甲、乙装置顺序颠倒,则a:b的值会 (填"变大"、"变小"或"不确定")。
(5)写出该碱式碳酸镁受热分解的化学方程式 。
(6)工业上用碱式碳酸镁作阻燃剂,其可能的原因有:①分解时吸热,降低了燃烧物的温度;②生成的二氧化碳、水等非可燃性气体,稀释了可燃物周围的氧气浓度;③ 。

27.为减少或消除燃煤烟气中二氧化硫的含量,可向原煤中加入石灰石、碱石灰(NaOH和CaO的混合物)等脱硫剂。利用数字化实验测定燃煤烟气中二氧化硫的含量,得到如图所示的二氧化硫含量随时间的变化曲线。
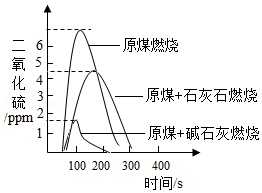
(1)结合图形和所学知识判断,下列说法正确的是 (填序号)
A、碱石灰的脱硫效率比石灰石的要高
B、将时间由300s变成400s,能提高碱石灰的脱硫效率
C、将原煤和脱硫剂粉碎、混合均匀,能提高脱硫效率
D、燃煤烟气中二氧化硫的浓度对脱硫速率没有影响
(2)某火力发电厂产生的燃煤烟气中SO2的平均含量为0.032g/L,若用碱石灰处理8×104L燃煤烟气,理论上需要碱石灰的质量至少为多少克?(写出计算过程)
已知:①氢氧化钠与二氧化硫反应转化为Na2SO3,氧化钙与二氧化硫反应转化为CaSO3。
②假设二氧化硫全部被吸收。

(1)结合图形和所学知识判断,下列说法正确的是 (填序号)
A、碱石灰的脱硫效率比石灰石的要高
B、将时间由300s变成400s,能提高碱石灰的脱硫效率
C、将原煤和脱硫剂粉碎、混合均匀,能提高脱硫效率
D、燃煤烟气中二氧化硫的浓度对脱硫速率没有影响
(2)某火力发电厂产生的燃煤烟气中SO2的平均含量为0.032g/L,若用碱石灰处理8×104L燃煤烟气,理论上需要碱石灰的质量至少为多少克?(写出计算过程)
已知:①氢氧化钠与二氧化硫反应转化为Na2SO3,氧化钙与二氧化硫反应转化为CaSO3。
②假设二氧化硫全部被吸收。
查看全部题目