下载高清试卷
【2020年浙江省温州市中考化学试卷】-第1页
试卷格式:2020年浙江省温州市中考化学试卷.PDF
试卷热词:最新试卷、2020年、浙江试卷、温州市试卷、化学试卷、九年级试卷、中考试卷、初中试卷
扫码查看解析
试卷题目
1.新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是( )
- A.
 柠檬汁
柠檬汁 - B.
 苹果汁
苹果汁 - C.
 西瓜汁
西瓜汁 - D.
 玉米汁
玉米汁
2.伏打电堆于1800年问世,它利用化学反应将化学能转化为电能,其中的一条化学反应是:2Zn+O2+2H2O═2Zn(OH)2,该反应属于( )
- A. 化合反应
- B. 分解反应
- C. 置换反应
- D. 复分解反应
3.中医药在治疗新冠肺炎中,为全球抗击疫情贡献了中国智慧。下列中药煎制步骤与实验室过滤操作原理相同的是( )
- A.
 冷水浸泡
冷水浸泡 - B.
 加热煎制
加热煎制 - C.
 取液弃渣
取液弃渣 - D.
 装袋保存
装袋保存
4.银器在使用过程中,因为发生化学反应:4Ag+O2+2H2S═2Ag2S+2H2O,产生的Ag2S使银器逐渐失去光泽。已知银的化合价为+1价,则Ag2S中S的化合价为( )
- A. +2
- B. ﹣2
- C. +1
- D. ﹣1
5.茶是人类健康的饮品之一,联合国将今年5月21日定为首个"国际茶日"。
(1)在泡茶过程中,会闻到茶特有的香气,这是因为分子 。
(2)茶氨酸(C7H14N2O3)是茶树特有的一种氨基酸。茶氨酸中氮元素与氧元素的质量比为 。
(1)在泡茶过程中,会闻到茶特有的香气,这是因为分子 。
(2)茶氨酸(C7H14N2O3)是茶树特有的一种氨基酸。茶氨酸中氮元素与氧元素的质量比为 。
6.18世纪前后,人们把元素等同于一种在化学变化中不可再分的物质,即单质。"燃素说"和"燃烧的氧化学说"一度成为科学家争论的焦点。
材料一:1723年,施塔尔提出"燃素说":燃素也是一种元素,燃素存在于一切可燃物中。如金属含有燃素,金属燃烧时金属释放燃素后成为金属灰(实际是金属氧化物);金属灰与燃素结合又会重新变回金属。
材料二:1766年,卡文迪许制得氢气并认为它是燃素;1773年,舍勒研究发现,可燃物燃烧需要一种他称为"火空气"的单质参与;1784年前,人们认为水是一种元素;1796年,普里斯特利制得可在"脱燃素气"中燃烧的"可燃空气",也把它当作燃素。
材料三:1777年,拉瓦锡建立了"燃烧的氧化学说",认为可燃物中不存在燃素;1801年,克鲁克香克证明了普里斯特利所谓的"可燃空气"是一氧化碳,从而结束了"燃素说"与"燃烧的氧化学说"之争。
(1)用你所学的燃烧条件分析,材料二中的"火空气"是 。
(2)材料三中的"可燃空气"一氧化碳属于纯净物中的 ,所以不可能是燃素。
(3)"燃素说"自提出后就引起争议。下列是当时科学家分析的事实或现象,用"燃素说"解释不合理的是 。(可多选)
材料一:1723年,施塔尔提出"燃素说":燃素也是一种元素,燃素存在于一切可燃物中。如金属含有燃素,金属燃烧时金属释放燃素后成为金属灰(实际是金属氧化物);金属灰与燃素结合又会重新变回金属。
材料二:1766年,卡文迪许制得氢气并认为它是燃素;1773年,舍勒研究发现,可燃物燃烧需要一种他称为"火空气"的单质参与;1784年前,人们认为水是一种元素;1796年,普里斯特利制得可在"脱燃素气"中燃烧的"可燃空气",也把它当作燃素。
材料三:1777年,拉瓦锡建立了"燃烧的氧化学说",认为可燃物中不存在燃素;1801年,克鲁克香克证明了普里斯特利所谓的"可燃空气"是一氧化碳,从而结束了"燃素说"与"燃烧的氧化学说"之争。
(1)用你所学的燃烧条件分析,材料二中的"火空气"是 。
(2)材料三中的"可燃空气"一氧化碳属于纯净物中的 ,所以不可能是燃素。
(3)"燃素说"自提出后就引起争议。下列是当时科学家分析的事实或现象,用"燃素说"解释不合理的是 。(可多选)
| 选项 | 事实或现象 | 用"燃素说"解释 |
| A | 金属成分比金属灰简单 | 因为金属燃烧时燃素从金属中逸出 |
| B | 加热金属灰通入氢气,金属灰变回金属 | 因为氢气是燃素 |
| C | 木炭与金属灰一起加热变回金属 | 因为木炭富含燃素 |
| D | 铜在空气中加热后质量增加 | 因为金属铜中含有燃素,加热后有燃素逸出 |
| E | 燃素(氢气)与脱燃素气(氧气)结合成为水 | 因为水是一种元素 |
7.小明和兴趣小组同学利用铁与硫酸铜溶液反应,比较铁与铜的活动性强弱,发现铁丝表面有红色物质析出,溶液颜色由蓝色逐渐变为浅绿色,但有时会出现溶液颜色变为淡黄绿色或淡蓝色,甚至无明显变化的异常现象。
(1)针对上述异常现象,他们认为可能是溶液浓度或反应时间不同导致。为进一步探究此问题,请你设计实验方案并写出实验步骤 。
建议:①实验可设计4~5组;②实验时每支试管取用硫酸铜溶液5毫升;③每次实验总时间为20分钟。实验室提供铁丝、质量分数为16%的硫酸铜溶液、蒸馏水及其它实验所需的仪器。
(2)列举一个因反应物浓度不同导致实验现象不同的例子,写出反应物及现象 。
(1)针对上述异常现象,他们认为可能是溶液浓度或反应时间不同导致。为进一步探究此问题,请你设计实验方案并写出实验步骤 。
建议:①实验可设计4~5组;②实验时每支试管取用硫酸铜溶液5毫升;③每次实验总时间为20分钟。实验室提供铁丝、质量分数为16%的硫酸铜溶液、蒸馏水及其它实验所需的仪器。
(2)列举一个因反应物浓度不同导致实验现象不同的例子,写出反应物及现象 。
8.小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁,实验流程如图:
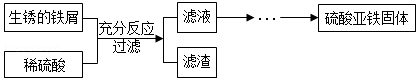
资料:①Fe2(SO4)3+Fe═3FeSO4;②硫酸亚铁容易被氧化为硫酸铁等物质。
(1)配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸 克。
(2)写出该实验中的一条化学方程式(除资料①中的反应外) 。
(3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目的是 。

资料:①Fe2(SO4)3+Fe═3FeSO4;②硫酸亚铁容易被氧化为硫酸铁等物质。
(1)配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸 克。
(2)写出该实验中的一条化学方程式(除资料①中的反应外) 。
(3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目的是 。
9.工业纯碱中含少量氯化钠。兴趣小组分别采用不同的方法测定工业纯碱样品中碳酸钠的质量分数。
(1)方法一:差量法。称取W克样品与足量的稀盐酸充分反应,生成的二氧化碳通过装有试剂X的乙装置,并利用测量乙装置增加的质量,求得样品中碳酸钠的质量分数。该方法中试剂X可选用 。
(2)方法二:沉淀法。称取15克样品完全溶解于水中配成60克样品溶液,取三个烧杯分三次进行实验,每次加入30克氯化钙溶液充分反应,过滤、洗涤、干燥所得的沉淀质量记录如表。计算样品中碳酸钠的质量分数。
(Na2CO3+CaCl2═CaCO3↓+2NaCl)
(3)请写出提高方法一测量精确度的操作建议(写出2条) 。

(1)方法一:差量法。称取W克样品与足量的稀盐酸充分反应,生成的二氧化碳通过装有试剂X的乙装置,并利用测量乙装置增加的质量,求得样品中碳酸钠的质量分数。该方法中试剂X可选用 。
(2)方法二:沉淀法。称取15克样品完全溶解于水中配成60克样品溶液,取三个烧杯分三次进行实验,每次加入30克氯化钙溶液充分反应,过滤、洗涤、干燥所得的沉淀质量记录如表。计算样品中碳酸钠的质量分数。
(Na2CO3+CaCl2═CaCO3↓+2NaCl)
| 烧杯1 | 烧杯2 | 烧杯3 | |
| 样品溶液(克) | 10 | 20 | 30 |
| 氯化钙溶液(克) | 30 | 30 | 30 |
| 沉淀质量(克) | 2 | 4 | 5 |
(3)请写出提高方法一测量精确度的操作建议(写出2条) 。

查看全部题目