下载高清试卷
【2020年山东省青岛市中考化学试卷】-第1页
试卷格式:2020年山东省青岛市中考化学试卷.PDF
试卷热词:最新试卷、2020年、山东试卷、青岛市试卷、化学试卷、九年级试卷、中考试卷、初中试卷
扫码查看解析
试卷题目
1.下列物质属于纯净物的是( )
- A. 不锈钢
- B. 碘酒
- C. 氢气
- D. 粗盐
2.适当增加蛋白质的摄入量,有助于提高人体免疫力。下列食物富含蛋白质的是( )
- A. 菠菜
- B. 鸡蛋
- C. 香蕉
- D. 馒头
3.下列液体去除油污效果最好的是( )
- A. 洗洁精
- B. 食盐水
- C. 白醋
- D. 自来水
4.蚊虫叮咬时释放出的液体中含有蚁酸(显酸性),为了减轻痒痛,可以在被叮咬处涂抹( )
| 物质名称 | 西红柿汁 | 柠檬汁 | 牛奶 | 小苏打水 |
| pH范围 | 4~5 | 2~3 | 6~7 | 8~9 |
- A. 西红柿汁
- B. 柠檬汁
- C. 牛奶
- D. 小苏打水
5.氧化铟(In2O3)是制造触摸屏的主要材料。氧化铟中铟(In)元素的化合价是( )
- A. +1
- B. +2
- C. +3
- D. +6
6.化学元素与人体健康息息相关。下列关于元素影响人体健康的表述不正确的是( )
- A. 缺氟易产生龋齿
- B. 缺硒会引起甲状腺肿大
- C. 老年人缺钙会导致骨质疏松
- D. 长期缺铁会引发缺铁性贫血
7.下列对一氧化碳性质的描述,属于化学性质的是( )
- A. 常温下为无色、无味的气体
- B. 极难溶于水
- C. 相同状况下,密度比空气略小
- D. 具有可燃性
8.下列物质由分子构成的是( )
- A. 氧气
- B. 金刚石
- C. 铜
- D. 氯化钠
9.下列化学用语书写正确的是( )
- A. 氧化钙 Ca2O
- B. 钠离子 Na+1
- C. 两个硫原子 S2
- D. 两个甲烷分子 2CH4
10.下列对宏观事实的微观解释不正确的是( )
- A. 水通电生成氢气和氧气﹣﹣化学反应中分子发生了改变
- B. 压瘪的乒乓球在热水中能鼓起来﹣﹣温度升高,分子变大
- C. 端午时节粽飘香﹣﹣分子不断运动
- D. 一氧化碳和二氧化碳的化学性质不同﹣﹣不同种分子的性质不同
11.空气是一种重要的资源。下列有关空气的说法正确的是( )
- A. 食品包装袋中充入氧气可延长食品的保质期
- B. 空气污染指数越高,空气质量越好
- C. 氧循环对维持自然界中物质、能量及生态的平衡有重要意义
- D. 分离液态空气得到氧气和氮气的过程中发生了化学变化
12.下列对实验现象的描述不正确的是( )
- A. 向铁锈中加入稀硫酸,振荡,铁锈逐渐溶解,溶液变为浅绿色
- B. 向氯化铜溶液中滴加氢氧化钠溶液,生成蓝色沉淀
- C. 灼烧纯羊毛线,产生烧焦羽毛的特殊气味
- D. 红热的细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
13.化肥和农药影响农作物的产量。下列说法正确的是( )
- A. 使用化肥越多,农作物产量越高
- B. 铵态氮肥与熟石灰混合使用可以提高肥效
- C. 大量使用农药会导致土壤和食品污染,因此要杜绝使用农药
- D. 适当增大蔬菜大棚内二氧化碳的浓度,可以促进蔬菜的光合作用
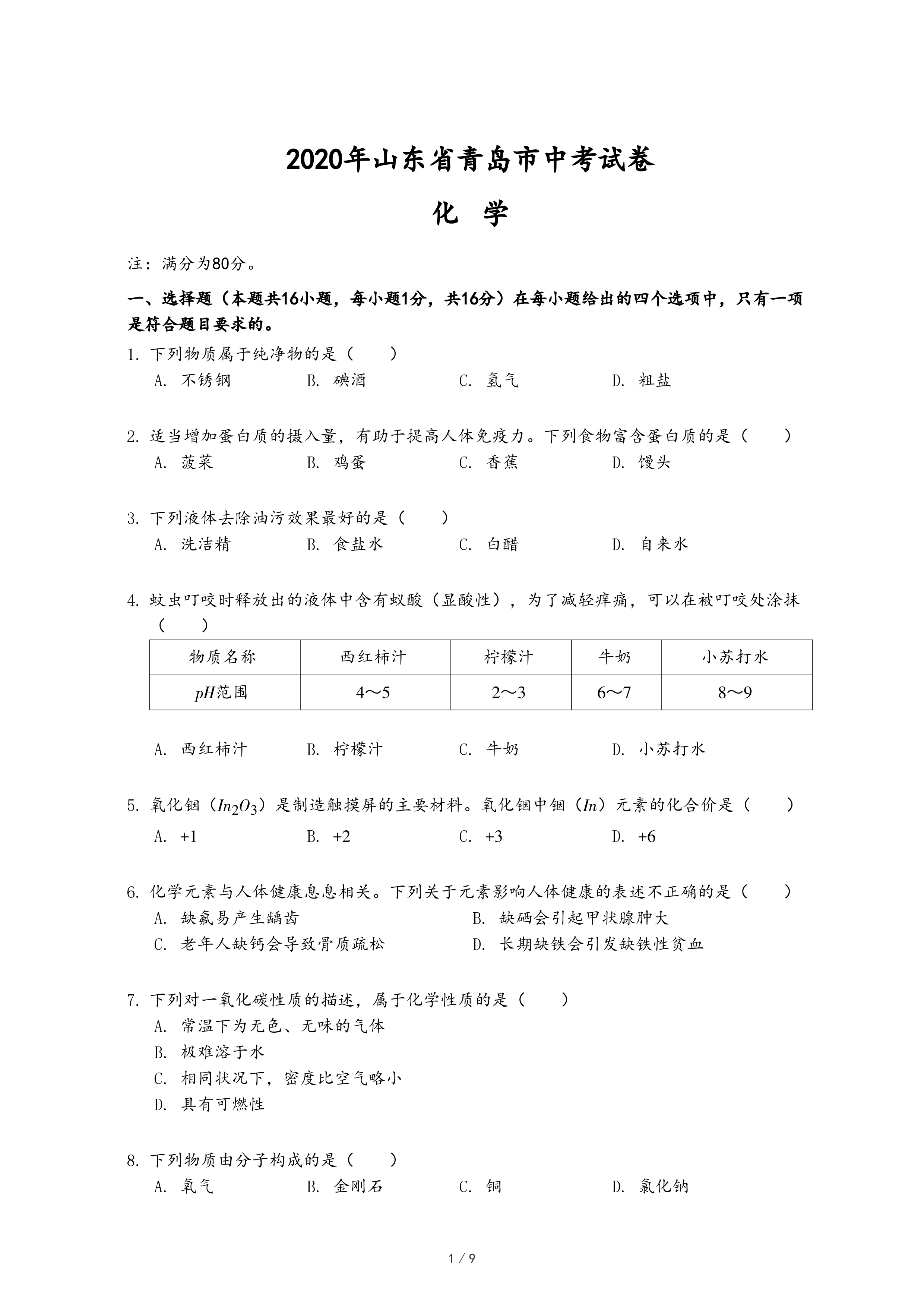
14.2019年诺贝尔化学奖颁给了约翰•古迪纳夫、斯坦利•威廷汉和吉野彰三位科学家,以表彰他们在锂离子电池领域的卓越贡献。如图是锂元素在周期表中的部分信息及原子结构示意图。下列说法正确的是( )

- A. 锂原子的核电荷数为 1
- B. 锂原子在化学反应中容易失去一个电子
- C. 锂元素的相对原子质量为6.941g
- D. 氯化锂的化学式为LiCl2
15.常用的医用酒精是体积分数为75%的乙醇溶液,可用于杀菌消毒。乙醇分子的模型如图所示,其中 代表碳原子,
代表碳原子, 代表氢原子,
代表氢原子, 代表氧原子。下列有关乙醇的说法不正确的是( )
代表氧原子。下列有关乙醇的说法不正确的是( )

 代表碳原子,
代表碳原子, 代表氢原子,
代表氢原子, 代表氧原子。下列有关乙醇的说法不正确的是( )
代表氧原子。下列有关乙醇的说法不正确的是( )
- A. 乙醇的化学式为C2H6O
- B. 乙醇的相对分子质量为46
- C. 乙醇中碳元素和氢元素的质量比为12:1
- D. 乙醇是一种有机物
16.工业上用氮气合成氨气(NH3),用氨气生产硝酸,相关反应如下:
①N2+3H2
2NH3
②4NH3+5O2
4X+6H2O
③2NO+O2═2NO2
④3NO2+H2O═2HNO3+NO
下列说法不正确的是( )
①N2+3H2
| 高温、高压 |
| 催化剂 |
②4NH3+5O2
| 催化剂 |
| △ |
③2NO+O2═2NO2
④3NO2+H2O═2HNO3+NO
下列说法不正确的是( )
- A. 反应①③属于化合反应
- B. 反应②中X的化学式为N2
- C. 反应④中氮元素的化合价既有升高又有降低
- D. NO和NO2可以相互转化
17.(多选)下列有关溶液的说法正确的是( )
- A. 溶液是溶质的粒子分散在溶剂中形成的均一、稳定的混合物
- B. 溶液加水稀释后溶质的质量减少
- C. 同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化
- D. 温度和溶剂的种类对物质的溶解性没有影响
18.逻辑推理是化学学习中常用的思维方法。下列推理正确的是( )
- A. 单质是由一种元素组成的纯净物,则由一种元素组成的纯净物一定是单质
- B. 中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
- C. 氧化物中含有氧元素,则含有氧元素的化合物一定是氧化物
- D. 置换反应有单质生成,则有单质生成的反应一定是置换反应
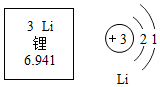
19.某同学为验证镁、铁、铜、银的金属活动性顺序,设计了如图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。
下列分析不正确的是( )

下列分析不正确的是( )
- A. 对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
- B. 分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
- C. 分析实验④的现象,能判断出铜和银的金属活动性强弱
- D. 分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
20.(多选)分离与提纯是获得物质的重要方法。下列实验操作能达到实验目的的是( )
| 实验目的 | 实验操作 | |
| A | 除去二氧化碳气体中的一氧化碳 | 通入适量氧气,点燃 |
| B | 除去氯化钠固体中的泥沙 | 加入足量的水溶解,过滤,蒸发结晶 |
| C | 除去氯化钙溶液中的盐酸 | 加入过量的碳酸钙固体,充分反应后过滤 |
| D | 除去碳酸钠溶液中的氯化钠 | 加入过量的硝酸银溶液,过滤 |
- A. A
- B. B
- C. C
- D. D
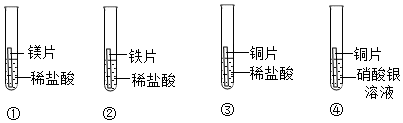
21.下列图象表示的化学反应过程,与实际情况相符合的是( )
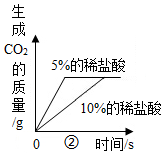

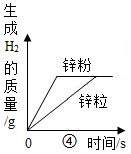
(说明:①至④对应的每组实验其他条件均相同)




(说明:①至④对应的每组实验其他条件均相同)
- A. 图①表示等质量等溶质质量分数的过氧化氢溶液分别在有、无MnO2的条件下反应
- B. 图②表示等质量的碳酸钙粉末分别与足量的溶质质量分数为5%和10%的稀盐酸反应
- C. 图③表示等质量的锌粉和铁粉分别与足量的等溶质质量分数的稀盐酸反应
- D. 图④表示等质量的锌粉和锌粒分别与足量的等溶质质量分数的稀盐酸反应
22.(多选)有一包固体样品,可能由氢氧化钠、硫酸钠、硝酸镁、硝酸铜、碳酸钙中的一种或几种物质组成。为确定该样品的组成,某兴趣小组同学取适量样品进行探究。探究过程如图:

根据以上信息判断,下列说法正确的是( )

根据以上信息判断,下列说法正确的是( )
- A. 白色沉淀a的成分是碳酸钙
- B. 该样品中一定存在氢氧化钠、硝酸镁、硫酸钠、碳酸钙,一定不存在硝酸铜
- C. 该样品中一定存在硫酸钠、碳酸钙、硝酸镁,一定不存在硝酸铜和氢氧化钠
- D. 若步骤①②保持不变,用硝酸钡溶液代替步骤③中的氢氧化钡溶液,则不需要进行步骤④的探究,也能确定该样品的组成
23.能源、环境和安全已成为人类日益关注的问题。请回答下列问题。
(1)目前世界上多数国家利用的能量主要来自煤、石油和 等化石燃料的燃烧。
(2)科技发展可促进新能源的开发利用。下列能源不属于新能源的是 (选填字母序号)。
A.煤 B.地热能 C.太阳能 D.核能
(3)2020年6月23日,北斗三号最后一颗全球组网卫星发射成功。此次卫星发射用的火箭推进剂为液氢和液氧,其反应产物无污染。写出氢气在氧气中燃烧的化学方程式 。
(4)燃料的充分燃烧对于节约能源、减少环境污染非常重要。汽车化油器将汽油喷成雾状进入内燃机气缸,使汽油充分燃烧。这是通过 的方法使汽油充分燃烧。
(5)加油站、化工厂、面粉厂等场所的空气中含有较多可燃性气体或粉尘,因此这些场所一定要严禁烟火,防止发生 。
(1)目前世界上多数国家利用的能量主要来自煤、石油和 等化石燃料的燃烧。
(2)科技发展可促进新能源的开发利用。下列能源不属于新能源的是 (选填字母序号)。
A.煤 B.地热能 C.太阳能 D.核能
(3)2020年6月23日,北斗三号最后一颗全球组网卫星发射成功。此次卫星发射用的火箭推进剂为液氢和液氧,其反应产物无污染。写出氢气在氧气中燃烧的化学方程式 。
(4)燃料的充分燃烧对于节约能源、减少环境污染非常重要。汽车化油器将汽油喷成雾状进入内燃机气缸,使汽油充分燃烧。这是通过 的方法使汽油充分燃烧。
(5)加油站、化工厂、面粉厂等场所的空气中含有较多可燃性气体或粉尘,因此这些场所一定要严禁烟火,防止发生 。
24.水和溶液在生活、生产中应用广泛。请回答下列问题。
(1)水的天然循环既实现了水的自身净化,又完成了水资源的重新分配。水在天然循环过程中发生了 (选填“物理”或“化学”)变化。
(2)对天然水进行净化处理,可以得到自来水,将自来水进一步净化处理得到可直接饮用的水。机场、车站等公共场所设有许多直饮水机,其处理水的过程如图所示。
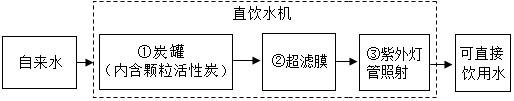
图中①对应的作用是 (选填字母序号,下同),③对应的作用是 。
A.杀菌消毒
B.过滤
C.吸附杂质
D.蒸馏
(3)含有较多可溶性钙、镁矿物质的天然水称为硬水。生活中为了降低水的硬度并杀菌消毒,可采用的方法是 。
(4)溶液对于生命活动具有重要意义。某同学出现低血糖症状时,校医给他喝了一瓶质量为200g溶质质量分数为25%的葡萄糖水,快速补充糖分。这瓶葡萄糖水中溶质的质量为 g。
(5)如图是氯化钠和硝酸钾两种固体的溶解度曲线,据图分析:
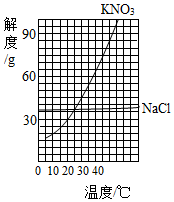
①溶解度受温度影响较大的物质是 。
②若硝酸钾晶体中含有少量的氯化钠杂质,可采用 的方法提纯硝酸钾。
(1)水的天然循环既实现了水的自身净化,又完成了水资源的重新分配。水在天然循环过程中发生了 (选填“物理”或“化学”)变化。
(2)对天然水进行净化处理,可以得到自来水,将自来水进一步净化处理得到可直接饮用的水。机场、车站等公共场所设有许多直饮水机,其处理水的过程如图所示。

图中①对应的作用是 (选填字母序号,下同),③对应的作用是 。
A.杀菌消毒
B.过滤
C.吸附杂质
D.蒸馏
(3)含有较多可溶性钙、镁矿物质的天然水称为硬水。生活中为了降低水的硬度并杀菌消毒,可采用的方法是 。
(4)溶液对于生命活动具有重要意义。某同学出现低血糖症状时,校医给他喝了一瓶质量为200g溶质质量分数为25%的葡萄糖水,快速补充糖分。这瓶葡萄糖水中溶质的质量为 g。
(5)如图是氯化钠和硝酸钾两种固体的溶解度曲线,据图分析:

①溶解度受温度影响较大的物质是 。
②若硝酸钾晶体中含有少量的氯化钠杂质,可采用 的方法提纯硝酸钾。
25.近年来,我国高铁飞速发展,已成为世界上唯一高铁成网运行的国家。请回答下列问题。
(1)制造高铁列车使用了多种材料。下列高铁列车的部件中,其主要材料属于金属材料的是 (选填字母序号)。
A.玻璃车窗
B.镁铝合金车体
C.塑料小桌板
D.涤纶座套
(2)高铁电路多用铜质导线,这是利用了铜的延展性和 性。
(3)高铁刹车片由合金锻钢制作,时速300公里以上的列车紧急制动时,轮毂盘面和刹车片的温度瞬间达到700℃以上,合金锻钢应该具备耐磨和 等特性。
(4)建造高铁需要消耗大量的铝、铁等金属。工业炼铁的原理是氧化铁(Fe2O3)和一氧化碳在高温条件下反应,其化学方程式为 。
(5)车身表面烤漆不仅美观,还能起到防锈的作用。其防锈的原理是 。
(6)目前世界上已有50%以上的铁得到了回收利用。回收利用废旧金属的社会意义是 (写出一条即可)。
(1)制造高铁列车使用了多种材料。下列高铁列车的部件中,其主要材料属于金属材料的是 (选填字母序号)。
A.玻璃车窗
B.镁铝合金车体
C.塑料小桌板
D.涤纶座套
(2)高铁电路多用铜质导线,这是利用了铜的延展性和 性。
(3)高铁刹车片由合金锻钢制作,时速300公里以上的列车紧急制动时,轮毂盘面和刹车片的温度瞬间达到700℃以上,合金锻钢应该具备耐磨和 等特性。
(4)建造高铁需要消耗大量的铝、铁等金属。工业炼铁的原理是氧化铁(Fe2O3)和一氧化碳在高温条件下反应,其化学方程式为 。
(5)车身表面烤漆不仅美观,还能起到防锈的作用。其防锈的原理是 。
(6)目前世界上已有50%以上的铁得到了回收利用。回收利用废旧金属的社会意义是 (写出一条即可)。
26.实验是进行科学探究的重要方式。同学们设计实验探究二氧化碳的性质,请你参与探究并填空。
【实验记录与分析】
【反思与拓展】
(1)依据实验一的结论,写出二氧化碳的一条重要用途 。
(2)由实验二的结论分析得出:实验室中保存氢氧化钠要注意 。
(3)在设计上述三组对比实验时,都只改变一个影响因素,保持其他因素不变,这是运用了科学探究中的 方法。
【实验记录与分析】
| 实验一 | 实验二 | 实验三 | |
| 实验操作 | 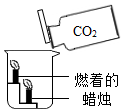 |  |  |
| 实验现象 | 蜡烛火焰 | 软塑料瓶变瘪程度较大的是 (选填“甲”或“乙”) | 干石蕊纸花不变色,湿石蕊纸花变红色 |
| 实验结论 | ①二氧化碳的密度比空大;②二氧化碳既不能燃烧,也不能支持燃烧 | 二氧化碳能与氢氧化钠发生反应 |
【反思与拓展】
(1)依据实验一的结论,写出二氧化碳的一条重要用途 。
(2)由实验二的结论分析得出:实验室中保存氢氧化钠要注意 。
(3)在设计上述三组对比实验时,都只改变一个影响因素,保持其他因素不变,这是运用了科学探究中的 方法。
27.实验室制取气体时需要的部分装置如图所示,请回答下列问题。

【信息】二氧化碳不易溶于饱和碳酸氢钠溶液。
(1)实验室中可用过氧化氢溶液与二氧化锰制取氧气,反应的化学方程式为 ,应选用的发生装置是 (选填装置字母序号)。
(2)实验室中用石灰石和稀盐酸制取一瓶干燥、纯净的二氧化碳气体,所选装置的连接顺序为:气体发生装置→ → →D(选填装置字母序号)。
(3)确定实验室制取气体的反应原理时,下列因素中不需要考虑的是 (选填字母序号)。
A.药品容易获得,能生成所要制取的气体 B.反应条件易于控制,反应速率适中 C.操作简便易行,安全可靠,节能环保
D.所要制取气体的颜色和气味

【信息】二氧化碳不易溶于饱和碳酸氢钠溶液。
(1)实验室中可用过氧化氢溶液与二氧化锰制取氧气,反应的化学方程式为 ,应选用的发生装置是 (选填装置字母序号)。
(2)实验室中用石灰石和稀盐酸制取一瓶干燥、纯净的二氧化碳气体,所选装置的连接顺序为:气体发生装置→ → →D(选填装置字母序号)。
(3)确定实验室制取气体的反应原理时,下列因素中不需要考虑的是 (选填字母序号)。
A.药品容易获得,能生成所要制取的气体 B.反应条件易于控制,反应速率适中 C.操作简便易行,安全可靠,节能环保
D.所要制取气体的颜色和气味
28.化学课堂上,同学们分小组合作探究碳酸钠的性质,请你参与探究并填空。
【实验记录与分析】
【反思与拓展】
(1)甲同学分析实验一得出:盐溶液 (选填“一定”或“不一定”)显中性。
(2)乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有 。
(3)丙同学对比实验三和实验四的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是 。
【实验记录与分析】
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 实验操作 |  |  |  |  |
| 实验现象 | 溶液由无色变为红色 | 生成白色沉淀 | 生成白色沉淀 | |
| 实验结论 | 碳酸钠溶液显 性 | 碳酸钠能与盐酸发生反应 | 碳酸钠能与氢氧化钙发生反应 |
【反思与拓展】
(1)甲同学分析实验一得出:盐溶液 (选填“一定”或“不一定”)显中性。
(2)乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有 。
(3)丙同学对比实验三和实验四的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是 。
29.回收利用废旧金属具有重要意义。某机械厂金属废料的成分是Zn、Cu、ZnO和CuO,某化学小组利用该金属废料回收铜并制取氧化锌和硫酸铜。请回答下列问题。
【活动一】回收铜并制取氧化锌,实验方案如图:
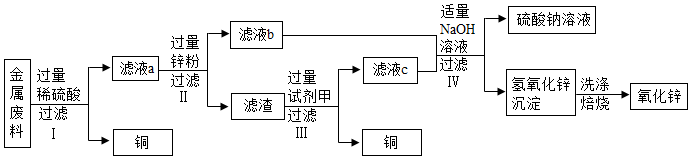
(1)步骤Ⅰ所得滤液a中溶质的成分是 (填写化学式)。
(2)步骤Ⅲ加入试剂甲的名称是 。
(3)步骤Ⅳ加入适量NaOH溶液的目的是 。
【活动二】利用活动一回收的铜制取硫酸铜,设计方案如下:
方案A:Cu
CuO
CuSO4
方案B:Cu
CuSO4
【信息】Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
(4)方案A中氧化铜与稀硫酸反应的化学方程式为 。
(5)小组同学从绿色化学的视角分析方案B不合理,理由是 (写出一条即可)。
【活动一】回收铜并制取氧化锌,实验方案如图:

(1)步骤Ⅰ所得滤液a中溶质的成分是 (填写化学式)。
(2)步骤Ⅲ加入试剂甲的名称是 。
(3)步骤Ⅳ加入适量NaOH溶液的目的是 。
【活动二】利用活动一回收的铜制取硫酸铜,设计方案如下:
方案A:Cu
△ |
| O2 |
稀硫酸 |
方案B:Cu
△ |
| 浓硫酸 |
【信息】Cu+2H2SO4(浓)
| △ |
(4)方案A中氧化铜与稀硫酸反应的化学方程式为 。
(5)小组同学从绿色化学的视角分析方案B不合理,理由是 (写出一条即可)。
30.2020年6月8日是第12个“世界海洋日”,海洋是巨大的资源宝库。某课题小组模拟工业海水提镁的流程,在实验室制取生产镁的原料﹣﹣氯化镁,设计方案如图:

【信息】
1.海水和苦卤中都含有NaCl、Na2SO4、MgCl2、CaCl2、KCl等。
2.苦卤是海水晒盐后剩余的溶液。
3.下表是某品牌不同碱的价格。
请分析与计算。
(1)海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是 。
(2)在工业生产中为了降低成本,试剂X最好选择表格中的 。
(3)该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是 。
(4)小组同学按上述方案进行了实验,并制得19.0g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤Ⅲ中氯化镁没有损失,求步骤Ⅱ中消耗稀盐酸的质量。(写出计算步骤)

【信息】
1.海水和苦卤中都含有NaCl、Na2SO4、MgCl2、CaCl2、KCl等。
2.苦卤是海水晒盐后剩余的溶液。
3.下表是某品牌不同碱的价格。
| 试剂 | NaOH | Ca(OH)2 | Ba(OH)2 | KOH |
| 价格(元/吨) | 2400 | 850 | 5300 | 5500 |
请分析与计算。
(1)海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是 。
(2)在工业生产中为了降低成本,试剂X最好选择表格中的 。
(3)该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是 。
(4)小组同学按上述方案进行了实验,并制得19.0g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤Ⅲ中氯化镁没有损失,求步骤Ⅱ中消耗稀盐酸的质量。(写出计算步骤)
查看全部题目