下载高清试卷
【2019-2020学年天津市和平区九年级(上)期中化学试卷】-第1页
试卷格式:2019-2020学年天津市和平区九年级(上)期中化学试卷.PDF
试卷热词:最新试卷、2019年、天津试卷、化学试卷、九年级上学期试卷、期中试卷、初中试卷
扫码查看解析
试卷题目
1.如图实验中的水发生了化学变化的是( )
- A.
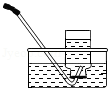 排水法收集氧气
排水法收集氧气 - B.
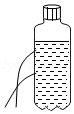 探究液体压强的特点
探究液体压强的特点 - C.
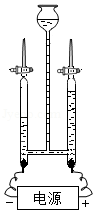 探究水的组成
探究水的组成 - D.
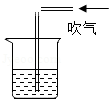 探究流体压强与流速的关系
探究流体压强与流速的关系
2.下列实验操作规范的是( )
- A.
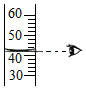 量取液体
量取液体 - B.
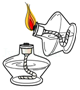 引燃酒精灯
引燃酒精灯 - C.
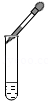 滴加试剂
滴加试剂 - D.
 检验氧气
检验氧气
3.有关空气的叙述中,正确的是( )
- A. 空气中的氧气具有可燃性,可用作火箭燃料
- B. 化工厂废气及汽车尾气,不会造成空气污染
- C. 稀有气体有广泛的用途,可制成多种用途的电光源
- D. 空气中的氮气与氧气体积比约为5:1
4.下列物质按照混合物、氧化物、单质顺序排列的是( )
- A. 空气、二氧化锰、氧气
- B. 海水、氯酸钾、氢气
- C. 氧化铁、锰酸钾、水
- D. 硫酸铜、高锰酸钾、二氧化碳
5.垃圾分类回收是绿色新时尚,矿泉水瓶可归为( )
- A. 厨余垃圾
- B. 有害垃圾
- C. 其他垃圾
- D. 可回收垃圾
6.硒元素具有抗衰老、抑制癌细胞生长的功能,其原子结构示意图及在元素周期表中的信息如图,下列说法错误的是( )
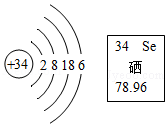

- A. 硒原子核内有34个质子
- B. 硒元素的相对原子质量是78.96g
- C. 硒元素位于元素周期表中第四周期
- D. 硒元素在某些化合物中可显﹣2价
7.下列说法不正确的是( )
- A. 细铁丝在氧气中燃烧时,火星四射,生成黑色固体
- B. 红磷在空气中燃烧产生大量的白雾
- C. 硫在氧气中燃烧生成有刺激性气味的气体
- D. 木炭在氧气中燃烧,生成无色气体
8.对于下列事实的微观解释错误的是( )
- A. 变瘪的乒乓球放入热水中能鼓起来﹣﹣分子的种类变多
- B. 一滴水中约有1.67×1021个水分子﹣﹣分子的质量和体积都很小
- C. 切开成熟的菠萝蜜能闻到浓浓的香味﹣﹣分子在不断地运动
- D. 6000L氧气加压后可装入40L的钢瓶﹣﹣分子间的间隔变小
9.蔗糖(C12H22O11)是一种常用的食品甜味剂。下列关于蔗糖的说法正确的是( )
- A. 蔗糖的相对分子质量为352
- B. 蔗糖中含有45个原子
- C. 蔗糖中氢元素的质量分数最高
- D. 蔗糖是由碳、氢、氧三种元素组成
10.下列图象能正确反映其变化过程的是( )
- A.
 在密闭容器中用红磷测定空气中氧气的含量
在密闭容器中用红磷测定空气中氧气的含量 - B.
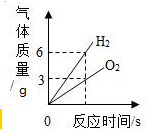 电解水生成气体的质量
电解水生成气体的质量 - C.
 镁在装有空气的密闭容器内燃烧
镁在装有空气的密闭容器内燃烧 - D.
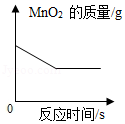 用氯酸钾和二氧化锰混合加热制取氧气
用氯酸钾和二氧化锰混合加热制取氧气
11.推理是常用的学习方法。下列推理不正确的是( )
- A. 红磷和木炭都可以在空气中燃烧,所以也可用木炭代替红磷测定空气中O2的含量
- B. 由一种元素组成的纯净物一定是单质,所以单质一定只含有一种元素
- C. 某物质在空气中燃烧生成水,所以该物质中一定含有氢元素
- D. 同种元素的原子质子数相同,则质子数相同的原子一定是同种元素
12.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示,下列说法正确的是( )


- A. 该反应一定属于置换反应
- B. 戊一定是该反应的催化剂
- C. 参加反应的乙、丙的质量比一定为48:23
- D. 该反应中甲、丁的相对分子质量之比一定为44:27
13.某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示。下列关于该过程的说法正确的是( )
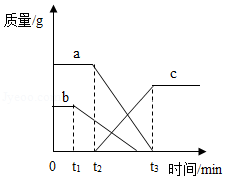

- A. c可以代表氧气
- B. t2时刻,O2开始产生
- C. t1时刻,KMnO4开始分解
- D. 起催化作用物质的质量一直保持不变
14.在反应A+3B→2C+2D中,已知A和B的式量之比为7:8,当2.8gA与一定量B恰好完全反应后,生成3.6gD,则生成C的质量为( )
- A. 9.6g
- B. 4.4g
- C. 6.8g
- D. 8.8g
15.将氯酸钾和二氧化锰均匀混合后分成两份,第一份14g加热至完全反应后,得固体9.2g,第二份21g加热一段时间后,测得剩余固体中二氧化锰占15%。可得氧气质量是( )
- A. 7.2g
- B. 11.8g
- C. 3.5g
- D. 9.6g
16.化学用语是学习化学的重要工具,是国际通用的化学语言。
(1)请用化学用语填空:
①镁元素 ;②三个氧原子 ;③五个二氧化硫分子 ;④两个氢氧根离子 。
(2)符号“3Ca2+”中的“3”表示 ,“Ca2+”表示 。
(1)请用化学用语填空:
①镁元素 ;②三个氧原子 ;③五个二氧化硫分子 ;④两个氢氧根离子 。
(2)符号“3Ca2+”中的“3”表示 ,“Ca2+”表示 。
17.下图是元素周期表的一部分,试回答下列问题
(1)写出①中原子结构示意图 。
(2)氯原子的最外层电子数是 ,与其化学性质相似的是 元素。
(3)②所示元素与③所示元素形成化合物的化学式是 。
(4)利用锂与水的反应可制成锂水电池,作为潜艇的储备电源。已知锂与水反应生成一种氢氧化物和一种可燃性气体,请写出该反应的化学反应方程式 。
(5)地壳中含量最多的金属元素位于周期表的第 周期。
| 第一周期 | 1H | 2He | ||||||
| 第二周期 | 3Li | 4He | 4Be | ① | 7N | 8O | 9F | 10Ne |
| 第三周期 | ② | 12Mg | 13Al | 14Si | 15P | ③ | 17Cl | 18Ar |
(1)写出①中原子结构示意图 。
(2)氯原子的最外层电子数是 ,与其化学性质相似的是 元素。
(3)②所示元素与③所示元素形成化合物的化学式是 。
(4)利用锂与水的反应可制成锂水电池,作为潜艇的储备电源。已知锂与水反应生成一种氢氧化物和一种可燃性气体,请写出该反应的化学反应方程式 。
(5)地壳中含量最多的金属元素位于周期表的第 周期。
18.水是生命之源!“珍惜水、节约水、爱护水”是每个公民应尽的义务和责任。
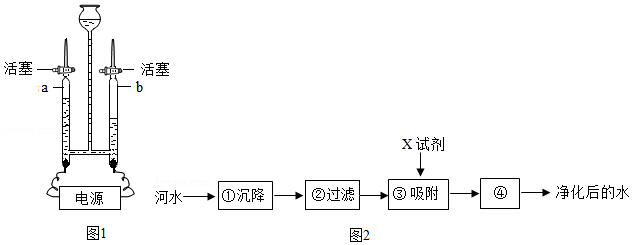
(1)用如图1所示装置进行电解水的实验,a、b两玻璃管中收集到的气体质量比为 。反应的化学反应方程式为 ,该实验证明水是由 组成的;
(2)饮用硬度过大的水不利于人体健康,在生活中可用 区分硬水和软水;
3)如图2是自来水厂净化水的主要步骤,有关说法错误的是 (填字母)
A.步骤①中可加入明矾作絮凝剂
B.X试剂可以是活性炭
C.步骤④的作用是消毒杀菌
D.净化后的水为纯净物
(4)在水的净化过程中常加入明矾,明矾的作用是 。
(5)②中操作规范的是 (填标号)
a.用玻璃棒引流
b.滤纸边缘高出漏斗
c.漏斗末端颈尖未紧靠烧杯内壁
d.将滤纸湿润,使其紧贴漏斗内壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度

(1)用如图1所示装置进行电解水的实验,a、b两玻璃管中收集到的气体质量比为 。反应的化学反应方程式为 ,该实验证明水是由 组成的;
(2)饮用硬度过大的水不利于人体健康,在生活中可用 区分硬水和软水;
3)如图2是自来水厂净化水的主要步骤,有关说法错误的是 (填字母)
A.步骤①中可加入明矾作絮凝剂
B.X试剂可以是活性炭
C.步骤④的作用是消毒杀菌
D.净化后的水为纯净物
(4)在水的净化过程中常加入明矾,明矾的作用是 。
(5)②中操作规范的是 (填标号)
a.用玻璃棒引流
b.滤纸边缘高出漏斗
c.漏斗末端颈尖未紧靠烧杯内壁
d.将滤纸湿润,使其紧贴漏斗内壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
19.写出下列反应的化学方程式
(1)磷粉在氧气中燃烧 。
(2)铁粉在氧气中燃烧 。
(3)氢气还原氧化铁的反应 。
(1)磷粉在氧气中燃烧 。
(2)铁粉在氧气中燃烧 。
(3)氢气还原氧化铁的反应 。
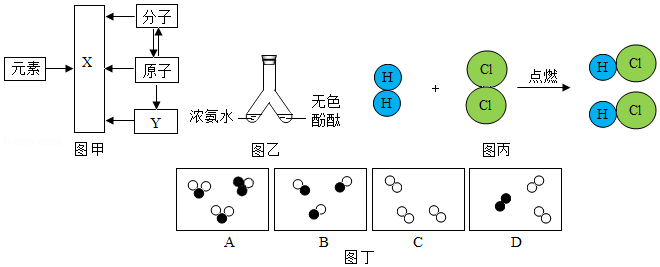
20.在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
(1)氢气、汞、氯化钠三种物质中,由原子直接构成的物质是 (填化学符号)。
(2)如图甲,X是 ,Y是 。
(3)如图乙所示,可观察到的现象是 ,此现象说明分子具有的性质是 。
(4)如图丙所示,该反应的化学方程式为 ,反应后生成的物质是 (填“混合物”或“纯净物”)。
(5)如图丁所示为气体分子的示意图,图中“●”和“〇”分别表示质子数不同的两种原子,其中表示化合物的是 (填字母)。
(1)氢气、汞、氯化钠三种物质中,由原子直接构成的物质是 (填化学符号)。
(2)如图甲,X是 ,Y是 。
(3)如图乙所示,可观察到的现象是 ,此现象说明分子具有的性质是 。
(4)如图丙所示,该反应的化学方程式为 ,反应后生成的物质是 (填“混合物”或“纯净物”)。
(5)如图丁所示为气体分子的示意图,图中“●”和“〇”分别表示质子数不同的两种原子,其中表示化合物的是 (填字母)。

21.A~G是初中化学已学过的7种物质,它们有如图所示的转化关系(部分产物己略去)。已知A、C是无色液体,D是一种黑色固体单质,F是一种能使澄清石灰水变浑浊的无色气体,G是一种紫黑色固体。
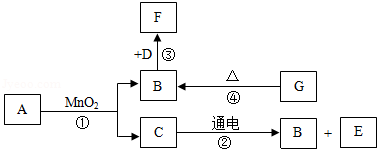
回答下列问题:
(1)写出E、G的化学式:E ,G 。
(2)写出的反应①化学方程式 。
(3)写出的反应③化学方程式 。

回答下列问题:
(1)写出E、G的化学式:E ,G 。
(2)写出的反应①化学方程式 。
(3)写出的反应③化学方程式 。
22.空气是人类赖以生存的宝贵资源。
(1)空气的用途:焊接金属时常用作保护气的是 (填化学式)。
(2)空气的成分:老师利用图甲装置测定空气中氧气的含量并结合现代传感器技术,测得过程中容器内气体压强、温度、氧气浓度的变化趋势如图乙所示。
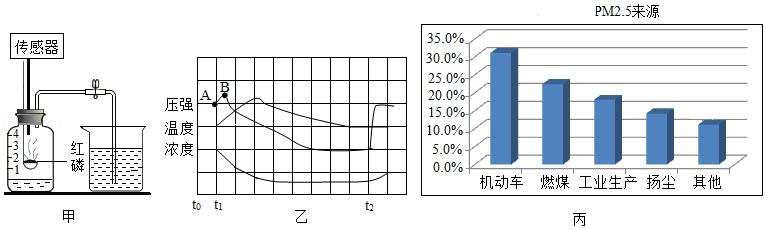
①t2时打开止水夹,最终集气瓶中水平面大约上升至刻度 处。
②结合曲线,解释AB段气体压强变化的原因是 。
(3)空气的保护:图丙是某地PM2.5来源分布图。据此,下列措施对减少PM2.5效果最不明显的是 。
A.减少汽车的保有量
B.用风能与太阳能发电替代燃煤发电
C.减少工业生产中二氧化碳的排放
(1)空气的用途:焊接金属时常用作保护气的是 (填化学式)。
(2)空气的成分:老师利用图甲装置测定空气中氧气的含量并结合现代传感器技术,测得过程中容器内气体压强、温度、氧气浓度的变化趋势如图乙所示。

①t2时打开止水夹,最终集气瓶中水平面大约上升至刻度 处。
②结合曲线,解释AB段气体压强变化的原因是 。
(3)空气的保护:图丙是某地PM2.5来源分布图。据此,下列措施对减少PM2.5效果最不明显的是 。
A.减少汽车的保有量
B.用风能与太阳能发电替代燃煤发电
C.减少工业生产中二氧化碳的排放
23.化学是一门以实验为基础的科学,根据如图所示装置,回答相关问题。
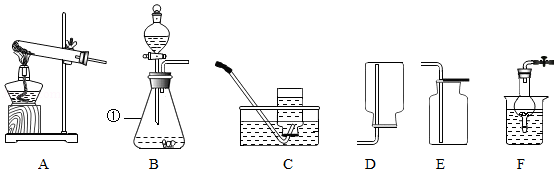
(1)图中标有序号①的仪器名称是 。
(2)实验室用双氧水和二氧化锰制取氧气,该反应的化学方程式是 ,若需收集瓶氧气用于铁丝燃烧的实验,应选择的发生与收集装置的组合是 (从A﹣E中选择,填字母),收集完毕,用玻璃片的 (填“光滑面”或“磨砂面”)盖住集气瓶口。
(3)装置F可以作为制取氢气的发生装置,相比B装置其主要优点是 ,其反应方程式为 。点燃氢气前必须验纯,为确保安全,最好选用装置 (填字母序号)所示方法收集氢气。
(4)用高锰酸钾制氧气,应选用的发生装置是 (填字母序号),该反应的化学方程式为 ,其中转化为氧气的氧元素与高锰酸钾中氧元素的质量之比是 。

(1)图中标有序号①的仪器名称是 。
(2)实验室用双氧水和二氧化锰制取氧气,该反应的化学方程式是 ,若需收集瓶氧气用于铁丝燃烧的实验,应选择的发生与收集装置的组合是 (从A﹣E中选择,填字母),收集完毕,用玻璃片的 (填“光滑面”或“磨砂面”)盖住集气瓶口。
(3)装置F可以作为制取氢气的发生装置,相比B装置其主要优点是 ,其反应方程式为 。点燃氢气前必须验纯,为确保安全,最好选用装置 (填字母序号)所示方法收集氢气。
(4)用高锰酸钾制氧气,应选用的发生装置是 (填字母序号),该反应的化学方程式为 ,其中转化为氧气的氧元素与高锰酸钾中氧元素的质量之比是 。
24.某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用如图装置完成表中实验:
(1)设置实验1的目的是 。
(2)表中所列3种催化剂的催化效果最佳的是 。
(3)写出KClO3分解的化学方程式: 。
(4)由实验1和实验4可知,KCl (填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集50mLO2,所需时间明显少于171s,解释原因: 。
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内 。
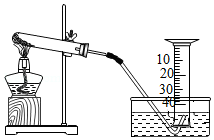
| 编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
| 实验1 | 5 | ﹣ | ﹣ | 171 |
| 实验2 | 5 | MnO2 | 0.5 | 49 |
| 实验3 | 5 | Fe2O3 | 0.5 | 58 |
| 实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是 。
(2)表中所列3种催化剂的催化效果最佳的是 。
(3)写出KClO3分解的化学方程式: 。
(4)由实验1和实验4可知,KCl (填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集50mLO2,所需时间明显少于171s,解释原因: 。
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内 。

25.蛋白质是由丙氨酸(C3H7NO2)等多种氨基酸构成的。根据丙氨酸的化学式计算:
(1)C3H7NO2的相对分子质量是 。
(2)丙氨酸中各元素的质量比C:H:N:O= 。
(3)丙氨酸中氮元素的质量分数为 (结果保留0.01%)
(4) g C3H7NO2中含有氢元素的质量是10.5g。
(1)C3H7NO2的相对分子质量是 。
(2)丙氨酸中各元素的质量比C:H:N:O= 。
(3)丙氨酸中氮元素的质量分数为 (结果保留0.01%)
(4) g C3H7NO2中含有氢元素的质量是10.5g。
26.文文想通过实验测定稀硫酸中硫酸的质量分数,他分四次向182.5g稀硫酸(包含硫酸和水)中加入含有杂质的锌粉(杂质不溶于硫酸也不与硫酸发生反应),记录所加锌粉质量与产生氢气的质量如下表所示:
(1)M的数值为 。
(2)请计算稀硫酸中硫酸所占的质量分数。
(3)含杂质的锌中锌的质量分数。
| 次数 | 1 | 2 | 3 | 4 |
| 锌粉质量/g | 5 | 5 | 5 | 5 |
| 氢气质量/g | M | 0.15 | 0.1 | 0 |
(1)M的数值为 。
(2)请计算稀硫酸中硫酸所占的质量分数。
(3)含杂质的锌中锌的质量分数。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解