下载高清试卷
【2019年江苏省泰州市中考化学试卷】-第1页
试卷格式:2019年江苏省泰州市中考化学试卷.PDF
试卷热词:最新试卷、2019年、江苏试卷、泰州市试卷、化学试卷、九年级试卷、中考试卷、初中试卷
扫码查看解析
试卷题目
1.下列变化属于物理变化的是( )
- A. 浓盐酸挥发
- B. 木柴燃烧
- C. 工业炼铁
- D. 有机肥腐熟
2.下列物质由分子构成的是( )
- A. 金
- B. 氨气
- C. 氯化镁
- D. 硫酸铜
3.下列物质可用作氮肥的是( )
- A. KCl
- B. Na2SO4
- C. CO(NH2 )2
- D. Ca3(PO4)2
4.下列用途中,主要利用物质化学性质的是( )
- A. 铜作导线
- B. 食品包装袋中充入氮气
- C. 干冰用于人工降雨
- D. 竹炭除冰箱中的异味
5.下列实验操作正确的是( )
- A.
 验满氧气
验满氧气 - B.
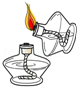 点燃酒精灯
点燃酒精灯 - C.
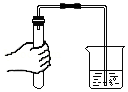 检查装置气密性
检查装置气密性 - D.
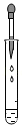 滴加液体
滴加液体
6.下列化学用语书写错误的是( )
- A. 五氧化二磷:P2O5
- B. 镁离子:Mg2+
- C. 2个钾原子:2K
- D. 3个氮分子:N3
7.下列物质属于氧化物的是( )
- A. 蒸馏水
- B. 氖气
- C. 硝酸钾
- D. 氢氧化钡
8.我国的北斗导航卫星系统采用铷原子钟,提供精确时间。如图是铷元素在元素周期表中的相关信息,下列说法正确的是( )
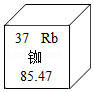

- A. 铷元素属于非金属元素
- B. 铷元素的相对原子质量为85.47g
- C. 铷原子的质子数等于中子数
- D. 铷元素的原子序数为37
9.化学与人类健康密切相关,下列说法正确的是( )
- A. 霉变大米经淘洗后可食用
- B. 人误食重金属盐中毒,可服蛋清减轻毒性
- C. 人体缺锌可引起佝偻病
- D. 补充维生素C可预防夜盲症
10.下列说法正确的是( )
- A. 将少量面粉和蔗糖分别加入适量的水中,均可形成均一、稳定的混合物
- B. 自来水生产过程中加入明矾,目的是杀菌消毒
- C. 用氯化钠固体配制50克10%的氯化钠溶液的主要步骤:计算、量取、溶解
- D. 向一定体积的气体加压,体积明显变小,可用微粒之间有空隙的性质来解释
11.(多选)有关物质的组成、构成与性质关系的说法正确的是( )
- A. 水和过氧化氢组成元素相同,故它们的化学性质相同
- B. 稀硫酸和盐酸溶液中都含有大量氢离子,故它们具有一些共同的化学性质
- C. 构成金刚石和石墨的原子相同但排列方式不同,故它们的物理性质不同
- D. 氢氧化铜和氢氧化钠都含有氢氧根离子,故它们都能使无色酚酞试液变红色
12.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
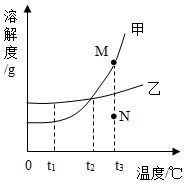

- A. t1℃时,甲、乙两物质的溶解度大小关系:甲>乙
- B. t2℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
- C. t3℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
- D. 将t1℃时甲、乙的饱和溶液升温至t3℃,所得甲、乙的溶液仍都是饱和溶液
13.下列说法正确的是( )
- A. 制作烟花常加入镁粉,原因是镁燃烧能发出耀眼的白光
- B. 通常情况下铝制品耐腐蚀,原因是铝不易发生化学反应
- C. 巴黎圣母院失火,消防队员用水灭火是为了降低可燃物的着火点
- D. 实验时,氯酸钾中加入少量高锰酸钾加热,发现产生氧气的速率加快,原因是高锰酸钾对氯酸钾分解起催化作用
14.下列有关物质的检验、鉴别以及分离、提纯的做法,正确的是( )
- A. 检验食品中是否含有淀粉:用碘化钾溶液
- B. 鉴别K2SO4和(NH4)2SO4两种固体:加熟石灰研磨
- C. 除去CaCO3固体中的少量Na2CO3:加入足量稀盐酸充分反应后过滤
- D. 分离Fe和CuSO4固体混合物:加入足量的水溶解,过滤
15.(多选)某化学兴趣小组进行了两组实验。实验一:如图1,将除去表面氧化膜的锌片插入到盛CuSO4溶液的烧杯中;实验二:如图2,用导线将除去表面氧化膜的铜片和锌片分别连接到电流表的正、负极,然后把铜片和锌片一起插入盛CuSO4溶液的烧杯中。下列说法正确的是( )
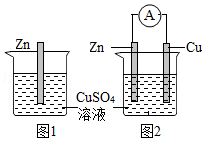

- A. 实验一观察到锌表面有红色物质析出,反应后溶液质量会减小
- B. 实验二观察到电流表指针发生了偏转
- C. 实验一和实验二都明显体现了化学能转化为电能
- D. 实验一和实验二从微观角度分析,都存在着电子的得失
16.化学与科技、生产、生活密切相关。
(1)某学校的营养早餐配料标签如图1所示,该配料中富含油脂的物质是 。当衣服上粘有油脂时,可以用洗衣粉除去,其去污原理是 。

(2)泰州是中国人民解放军海军的摇篮,138泰州舰上使用的
玻璃钢属于 材料;舰体在高盐的海水中易生锈,原因是海水中所含的 物质存在时会加速铁的锈蚀。
(3)利用植物秸秆、牲畜粪便等可制得沼气,沼气的主要成分甲烷在空气中完全燃烧的化学方程式为 ,推广使用沼气做燃料的优点是 (答1点即可)。
(4)一种创可贴中间有个凸起的小囊区,如图2。按贴伤口的同时,小囊区内的水和硝酸铵固体被挤破混合,利用硝酸铵固体溶解时温度 ,起到快速止血的作用。
(1)某学校的营养早餐配料标签如图1所示,该配料中富含油脂的物质是 。当衣服上粘有油脂时,可以用洗衣粉除去,其去污原理是 。

(2)泰州是中国人民解放军海军的摇篮,138泰州舰上使用的
玻璃钢属于 材料;舰体在高盐的海水中易生锈,原因是海水中所含的 物质存在时会加速铁的锈蚀。
(3)利用植物秸秆、牲畜粪便等可制得沼气,沼气的主要成分甲烷在空气中完全燃烧的化学方程式为 ,推广使用沼气做燃料的优点是 (答1点即可)。
(4)一种创可贴中间有个凸起的小囊区,如图2。按贴伤口的同时,小囊区内的水和硝酸铵固体被挤破混合,利用硝酸铵固体溶解时温度 ,起到快速止血的作用。
17.请回答下列实验问题:
(1)现提供下列装置:
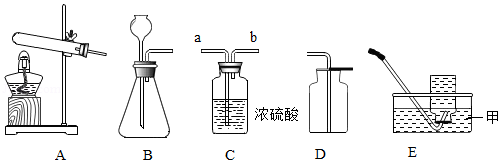
①如图E装置中,甲仪器的名称是 。
②实验室用KClO3和MnO2混合制O2,发生装置可选用 (填装置序号),用装置C干燥O2,气体由导管 端(填“a”或“b”)进入,用E装置收集O2的依据是 。
③英国化学家布莱克是第一个“捕捉”到CO2的人,实验室制备CO2的化学方程式为 ;1774年德国化学家贝格曼将CO2通入紫色石蕊试液中,发现试液由紫色变为红色,此反应的化学方程式为 。
(2)对一定质量的粗盐(含泥沙)进行初步提纯。
①实验的主要步骤:称量与溶解、过滤、蒸发;蒸发结束后用 (填仪器名称)将固体从蒸发皿转移到纸片上,比较食盐提纯前后的状态。
②下列有关蒸发过程说法正确的是 (填序号)。
a.蒸发时用玻璃棒不断搅拌
b.当蒸发皿中水分全部蒸干时,停止加热
c.蒸发时若有滤液溅出,则精盐质量将偏低
d.蒸发过程中,溶液中钠元素质量增大
(1)现提供下列装置:

①如图E装置中,甲仪器的名称是 。
②实验室用KClO3和MnO2混合制O2,发生装置可选用 (填装置序号),用装置C干燥O2,气体由导管 端(填“a”或“b”)进入,用E装置收集O2的依据是 。
③英国化学家布莱克是第一个“捕捉”到CO2的人,实验室制备CO2的化学方程式为 ;1774年德国化学家贝格曼将CO2通入紫色石蕊试液中,发现试液由紫色变为红色,此反应的化学方程式为 。
(2)对一定质量的粗盐(含泥沙)进行初步提纯。
①实验的主要步骤:称量与溶解、过滤、蒸发;蒸发结束后用 (填仪器名称)将固体从蒸发皿转移到纸片上,比较食盐提纯前后的状态。
②下列有关蒸发过程说法正确的是 (填序号)。
a.蒸发时用玻璃棒不断搅拌
b.当蒸发皿中水分全部蒸干时,停止加热
c.蒸发时若有滤液溅出,则精盐质量将偏低
d.蒸发过程中,溶液中钠元素质量增大
18.A~J是初中化学常见的物质,A是一种含有四种元素的盐,可用作治疗胃酸过多,其反应原理:A和B反应生成C、D和E三种物质,通过光合作用D和E反应生成F和G,煤气主要成分H在F中燃烧生成E,I和D反应只生成J,J常用于改良酸性土壤。
(1)G的化学式为 ,G中质量分数最大的元素是 。
(2)A的俗称是 ;A和B反应的化学方程式为 ,基本反应类型是 。
(3)I的用途是 (答1点即可);H在F中燃烧的化学方程式为 。
(4)改良后土壤浸出液的酸碱度可用 测定。
(1)G的化学式为 ,G中质量分数最大的元素是 。
(2)A的俗称是 ;A和B反应的化学方程式为 ,基本反应类型是 。
(3)I的用途是 (答1点即可);H在F中燃烧的化学方程式为 。
(4)改良后土壤浸出液的酸碱度可用 测定。
19.某化学兴趣小组学习了酸、碱、盐的知识后,对某些盐的性质开展了探究活动。
研究主题:探究FeCl3溶液加热、灼烧的变化
相关信息:酒精(C2H5OH)具有还原性,加热条件下能与Fe2O3反应;Fe和Fe3O4易被磁铁吸引,FeO是一种黑色固体,不能被磁铁吸引;Fe3O4能与盐酸反应,生成盐和水。
(一)实验一:将大约20mL饱和FeCl3溶液在蒸发皿中加热蒸发,沸腾后发现溶液中逐渐产生红褐色浑浊。
(1)FeCl3溶液呈黄色主要是因为溶液中含有铁离子,符号为 。
(2)加热时,FeCl3易与水反应生成红褐色物质和盐酸,写出反应的化学方程式: 。
(3)由实验启示,FeCl3溶液通过蒸发结晶的方式 (填“能”或“不能”)获得FeCl3固体。
(二)实验二:将实验一蒸发获得的红褐色固体转移到坩埚中灼烧,颜色由红褐色变为红棕色。
(4)此过程发生分解反应,除生成红棕色物质外,还生成水,反应的化学方程式: 。
(5)氢氧化镁、氢氧化铜等加热分解也能得到对应的金属氧化物,结合实验,从物质类别及其溶解性推断,通过加热分解 可生成对应的金属氧化物。
(三)实验三:小组同学用多根玻璃棒蘸取饱和FeCl3溶液于酒精灯火焰上灼烧,随着加热时间的持续,在1分钟内观察到玻璃棒表面颜色的变化依次为:黄色、红褐色、红棕色、黑色。
(6)实验三相对于实验一和实验二,优点是 (答1点即可)。
(7)同学们对黑色物质的成分产生了疑问。联系酒精的可燃性、还原性等相关性质,对黑色物质的成分提出了猜想,经讨论认为,可能是 和Fe3O4四种物质中的一种或几种。
(8)为了确定黑色物质的成分,收集黑色物质,进行了如下实验:
(四)拓展延伸
(9)配制FeCl3溶液时,为防止出现红褐色物质,可向其中滴加少量的 溶液。
(10)结合已学知识,从元素化合价变化的角度分析,Fe2O3发生还原反应时,反应前后铁元素化合价一般呈 (填“上升”或“下降”)的变化。
研究主题:探究FeCl3溶液加热、灼烧的变化
相关信息:酒精(C2H5OH)具有还原性,加热条件下能与Fe2O3反应;Fe和Fe3O4易被磁铁吸引,FeO是一种黑色固体,不能被磁铁吸引;Fe3O4能与盐酸反应,生成盐和水。
(一)实验一:将大约20mL饱和FeCl3溶液在蒸发皿中加热蒸发,沸腾后发现溶液中逐渐产生红褐色浑浊。
(1)FeCl3溶液呈黄色主要是因为溶液中含有铁离子,符号为 。
(2)加热时,FeCl3易与水反应生成红褐色物质和盐酸,写出反应的化学方程式: 。
(3)由实验启示,FeCl3溶液通过蒸发结晶的方式 (填“能”或“不能”)获得FeCl3固体。
(二)实验二:将实验一蒸发获得的红褐色固体转移到坩埚中灼烧,颜色由红褐色变为红棕色。
(4)此过程发生分解反应,除生成红棕色物质外,还生成水,反应的化学方程式: 。
(5)氢氧化镁、氢氧化铜等加热分解也能得到对应的金属氧化物,结合实验,从物质类别及其溶解性推断,通过加热分解 可生成对应的金属氧化物。
(三)实验三:小组同学用多根玻璃棒蘸取饱和FeCl3溶液于酒精灯火焰上灼烧,随着加热时间的持续,在1分钟内观察到玻璃棒表面颜色的变化依次为:黄色、红褐色、红棕色、黑色。
(6)实验三相对于实验一和实验二,优点是 (答1点即可)。
(7)同学们对黑色物质的成分产生了疑问。联系酒精的可燃性、还原性等相关性质,对黑色物质的成分提出了猜想,经讨论认为,可能是 和Fe3O4四种物质中的一种或几种。
(8)为了确定黑色物质的成分,收集黑色物质,进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取黑色粉末,用磁铁吸引,观察 现象 | 黑色粉末全部被 磁铁吸引 | 综合实验现象判 断,此黑色物质 成分是 |
| 向装有黑色粉末的试管中加入足 量的盐酸,充分反应,观察现象 | 固体逐渐溶解, 但无气泡产生 |
(四)拓展延伸
(9)配制FeCl3溶液时,为防止出现红褐色物质,可向其中滴加少量的 溶液。
(10)结合已学知识,从元素化合价变化的角度分析,Fe2O3发生还原反应时,反应前后铁元素化合价一般呈 (填“上升”或“下降”)的变化。
20.钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。如图是利用钼矿石(主要成分为MoS2)制备金属钼的流程图:
信息:MoO3+3H2
Mo+3H2O
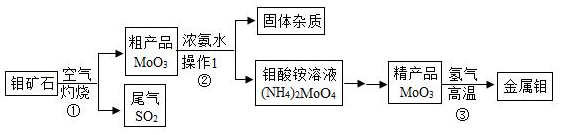
请回答下列问题:
(1)反应①常将钼矿石粉碎,目的是 ;MoO3中钼元素的化合价为 。
(2)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,化学方程式为 。
(3)制得19.2吨金属钼,理论上至少需含MoO380%的粗产品多少吨?请写出计算过程。
注:粗产品杂质中不含钼元素
信息:MoO3+3H2
| 高温 |

请回答下列问题:
(1)反应①常将钼矿石粉碎,目的是 ;MoO3中钼元素的化合价为 。
(2)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,化学方程式为 。
(3)制得19.2吨金属钼,理论上至少需含MoO380%的粗产品多少吨?请写出计算过程。
注:粗产品杂质中不含钼元素
查看全部题目