下载高清试卷
【2020年广西百色市中考化学试卷】-第1页
试卷格式:2020年广西百色市中考化学试卷.PDF
试卷热词:最新试卷、2020年、广西试卷、百色市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.下列变化属于化学变化的是( )
- A. 瓷碗破碎
- B. 纸张燃烧
- C. 芒果切片
- D. 冰雪融化
2.空气的成分按体积计算,约占78%的是( )
- A. 氮气
- B. 氧气
- C. 二氧化碳
- D. 稀有气体
3.下列物质属于氧化物的是( )
- A. NaCl
- B. Au
- C. NO2
- D. KOH
4.下列实验基本操作符合规范要求的是( )
- A.
 量取液体时读数
量取液体时读数 - B.
 倾倒废液
倾倒废液 - C.
 塞紧橡皮塞
塞紧橡皮塞 - D.
 倾倒液体
倾倒液体
5.磷肥具有增强农作物抗寒、抗旱能力的作用,下列化肥中属于磷肥的是( )
- A. Ca(H2PO4)2
- B. CO(NH2)2
- C. KNO3
- D. NH4HCO3
6.把少量下列物质分别放入水中,充分搅拌后可形成溶液的是( )
- A. 花生油
- B. 食盐
- C. 面粉
- D. 泥沙
7.下列有关实验现象的描述正确的是( )
- A. 红磷燃烧产生大量烟雾
- B. 硫在氧气中燃烧,生成二氧化硫
- C. 镁在空气中燃烧,发出耀眼白光,生成白色固体
- D. 将氯化铜溶液加入到氢氧化钾溶液中产生红褐色沉淀
8.习总书记说:“垃圾分类回收是一种新时尚”。废旧报纸属于以下垃圾类别的是( )
- A. 有害垃圾
- B. 可回收垃圾
- C. 厨余垃圾
- D. 其它垃圾
9.稀土是储量较少的一类金属的统称,有“工业的维生素”的美誉。铕(Eu)是稀土元素中化学性质最活泼的元素,Eu2O3中铕元素的化合价为( )
- A. +1
- B. +2
- C. +3
- D. +4
10.下列有关合金叙述正确的是( )
- A. 焊锡的熔点比纯锡的熔点高
- B. 合金中至少含有两种金属
- C. 钢是含碳量在2%~4.3%的铁合金
- D. 黄铜的硬度比纯铜的硬度大
11.“洁厕灵”与“漂白剂”不能混用,两者若混合易产生一种有毒气体X。反应原理为:NaClO+2HCl═NaCl+X↑+H2O,则X的化学式为( )
- A. Cl2
- B. ClO2
- C. HClO
- D. HClO3
12.中学生应有一定的安全常识。发现火险或遇火灾时,下列做法不正确的是( )
- A. 液化气泄漏起火时,首先关闭阀门
- B. 炒菜油锅内着火,立即盖上锅盖灭火
- C. 室内起火时,立即打开所有门窗通风
- D. 被困时,用湿毛巾捂住口鼻低下身子逃生
13.下列反应属于复分解反应的是( )
- A. 4P+5O22P2O5
点燃 - B. Fe+2HCl═FeCl2+H2↑
- C. 2H2O2H2↑+O2↑
MnO2 - D. Na2CO3+MgCl2═MgCO3↓+2NaCl
14.下列是一些生活物品的近似pH,其中酸性最强的是( )
- A. 酱油 pH=4.5
- B. 牛奶 pH=6.5
- C. 鸡蛋清 pH=7.8
- D. 厨房的清洁剂 pH=12.5
15.甲、乙两种固体物质的溶解度曲线如图所示。下列叙述正确的是( )
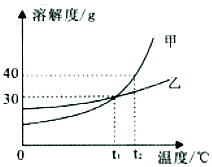

- A. 甲和乙的溶解度相等
- B. t2℃时,甲物质的溶解度为40
- C. 用降温的方法一定能使甲的不饱和溶液变成饱和溶液
- D. t2℃时,用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量
16.生活离不开化学,生活中的下列做法正确的是( )
- A. 发霉的花生,油炸后可食用
- B. 用小苏打除去面团发酵产生的酸
- C. 亚硝酸钠有咸味,可用于烹调食物
- D. 分别点燃一小块棉纤维和羊毛纤维,都发出烧焦羽毛的气味
17.下列关于氢氧化钠的描述中不正确的是( )
- A. 曝露在空气中易潮解
- B. 能与酸发生中和反应
- C. 其水溶液能使石蕊溶液变红
- D. 对皮肤有强烈的腐蚀作用
18.探究铁、铜、镁的金属活动性时,下列现象、分析或结论正确的是( )
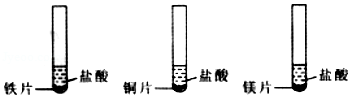

- A. 铜片表面有气泡产生
- B. 有镁片的试管外壁发烫
- C. 铁片与盐酸反应速率最快
- D. 它们的活动性:Cu>Fe>Mg
19.下列离子在溶液中可以大量共存的是( )
- A. NH4+、Na+、OH﹣、H+
- B. Na+、Ag+、NO3﹣、 Cl﹣
- C. Na+、Mg2+、Cl﹣、OH﹣
- D. Cu2+、NO3﹣、K+、Cl﹣
20.除去下列物质中的少量杂质,所选试剂及操作方法均正确的是( )
| 选项 | 物质(括号内为杂质) | 除杂方法及操作 |
| A | CO2(CO) | 在空气中点燃 |
| B | N2(O2) | 通过灼热的铜网 |
| C | Cu(NO3)2溶液(FeCl2) | 加足量的铜粉、过滤 |
| D | KCl溶液(CaCl2) | 加入足量的碳酸钠溶液,过滤 |
- A. A
- B. B
- C. C
- D. D
21.化学就在我们身边,请从下列物质中选择①氧气②煤③硝酸铵④石墨⑤不锈钢⑥硫酸铜。按要求填空(填序号):
(1)可用作干电池电极的是 ;
(2)溶于水温度降低的是 ;
(3)可用于制造炊具的是 ;
(4)被称为“工业粮食”的是 ;
(5)可用于配制波尔多液的是 ;
(6)可用于医疗急救的气体是 。
(1)可用作干电池电极的是 ;
(2)溶于水温度降低的是 ;
(3)可用于制造炊具的是 ;
(4)被称为“工业粮食”的是 ;
(5)可用于配制波尔多液的是 ;
(6)可用于医疗急救的气体是 。
22.写出符合下列要求的化学符号或符号的意义。
(1)锌离子 ;
(2)氧化汞中汞元素的化合价为+2价 ;
(3)2CH4 ;
(4)高锰酸钾 ;
(5)Ne 。
(1)锌离子 ;
(2)氧化汞中汞元素的化合价为+2价 ;
(3)2CH4 ;
(4)高锰酸钾 ;
(5)Ne 。
23.化学与人类的生活密切相关,请用所学的化学知识回答:
(1)打开汽水瓶盖时,汽水会自动喷出来,这说明气体溶解度与 有关。
(2)铁丝在氧气中燃烧的实验,铁丝绕成螺旋状的原因是 。
(3)森林着火,设置防火隔离带,其灭火原理是 。
(4)浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,然后再涂上3%~5%的 (填名称)的溶液。
(5)用稀硫酸清除铁制品表面的锈,反应的化学方程式为 。
(1)打开汽水瓶盖时,汽水会自动喷出来,这说明气体溶解度与 有关。
(2)铁丝在氧气中燃烧的实验,铁丝绕成螺旋状的原因是 。
(3)森林着火,设置防火隔离带,其灭火原理是 。
(4)浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,然后再涂上3%~5%的 (填名称)的溶液。
(5)用稀硫酸清除铁制品表面的锈,反应的化学方程式为 。
24.饮食健康是人们普遍的生活追求,让我们明白健康的重要。
(1)烹饪过程中使用了加碘盐,其目的是为了防止缺碘引起 疾病。
(2)胃酸过多的病人可服用含 (选填“氢氧化铝”或“氢氧化钠”)的药物治疗。
(3)新鲜牛奶的pH约为7,贮存一段时间后味道变酸,pH (填“变大”或“变小”)。
(4)水是重要的资源,硬水给生活带来诸多不便,生活中用 来区别软水和硬水,生活中用 方法使硬水软化。
(1)烹饪过程中使用了加碘盐,其目的是为了防止缺碘引起 疾病。
(2)胃酸过多的病人可服用含 (选填“氢氧化铝”或“氢氧化钠”)的药物治疗。
(3)新鲜牛奶的pH约为7,贮存一段时间后味道变酸,pH (填“变大”或“变小”)。
(4)水是重要的资源,硬水给生活带来诸多不便,生活中用 来区别软水和硬水,生活中用 方法使硬水软化。
25.元素周期表是学习化学的重要工具。下表为元素周期表中部分元素的相关信息,请利用下表回答相关问题:

(1)位于第2周期ⅥA族元素的名称是 ,其原子核内有 个质子,在化学反应中易 电子。
(2)图2为铟元素原子结构示意图,其化学性质与铝的化学性质相似,原因是 ,铟元素在元素周期表中位于第 周期。

(1)位于第2周期ⅥA族元素的名称是 ,其原子核内有 个质子,在化学反应中易 电子。
(2)图2为铟元素原子结构示意图,其化学性质与铝的化学性质相似,原因是 ,铟元素在元素周期表中位于第 周期。
26.新冠肺炎是一种急性感染性肺炎,做好自身防护是防止感染的重要措施。家庭和学校常备洗手液、酒精、一次性口罩、温度计等。
(1)佩戴口罩预防病毒的原理相当于化学实验中的 操作。
(2)活性炭口罩能有效阻隔空气中的氨、苯、甲醛等有害气体,其功能比普通口罩强大,原因是活性炭具有 性。
(3)医用酒精是75%酒精溶液,其溶剂是 。
(4)温度计有多种,常用的体温计有水银温度计,温度升高,水银柱会上升,从微观角度来解释是 。
(5)一次性口罩一般有三层,中间的一层是熔喷布,是制作口罩的核心材料,熔喷布主要以聚丙烯为主要原料,其中聚丙烯是 (填“合成材料”或“金属材料”)。
(6)以下是人们在应对“新型冠状病毒肺炎”时的一些认识,你认为不符合科学道理的是 。
A.家庭消毒时,消毒液越浓越好
B.多饮水,保证身体充足的水分
C.外出时佩戴口罩,避免前往人群密集的公共场所
(1)佩戴口罩预防病毒的原理相当于化学实验中的 操作。
(2)活性炭口罩能有效阻隔空气中的氨、苯、甲醛等有害气体,其功能比普通口罩强大,原因是活性炭具有 性。
(3)医用酒精是75%酒精溶液,其溶剂是 。
(4)温度计有多种,常用的体温计有水银温度计,温度升高,水银柱会上升,从微观角度来解释是 。
(5)一次性口罩一般有三层,中间的一层是熔喷布,是制作口罩的核心材料,熔喷布主要以聚丙烯为主要原料,其中聚丙烯是 (填“合成材料”或“金属材料”)。
(6)以下是人们在应对“新型冠状病毒肺炎”时的一些认识,你认为不符合科学道理的是 。
A.家庭消毒时,消毒液越浓越好
B.多饮水,保证身体充足的水分
C.外出时佩戴口罩,避免前往人群密集的公共场所
27.轻质碳酸钙广泛应用于橡胶、塑料、油漆、水性涂料以及造纸等行业,某同学设计流程以石灰石(杂质不反应也不溶于水)为原料制取轻质碳酸钙和氢氧化钠。
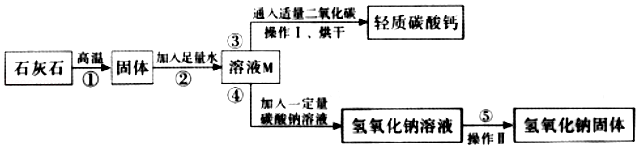
(1)写出第②步反应的化学方程式 。
(2)步骤②为 (填“吸热”或“放热”)反应。
(3)操作Ⅱ的名称是 ,该操作中玻璃棒的作用是 。

(1)写出第②步反应的化学方程式 。
(2)步骤②为 (填“吸热”或“放热”)反应。
(3)操作Ⅱ的名称是 ,该操作中玻璃棒的作用是 。
28.如图是实验室制取气体的装置图,请回答下列问题:

(1)仪器a的名称是 。
(2)实验室用氯酸钾和二氧化锰制取氧气,发生反应的化学方程式为 ,收集较为纯净的氧气应选择的装置是 (填装置字母)。
(3)实验室用大理石和稀盐酸制取二氧化碳,发生反应的化学方程式是 ,将 接近集气瓶口,若观察到木条熄灭,说明二氧化碳已收集满。

(1)仪器a的名称是 。
(2)实验室用氯酸钾和二氧化锰制取氧气,发生反应的化学方程式为 ,收集较为纯净的氧气应选择的装置是 (填装置字母)。
(3)实验室用大理石和稀盐酸制取二氧化碳,发生反应的化学方程式是 ,将 接近集气瓶口,若观察到木条熄灭,说明二氧化碳已收集满。
29.芯片作为集成电路的载体,广泛应用于手机、军工、航天等各个领域,是影响一个国家现代工业的重要因素。2020年6月23日,北斗三号最后一颗全球组网卫星在西昌卫星发射中心点火升空,发射成功。北斗导航型芯片的基材主要是高纯硅,百色市某中学化学研究小组的同学决定学习和研究芯片制造的相关知识。
[查阅资料]
(1)芯片制造首先要获得高纯度的晶体硅,单质硅有一些特殊的性质。
(2)沙子、石英、水晶的主要成分是SiO2,可通过SiO2获得硅单质。
[提出问题]如何获得硅单质?硅单质有哪些特殊的化学性质?
[分析讨论]小明同学认为SiO2→Si发生的是 (填“氧化”或“还原”)反应,可以用较为活泼的H2与SiO2在高温条件下制取,该反应的化学方程式为 ,小李上网查到工业制取高纯硅的相关化学方程式:
①SiO2+2C
Si+2CO↑
②Si+3HCl=SiHCl3+H2
③SiHCl3+H2
Si+3HCl
细心的小李发现,反应②和③是不同条件下方向相反的一对反应,工业上依次进行这两个反应的目的是为了 而获得高纯硅。
小方同学利用部分品体硅,对晶体硅的性质进行较为全面的研究。
[实验与理论探究]
(1)说文解字:网上查阅到,硅名称来自拉丁文的Silex,民国初期译为“矽”字,1953年中国科学院改为“硅”。“矽”和“硅”都是指Si这种元素,Si是地壳中含量排在第 位的元素,这个“矽”字的“石”字旁说明了Si是一种 单质,“夕”是这种元素的外文发音。
(2)硅的性质:
①硅是:一种灰黑色固体,小方同学将硅放入盛有水的烧杯中搅拌,发现不溶解。“灰黑色固体”、“硅不溶于水”都属于硅的 性质。
②小方同学将晶体硅放入一定浓度的氢氧化钠溶液中,观察到晶体硅溶解产生一种可燃性气体的同时,还得到一种粘性的盐类物质,该反应的化学方程式为 。
[结论]经过上述一系列的探究,同学们初步掌握了硅的一些相关知识,也学会了对未知元素的一些研究途径、思维和方法。
[查阅资料]
(1)芯片制造首先要获得高纯度的晶体硅,单质硅有一些特殊的性质。
(2)沙子、石英、水晶的主要成分是SiO2,可通过SiO2获得硅单质。
[提出问题]如何获得硅单质?硅单质有哪些特殊的化学性质?
[分析讨论]小明同学认为SiO2→Si发生的是 (填“氧化”或“还原”)反应,可以用较为活泼的H2与SiO2在高温条件下制取,该反应的化学方程式为 ,小李上网查到工业制取高纯硅的相关化学方程式:
①SiO2+2C
| 高温 |
②Si+3HCl=SiHCl3+H2
③SiHCl3+H2
| 高温 |
细心的小李发现,反应②和③是不同条件下方向相反的一对反应,工业上依次进行这两个反应的目的是为了 而获得高纯硅。
小方同学利用部分品体硅,对晶体硅的性质进行较为全面的研究。
[实验与理论探究]
(1)说文解字:网上查阅到,硅名称来自拉丁文的Silex,民国初期译为“矽”字,1953年中国科学院改为“硅”。“矽”和“硅”都是指Si这种元素,Si是地壳中含量排在第 位的元素,这个“矽”字的“石”字旁说明了Si是一种 单质,“夕”是这种元素的外文发音。
(2)硅的性质:
①硅是:一种灰黑色固体,小方同学将硅放入盛有水的烧杯中搅拌,发现不溶解。“灰黑色固体”、“硅不溶于水”都属于硅的 性质。
②小方同学将晶体硅放入一定浓度的氢氧化钠溶液中,观察到晶体硅溶解产生一种可燃性气体的同时,还得到一种粘性的盐类物质,该反应的化学方程式为 。
[结论]经过上述一系列的探究,同学们初步掌握了硅的一些相关知识,也学会了对未知元素的一些研究途径、思维和方法。
30.烟酸(化学式为C6H4NO2)是人体必须的13种维生素之一,具有扩张血管的作用。请回答下列问题:
(1)烟酸含有 种元素;
(2)烟酸分子中碳、氢、氮、氧的原子个数比为 。
(1)烟酸含有 种元素;
(2)烟酸分子中碳、氢、氮、氧的原子个数比为 。
31.往59.65g硝酸钡溶液中滴加52g硫酸钾溶液恰好完全反应,反应后得到溶液的质量为100g。求反应后生成的溶液溶质质量分数。
查看全部题目