下载高清试卷
【2019年四川省绵阳市中考化学试卷】-第1页
试卷格式:2019年四川省绵阳市中考化学试卷.PDF
试卷热词:最新试卷、2019年、四川试卷、绵阳市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.化学对科技发展具有重要作用,下列说法错误的是( )
- A. 尖端技术采用液氮获得低温,利用了氮气的化学性质
- B. 用作新型电池电极材料的石墨烯与金刚石组成元素相同
- C. 中国具有自主知识产权的大飞机C919机身主体材料是铝合金
- D. 通过改变钢铁组成,表面覆盖保护层,可以确保港珠澳大桥使用寿命
2.冰毒是一种毒品。吸食初期有多语,对种种刺激过敏、焦躁、抑郁循环性病态。继之,在幻听、幻视的错乱状态下,呈现被杀、被跟踪、嫉妒等多种妄想症,我们应该远离毒品。某种冰毒的化学式为C10H14NO2Cl,下列关于该冰毒的说法正确的是( )
- A. 是一种有机高分子化合物
- B. 相对分子质量为215.5 g
- C. N、H两种元素的质量分数相同
- D. 在空气中燃烧只生成CO2和H2O
3.下列关于资源、能源利用的说法正确的是( )
- A. 最理想的清洁、高能燃料是H2
- B. 地球上水储量非常丰富,淡水资源取之不尽
- C. 我国稀土资源丰富,可随意开采
- D. 为快速提高人类生活质量,必须加速开采石油
4.大连物化所研究发现,利用催化剂在低温下可将甲烷转化为甲醇,其反应微观示意图如图。下列说法错误的是( )
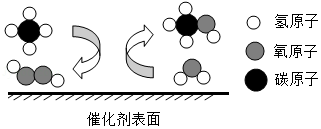

- A. 甲醇的化学式为CH4O
- B. 图示物质中有3种氧化物
- C. 该反应中分子、原子个数均不变
- D. 催化剂在反应前后质量不变
5.下列实验操作能达到目的的是( )
- A.
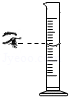 读取液体的体积
读取液体的体积 - B.
 配制100mL20%NaCl溶液
配制100mL20%NaCl溶液 - C.
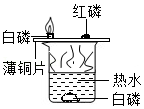 探究燃烧的条件
探究燃烧的条件 - D.
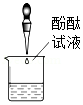 检验未知液是否碱溶液
检验未知液是否碱溶液
6.高铁酸钾(K2FeO4)可用于净水,也可用作电池的电极材料,可通过下列反应制备:
①MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
②3Cl2+2Fe(OH)3+xKOH═2K2FeO4+6KCl+yH2O
下列说法正确的是( )
①MnO2+4HCl(浓)
| △ |
②3Cl2+2Fe(OH)3+xKOH═2K2FeO4+6KCl+yH2O
下列说法正确的是( )
- A. 在反应①中,氯的化合价全部发生了改变
- B. 反应②中x=10,y=6
- C. 反应①②中共涉及了5种类型的化合物
- D. 上述反应不属于四种基本反应类型中的任何一种
7.根据如图所示溶解度曲线判断,下列说法正确的是( )
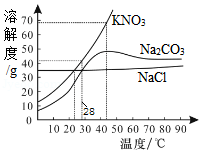

- A. 28℃时,将40g KNO3溶于100g水得到饱和溶液
- B. 将43℃的Na2CO3饱和溶液升高10℃,有晶体析出
- C. 三种物质的饱和溶液由40℃降温至23℃,所得溶液中溶质质量:m(NaCl)=m(KNO3)>m(Na2CO3)
- D. 除去KNO3中混有的Na2CO3,可在40℃配成饱和溶液,再降温结晶、过滤
8.向一定质量的AgNO3、Fe(NO3)2混合溶液中加入a g Zn粉,充分反应后过滤,将滤渣洗涤、干燥、称量,所得质量仍为a g.下列说法正确的是( )
- A. 滤液一定呈无色
- B. 滤液中一定含Fe(NO3)2和Zn(NO3)2
- C. 滤渣中一定含Fe
- D. 滤渣滴加稀盐酸一定无气泡产生
9.我国古代将赤铜(Cu2O)、炉甘石(ZnCO3)和木炭混合加热到800℃得到黄铜(铜锌合金)。若冶炼时所用Cu2O与ZnCO3的质量比为26:25,则所得黄铜的含铜量为( )
- A. 67.5%
- B. 51%
- C. 65%
- D. 64%
10.2019年是元素周期表诞生的第150周年,联合国大会宣布2019年是“国际化学元素周期表年”。 下面是元素周期表中1~18号元素原子核外电子排布:
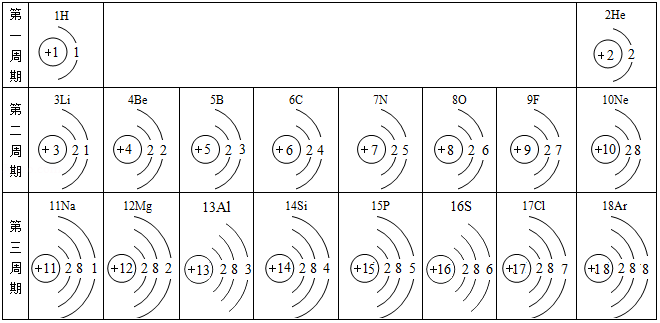
请回答下列问题:
(1)地壳中含量最多的金属元素原子核内质子数为 ,燃煤产生的两种氧化物易形成酸雨,组成这两种氧化物的元素中,原子序数最大的元素位于周期表中第 周期。
(2)第9号元素的钠盐常被添加到牙膏里以预防龋齿,该元素的离子结构示意图为 。元素X的原子核外电子总数为最外层电子数的3倍,单质X在空气中燃烧生成的化合物化学式为 。
(3)在元素周期表中,19号元素钾与钠位于同一族,则钾原子的电子层数为 ,金属钾与钠性质有许多相似之处,原因是 。

请回答下列问题:
(1)地壳中含量最多的金属元素原子核内质子数为 ,燃煤产生的两种氧化物易形成酸雨,组成这两种氧化物的元素中,原子序数最大的元素位于周期表中第 周期。
(2)第9号元素的钠盐常被添加到牙膏里以预防龋齿,该元素的离子结构示意图为 。元素X的原子核外电子总数为最外层电子数的3倍,单质X在空气中燃烧生成的化合物化学式为 。
(3)在元素周期表中,19号元素钾与钠位于同一族,则钾原子的电子层数为 ,金属钾与钠性质有许多相似之处,原因是 。
11.氯化钙(CaCl2)可用作干燥剂、混凝土防冻剂等。实验室用工业大理石(含有少量Al2O3、Fe2O3、SiO2等杂质)制备氯化钙的主要流程如下:
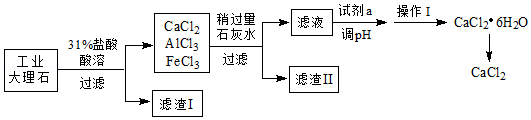
请回答下列问题:
(1)配制31%的稀盐酸730g,需要36.5%的浓盐酸 g。
(2)酸溶时碳酸钙参与反应的化学方程式为 。
(3)滤渣I的成分为 ,滤渣II中含有Al(OH)3和 。
(4)过滤使用到的玻璃仪器有 。操作I采用的方法是:蒸发浓缩、 、 、过滤。
(5)加入试剂a的目的是中和稍过量的石灰水,该反应的化学方程式为 。

请回答下列问题:
(1)配制31%的稀盐酸730g,需要36.5%的浓盐酸 g。
(2)酸溶时碳酸钙参与反应的化学方程式为 。
(3)滤渣I的成分为 ,滤渣II中含有Al(OH)3和 。
(4)过滤使用到的玻璃仪器有 。操作I采用的方法是:蒸发浓缩、 、 、过滤。
(5)加入试剂a的目的是中和稍过量的石灰水,该反应的化学方程式为 。
12.实验室提供下列仪器:

(1)用石灰石和稀盐酸制得CO2并观察CO2与石蕊溶液反应的现象,所需仪器按组装顺序依次是 (填序号),发生化合反应的化学方程式是 。
(2)用氯酸钾和二氧化锰制取O2,所需仪器按组装顺序依次是 (填序号),反应的化学方程式是 。

(1)用石灰石和稀盐酸制得CO2并观察CO2与石蕊溶液反应的现象,所需仪器按组装顺序依次是 (填序号),发生化合反应的化学方程式是 。
(2)用氯酸钾和二氧化锰制取O2,所需仪器按组装顺序依次是 (填序号),反应的化学方程式是 。
13.半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和水蒸气。某化学兴趣小组为检验半水煤气的某些成分,设计的实验方案如图所示。
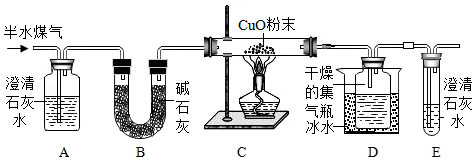
查阅资料可知碱石灰是CaO和NaOH的混合物。回答下列问题:
(1)A瓶中产生白色沉淀,证明半水煤气中含有 ,反应的化学方程式是 。
(2)B装置的作用是 。C装置的硬质玻璃管中发生置换反应的化学方程式是 。
(3)证明半水煤气中含有H2的现象是 。
(4)证明半水煤气中含有CO的现象是 。
(5)测定半水煤气中H2、CO质量的实验方案如下:
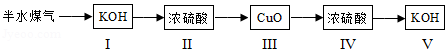
若步骤Ⅳ中浓硫酸质量增加ag,步骤Ⅴ的KOH溶液质量增加bg,则半水煤气中H2与CO的质量比为 (用含字母a、b的代数式表示)。

查阅资料可知碱石灰是CaO和NaOH的混合物。回答下列问题:
(1)A瓶中产生白色沉淀,证明半水煤气中含有 ,反应的化学方程式是 。
(2)B装置的作用是 。C装置的硬质玻璃管中发生置换反应的化学方程式是 。
(3)证明半水煤气中含有H2的现象是 。
(4)证明半水煤气中含有CO的现象是 。
(5)测定半水煤气中H2、CO质量的实验方案如下:

若步骤Ⅳ中浓硫酸质量增加ag,步骤Ⅴ的KOH溶液质量增加bg,则半水煤气中H2与CO的质量比为 (用含字母a、b的代数式表示)。
14.酸奶作为世界公认的长寿食品之一正愈来愈受到人们的重视和喜爱。酸奶中的酸味来自乳酸(化学式为C3H6O3)。

(1)酸奶主要提供人类营养物质中的哪一类? 。乳酸在人体内可被完全氧化为CO2和H2O,1.8 g乳酸完全氧化消耗O2的质量为 g。
(2)为了测定某品牌酸奶中乳酸的含量,振华同学取100 mL酸奶和100 mL蒸馏水于烧杯中,慢慢滴入0.4%的 NaOH溶液并不断搅拌,用传感器测得溶液pH随加入NaOH溶液体积V的变化关系如图所示,计算该酸奶中乳酸的含量为多少克每升。
(已知:乳酸的钠盐可表示为CH3CH(OH)COONa,测定所用NaOH溶液的密度为1.0 g/mL,计算结果精确到0.01,无计算过程不给分)。

(1)酸奶主要提供人类营养物质中的哪一类? 。乳酸在人体内可被完全氧化为CO2和H2O,1.8 g乳酸完全氧化消耗O2的质量为 g。
(2)为了测定某品牌酸奶中乳酸的含量,振华同学取100 mL酸奶和100 mL蒸馏水于烧杯中,慢慢滴入0.4%的 NaOH溶液并不断搅拌,用传感器测得溶液pH随加入NaOH溶液体积V的变化关系如图所示,计算该酸奶中乳酸的含量为多少克每升。
(已知:乳酸的钠盐可表示为CH3CH(OH)COONa,测定所用NaOH溶液的密度为1.0 g/mL,计算结果精确到0.01,无计算过程不给分)。
查看全部题目