下载高清试卷
【2021年江苏省南通市中考化学试卷】-第1页
试卷格式:2021年江苏省南通市中考化学试卷.PDF
试卷热词:最新试卷、2021年、江苏试卷、南通市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.粮食、蔬菜、水果、禽蛋等食物是日常营养的主要来源。下列食物富含蛋白质的是( )
- A. 米饭
- B. 青菜
- C. 苹果
- D. 鸡蛋
2.水是一切生命生存所必需的物质。下列有关水的说法正确的是( )
- A. 水由氢气和氧气组成
- B. 正常雨水一般显中性
- C. 水分子是保持水化学性质的最小粒子
- D. 硬水经活性炭处理可以转化为软水
3.下列实验操作不正确的是( )
- A.
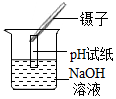 测定pH
测定pH - B.
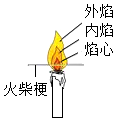 比较火焰各层温度
比较火焰各层温度 - C.
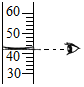 读出液体体积
读出液体体积 - D.
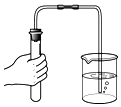 检查气密性
检查气密性
4.下列说法正确的是( )
- A. 回收废弃塑料可减少“白色污染”
- B. 乙醇属于有机高分子化合物
- C. 气体易压缩是因为分子间间隔小
- D. 硝酸铵溶解于水时放出热量
5.下列有关物质的性质与用途具有对应关系的是( )
- A. 氮气不易溶于水,可用作保护气
- B. 碳酸钙能与盐酸反应,可用作补钙剂
- C. 一氧化碳具有可燃性,可用于工业炼铁
- D. 氢氧化钙为白色固体,可用于改良酸性土壤
6.下列有关氧气的说法正确的是( )
- A. 氧气是空气中含量最多的气体
- B. 硫在氧气中燃烧生成三氧化硫
- C.
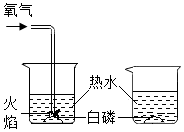 如图所示实验可说明氧气能支持燃烧
如图所示实验可说明氧气能支持燃烧 - D. 实验室常采用加热二氧化锰的方法制取氧气
7.金属材料包括铁、铝、铜等纯金属以及它们的合金。下列有关说法不正确的是( )
- A. 铝在空气中具有很好的抗腐蚀性能
- B. 铁钉浸没在植物油中比在潮湿空气中更易生锈
- C. 黄铜片(铜锌合金)的硬度大于铜片的硬度
- D. 室温下钛与稀盐酸不反应,可判断钛的金属活动性比镁弱
8.KNO3和KCl的溶解度曲线如图所示。下列说法正确的是( )
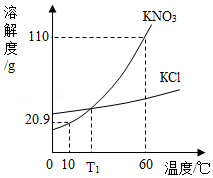

- A. KCl的溶解度小于KNO3的溶解度
- B. 10℃时,KNO3饱和溶液的质量分数为20.9%
- C. T1℃时,KNO3、KCl两溶液中溶质的质量分数一定相等
- D. 将60℃时的KNO3饱和溶液210g冷却至10℃,析出硝酸钾晶体89.1g
9.下列实验操作能达到实验目的的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 除去NaCl固体中混有的泥沙以获得NaCl固体 | 取混有泥沙的NaCl固体,加水、搅拌,充分溶解后过滤 |
| B | 除去NaCl溶液中混有的少量Na2SO4 | 向混有少量Na2SO4的NaCl溶液中加入过量BaCl2溶液,充分反应后过滤 |
| C | 配制50g质量分数为6%的NaCl溶液 | 向盛有3g NaCl固体的烧杯中,加入47mL水(密度为1g/cm3 ),搅拌至充分溶解 |
| D | 鉴别NaCl溶液和稀盐酸 | 向盛有两种溶液的试管中分别滴入AgNO3溶液,观察是否有沉淀产生 |
- A. A
- B. B
- C. C
- D. D
10.取24.8g过氧化银(Ag2O2)在真空条件下加热至固体质量不再发生变化,产生3.2g O2,固体质量随温度的变化如图所示(图中各点对应固体均为纯净物)。下列说法正确的是( )
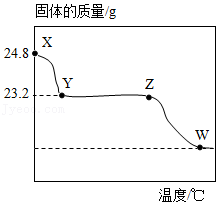

- A. X→Y过程中,固体中银元素的质量分数逐渐减小
- B. Y点对应的固体中银元素和氧元素的质量比为27:4
- C. Z→W过程中产生的氧气质量为2.4g
- D. Z→W过程中发生的反应为2Ag2O4Ag+O2↑
△
11.宏观和微观相结合是认识物质结构与性质的重要方法。
(1)下表为四种元素原子的结构示意图。
①上表中x= 。氯原子在反应中易 (填“得到”或“失去”)电子。
②钠原子失去一个电子所形成离子符号为 。
③由上表中三种元素组成的一种化合物能与盐酸发生中和反应,该化合物为 (填化学式)。
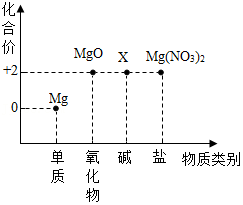
(2)镁及其化合物的“化合价—物质类别”关系如图。
①Mg(NO3)2中硝酸根的化合价为 。
②写出Mg与热水反应生成X和H2的化学方程式: 。
(1)下表为四种元素原子的结构示意图。
| 元素名称 | 氢 | 氧 | 钠 | 氯 |
| 原子结构示意图 | 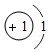 |  | 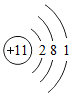 | 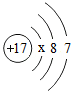 |
①上表中x= 。氯原子在反应中易 (填“得到”或“失去”)电子。
②钠原子失去一个电子所形成离子符号为 。
③由上表中三种元素组成的一种化合物能与盐酸发生中和反应,该化合物为 (填化学式)。
(2)镁及其化合物的“化合价—物质类别”关系如图。
①Mg(NO3)2中硝酸根的化合价为 。
②写出Mg与热水反应生成X和H2的化学方程式: 。

12.利用废镍催化剂(主要成分:Ni,还含有少量的Zn、Fe、CaO等杂质)制备NiCO3的实验流程如图(虚线处部分流程略去):
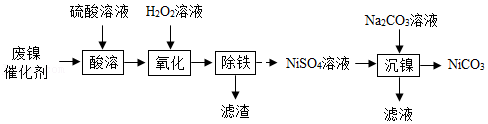
已知:Na2CO3溶液能使无色酚酞溶液变红。碱性条件下NiSO4转化为Ni(OH)2沉淀。
(1)“酸溶”时,为使废镍充分溶解,可采取的措施有 (任写一种)。
(2)“氧化”阶段发生的反应为H2O2+2FeSO4+H2SO4═Fe2(SO4)3+aH2O,则a= 。
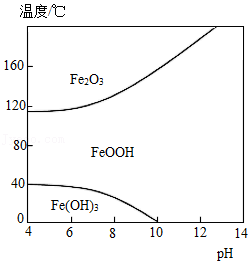
(3)“除铁”的目的是除去溶液中的Fe3+。改变温度、pH,Fe3+转化所得产物可能不同(如图)。80℃、pH=6时,Fe3+转化为 (填化学式)。
(4)“沉镍”是将Na2CO3溶液加入NiSO4溶液中生成NiCO3沉淀,反应的化学方程式为 。该过程不能将NiSO4溶液滴入Na2CO3溶液中,其原因是 。

已知:Na2CO3溶液能使无色酚酞溶液变红。碱性条件下NiSO4转化为Ni(OH)2沉淀。
(1)“酸溶”时,为使废镍充分溶解,可采取的措施有 (任写一种)。
(2)“氧化”阶段发生的反应为H2O2+2FeSO4+H2SO4═Fe2(SO4)3+aH2O,则a= 。
(3)“除铁”的目的是除去溶液中的Fe3+。改变温度、pH,Fe3+转化所得产物可能不同(如图)。80℃、pH=6时,Fe3+转化为 (填化学式)。

(4)“沉镍”是将Na2CO3溶液加入NiSO4溶液中生成NiCO3沉淀,反应的化学方程式为 。该过程不能将NiSO4溶液滴入Na2CO3溶液中,其原因是 。
13.碳及其化合物的综合利用使世界变得更加绚丽多彩。
(1)碳的多样性
1、金刚石和C60的化学性质相似,但物理性质却存在着很大差异。原因是 。
2、从石墨中分离出的单层石墨片(石墨烯)是目前人工制得的最薄材料,单层石墨片属于 (填“单质”或“化合物”)。
(2)“碳中和”的实现
“碳中和”是指一定时间内CO2的排放量与吸收量基本相当。CO2的捕集、利用是实现“碳中和”的重要途径。我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。
1、CO2的过度排放会造成 的加剧。结合生活实际,列举可为实现“碳中和”做出直接贡献的一种措施: 。
2、工业生产中产生的CO2经吸收剂处理可实现CO2的捕集。
①NaOH吸收。NaOH溶液吸收CO2生成NaHCO3的化学方程式为 。
②CaO吸收。CaC2O4在高温下分解制得疏松多孔的CaO,同时产生CO、CO2。该反应所得CO、CO2的分子个数之比为 。
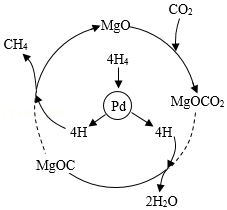
3、CO2与H2在一定条件下转化为CH4(反应过程如图所示,虚线处部分中间产物略去),可实现CO2的再利用。
①该反应中,除CH4外另一种生成物为 (填化学式),MgO的作用是 。
②天然气(主要成分为CH4)已成为居民的生活用气,是因为CH4在空气中燃烧时 (填“吸收”或“放出”)热量。
(1)碳的多样性
1、金刚石和C60的化学性质相似,但物理性质却存在着很大差异。原因是 。
2、从石墨中分离出的单层石墨片(石墨烯)是目前人工制得的最薄材料,单层石墨片属于 (填“单质”或“化合物”)。
(2)“碳中和”的实现
“碳中和”是指一定时间内CO2的排放量与吸收量基本相当。CO2的捕集、利用是实现“碳中和”的重要途径。我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。
1、CO2的过度排放会造成 的加剧。结合生活实际,列举可为实现“碳中和”做出直接贡献的一种措施: 。
2、工业生产中产生的CO2经吸收剂处理可实现CO2的捕集。
①NaOH吸收。NaOH溶液吸收CO2生成NaHCO3的化学方程式为 。
②CaO吸收。CaC2O4在高温下分解制得疏松多孔的CaO,同时产生CO、CO2。该反应所得CO、CO2的分子个数之比为 。
3、CO2与H2在一定条件下转化为CH4(反应过程如图所示,虚线处部分中间产物略去),可实现CO2的再利用。
①该反应中,除CH4外另一种生成物为 (填化学式),MgO的作用是 。
②天然气(主要成分为CH4)已成为居民的生活用气,是因为CH4在空气中燃烧时 (填“吸收”或“放出”)热量。

14.某学习小组对铜丝在空气中灼烧后的产物进行探究。
实验1甲同学将螺旋状铜丝灼烧至红热,冷却后观察到铜丝表面变为黑色,再伸入质量分数为25%的稀硫酸中,黑色固体消失,溶液出现蓝色,将铜丝取出洗净;重复上述实验2~3次,溶液蓝色逐渐加深。
(1)【实验分析】灼烧铜丝生成黑色固体,该反应属于基本反应类型中的 反应。溶液变为蓝色的原因是 (用化学方程式表示)。
实验2乙同学将螺旋状铜丝灼烧至红热,迅速伸入质量分数为25%的稀硫酸中,观察到溶液中有红色固体产生,将铜丝取出洗净;重复上述实验2~3次,红色固体逐渐增多,沉淀后滤出红色固体,滤液呈浅蓝色。
【提出问题1】红色固体是什么?
【查阅资料1】①Cu与O2在高于900℃时会反应生成红色的Cu2O。
②Cu2O能与H2SO4发生反应:Cu2O+H2SO4═Cu+CuSO4+H2O。
③加热条件下,Cu2O能与H2反应生成Cu和H2O。
【提出猜想】丙同学认为红色固体全部是Cu,不含Cu2O。
【实验验证1】学习小组取经过干燥的红色固体,采用如图装置验证猜想。

(2)仪器X的名称为 。
(3)装置B中浓硫酸的作用是 。
(4)实验时,应先将产生的氢气通入装置C中,待 ,再开始加热。
(5)实验中观察到 (填实验现象),说明红色固体中含有Cu2O,丙同学猜想错误。
【提出问题2】实验2中有稀硫酸存在的情况下,为什么红色固体中仍含有Cu2O?
【查阅资料2】Cu2O与H2SO4反应的快慢与稀硫酸的浓度有关。稀硫酸的浓度越大,Cu2O与H2SO4反应越快。
(6)【实验验证2】请设计实验验证“稀硫酸的浓度越大,Cu2O与H2SO4反应越快”这一结论。简述实验过程(包括操作和现象): 。
(实验中须使用的试剂:Cu2O、质量分数为5%和40%的稀硫酸)
【问题解决】因实验2中稀硫酸浓度变小,Cu2O与H2SO4反应变慢,Cu2O没有完全反应,故红色固体中仍含有Cu2O。
实验1甲同学将螺旋状铜丝灼烧至红热,冷却后观察到铜丝表面变为黑色,再伸入质量分数为25%的稀硫酸中,黑色固体消失,溶液出现蓝色,将铜丝取出洗净;重复上述实验2~3次,溶液蓝色逐渐加深。
(1)【实验分析】灼烧铜丝生成黑色固体,该反应属于基本反应类型中的 反应。溶液变为蓝色的原因是 (用化学方程式表示)。
实验2乙同学将螺旋状铜丝灼烧至红热,迅速伸入质量分数为25%的稀硫酸中,观察到溶液中有红色固体产生,将铜丝取出洗净;重复上述实验2~3次,红色固体逐渐增多,沉淀后滤出红色固体,滤液呈浅蓝色。
【提出问题1】红色固体是什么?
【查阅资料1】①Cu与O2在高于900℃时会反应生成红色的Cu2O。
②Cu2O能与H2SO4发生反应:Cu2O+H2SO4═Cu+CuSO4+H2O。
③加热条件下,Cu2O能与H2反应生成Cu和H2O。
【提出猜想】丙同学认为红色固体全部是Cu,不含Cu2O。
【实验验证1】学习小组取经过干燥的红色固体,采用如图装置验证猜想。

(2)仪器X的名称为 。
(3)装置B中浓硫酸的作用是 。
(4)实验时,应先将产生的氢气通入装置C中,待 ,再开始加热。
(5)实验中观察到 (填实验现象),说明红色固体中含有Cu2O,丙同学猜想错误。
【提出问题2】实验2中有稀硫酸存在的情况下,为什么红色固体中仍含有Cu2O?
【查阅资料2】Cu2O与H2SO4反应的快慢与稀硫酸的浓度有关。稀硫酸的浓度越大,Cu2O与H2SO4反应越快。
(6)【实验验证2】请设计实验验证“稀硫酸的浓度越大,Cu2O与H2SO4反应越快”这一结论。简述实验过程(包括操作和现象): 。
(实验中须使用的试剂:Cu2O、质量分数为5%和40%的稀硫酸)
【问题解决】因实验2中稀硫酸浓度变小,Cu2O与H2SO4反应变慢,Cu2O没有完全反应,故红色固体中仍含有Cu2O。
15.工业上用N2和H2合成NH3是人类科学技术的一项重大突破。
(1)①N2可通过分离液态空气获得,该方法利用了N2和O2沸点的差异。沸点属于物质的 (填“物理”或“化学”)性质。
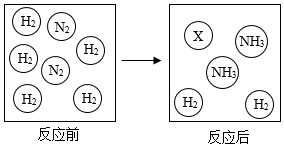
②一定条件下,向容器中充入一定量的N2和H2,充分反应生成NH3。反应前后物质的变化如图,图中X代表的分子为 (填化学式)。
(2)NH3与氰酸(HOCN)反应生成尿素[CO(NH2)2]。
①尿素为农作物生长提供的主要营养元素为________。
②尿素可用于去除大气污染物中的NO,其化学反应为6NO+2CO(NH2)2═5N2+2CO2+4H2O。若去除废气中6gNO,理论上所需质量分数为10%的尿素溶液的质量是多少?
(1)①N2可通过分离液态空气获得,该方法利用了N2和O2沸点的差异。沸点属于物质的 (填“物理”或“化学”)性质。
②一定条件下,向容器中充入一定量的N2和H2,充分反应生成NH3。反应前后物质的变化如图,图中X代表的分子为 (填化学式)。
(2)NH3与氰酸(HOCN)反应生成尿素[CO(NH2)2]。
①尿素为农作物生长提供的主要营养元素为________。
②尿素可用于去除大气污染物中的NO,其化学反应为6NO+2CO(NH2)2═5N2+2CO2+4H2O。若去除废气中6gNO,理论上所需质量分数为10%的尿素溶液的质量是多少?

查看全部题目