下载高清试卷
【2021-2022学年山西省运城市盐湖区九年级(上)期末化学试卷】-第1页
试卷格式:2021-2022学年山西省运城市盐湖区九年级(上)期末化学试卷.PDF
试卷热词:最新试卷、2022年、山西试卷、运城市试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷

扫码查看解析
试卷题目
1.为实现节能减排、绿色环保,我省积极倡导并大力发展新的绿色经济。下列做法与这一理念不相符的是( )
- A. 垃圾进行分类处理
- B. 用电动车逐步替代燃油车
- C. 节日期间大量燃放烟花爆竹
- D. 冬季取暖用天然气替代燃煤
2.开发和利用新能源是解决能源问题的重要途径,下列选项中使用的能源不属于新能源的是( )
- A. 地热能取暖
- B. 火力发电
- C. 太阳能热水器
- D. 潮汐能动力机
3.金属材料在生产、生活中有着广泛的应用。下列生活用品所使用的主要材料,属于金属材料的是( )
- A. 汽车轮胎
- B. 塑料油桶
- C. 玻璃啤酒瓶
- D. 不锈钢餐具
4.2020年5月12日是我国第12个全国防灾减灾日,主题是“提升基层应急能力,筑牢防灾减灾救灾的人民防线”,下列说法错误的是( )
- A. 可燃性气体中混有空气,遇明火一定会发生爆炸
- B. 加油站、加气站内拨打电话可能引发燃烧或爆炸
- C. 发生火灾,如果火势较大,立即拨打119电话报警
- D. 为扑灭森林火灾,可将大火蔓延路线前的一片树木砍掉,形成隔离带
5.铝是制造飞机、火箭、导弹的主要结构材料,被称为“国防金属”,如图是铝的原子结构示意图和该元素在元素周期表中的部分信息,下列说法不正确的是( )
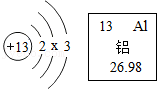

- A. x=8
- B. 铝原子在化学变化中容易失去电子
- C. 铝的相对原子质量为26.98g
- D. 铝原子的质子数为13
6.丙烷(C3H8)是液化石油气的主要成分之一,如图是丙烷燃烧的微观示意图,下列说法正确的是( )
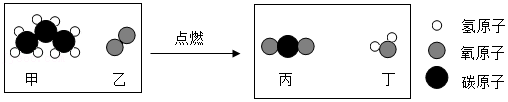

- A. 甲中碳元素的质量分数较大
- B. 乙和丙的元素组成相同
- C. 反应前后分子的数目没有改变
- D. 该反应涉及三种氧化物
7.我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合加热至800℃,得到一种外形酷似黄金的锌铜合金(俗称黄铜)。下列说法正确的是( )
- A. Cu2O中铜的化合价为+2
- B. 黄铜的熔点比铜与锌的熔点都低
- C. 该变化利用了木炭的氧化性
- D. 通过观察颜色可鉴别黄金与黄铜
8.化学实验是我们应用化学知识、拓展化学思维和培养化学素养的重要途径。下列实验能达到实验目的的是( )
- A.
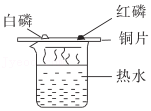 探究燃烧条件
探究燃烧条件 - B.
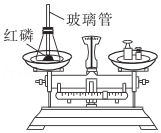 探究质量守恒定律
探究质量守恒定律 - C.
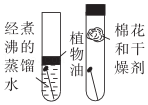 探究铁钉生锈条件
探究铁钉生锈条件 - D.
 探究金属和合金的硬度
探究金属和合金的硬度
9.科学精神与社会责任,是化学学科素养更高层面的价值追求。化学实践小组的同学欲探究镁、铁、铜三种金属的活动性顺序,下列实验方案可行的是( )
- A. Fe、Cu、MgSO4溶液
- B. FeSO4溶液、Cu、MgSO4溶液
- C. Fe、CuSO4溶液、MgSO4溶液
- D. Fe、Mg、CuSO4溶液
10.下列图象能正确反映对应实验操作的是( )
- A.
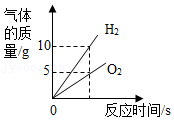 电解水
电解水 - B.
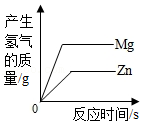 取两份等质量、相同质量分数的稀硫酸,分别不断加入镁粉和锌粉
取两份等质量、相同质量分数的稀硫酸,分别不断加入镁粉和锌粉 - C.
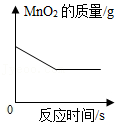 用氯酸钾和二氧化锰混合加热制取氧气
用氯酸钾和二氧化锰混合加热制取氧气 - D.
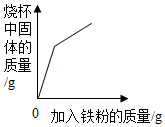 向盛有硫酸铜溶液的烧杯中加入铁粉至过量
向盛有硫酸铜溶液的烧杯中加入铁粉至过量
11.随着高铁路网的不断完善,城市间的距离正在逐渐缩短,人们的生活空间不断扩大,经济、快捷的高铁已成为人们出行的首选。
(1)高铁在建设过程中使用了大量的优质不锈钢。写出用赤铁矿和一氧化碳炼铁的化学方程式: 。
(2)“复兴号”是中国自主研发制造的达到世界先进水平的动车组列车。生产列车发动机时,要利用﹣40℃的干冰使部件体积收缩,以实现与其他部件的精准对接。上述过程,主要利用干冰的 (选填“物理”或“化学”)性质。
(1)高铁在建设过程中使用了大量的优质不锈钢。写出用赤铁矿和一氧化碳炼铁的化学方程式: 。
(2)“复兴号”是中国自主研发制造的达到世界先进水平的动车组列车。生产列车发动机时,要利用﹣40℃的干冰使部件体积收缩,以实现与其他部件的精准对接。上述过程,主要利用干冰的 (选填“物理”或“化学”)性质。
12.化学与我们的生活息息相关,如图是日常生活中一款常见的燃气灶的示意图。
(1)烹饪时,用铸铁炉架将锅架高,其主要目的是 (填字母)。
A.避免锅被烤坏
B.食物被烤焦
C.外焰加热
(2)燃气灶常使用天然气、液化石油气等燃气,写出天然气完全燃烧的化学方程式: 。
(3)燃气灶关火的方法是关闭燃气阀门,其灭火的原理是 。

(1)烹饪时,用铸铁炉架将锅架高,其主要目的是 (填字母)。
A.避免锅被烤坏
B.食物被烤焦
C.外焰加热
(2)燃气灶常使用天然气、液化石油气等燃气,写出天然气完全燃烧的化学方程式: 。
(3)燃气灶关火的方法是关闭燃气阀门,其灭火的原理是 。

13.我国科学家研发出一种将二氧化碳高效转化为清洁能源甲醇的新技术。
(1)二氧化碳转化为清洁能源甲醇的化学方程式为CO2+3H2
X+H2O,则X的化学式为 。
(2)该技术可能解决的环境问题是 (答一条即可)。
(1)二氧化碳转化为清洁能源甲醇的化学方程式为CO2+3H2
| 催化剂 |
(2)该技术可能解决的环境问题是 (答一条即可)。
14.氢气被认为是21世纪最具发展潜力的清洁能源,其原因是 (答一条即可,下同),氢气目前没有被大规模使用的原因是 。
15.利用锌渣(主要成分是Zn和FeSO4)制备氯化锌的主要工艺流程如图所示:
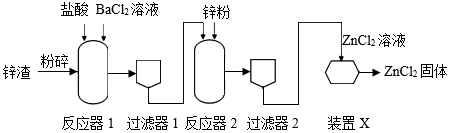
(1)粉碎锌渣的目的是 。
(2)反应器1中发生的主要反应有①BaCl2+FeSO4═FeCl2+BaSO4↓;②Zn+FeSO4═ZnSO4+Fe;③ (填一个即可)。
(3)反应器2中发生的主要反应的基本反应类型是 。
(4)上述流程中,装置X的作用是 。

(1)粉碎锌渣的目的是 。
(2)反应器1中发生的主要反应有①BaCl2+FeSO4═FeCl2+BaSO4↓;②Zn+FeSO4═ZnSO4+Fe;③ (填一个即可)。
(3)反应器2中发生的主要反应的基本反应类型是 。
(4)上述流程中,装置X的作用是 。
16.
长征系列运载火箭燃料
长征系列运载火箭是我国自行研制的航天运输工具,运载火箭的保障是所有航天活动的第一步。我国长征系列运载火箭的第一、二级燃料多数采用偏二甲肼(C2H4N2)和四氧化二氮(N2O4)作的“二元推进剂”,在点燃时偏二甲肼和四氧化二氮发生剧烈的反应,生成氮气、水和二氧化碳。偏二甲肼是一种有毒、有腐蚀性的油状液体。因此燃料加注要控制在火箭发射窗口期前24小时左右进行。使用高效、低毒的液氧和煤油替代常规的肼类燃料,是世界航天推进技术的发展趋势,煤油作为常温推进剂,可实现来源广泛、高能量特性、廉价环保、可重复使用、可靠性高,大范围推力调节等突出优势,将为我国空间站建设,载人登月和深空探测提供技术支撑。中国自主研制新一代重型运载火箭“冰箭“,采用无毒、无污染、高性能的液氧和液氢低温燃料,我国成为世界上第三个掌握控制液态氢技术的国家。
阅读文本,完成下列任务:
(1)写出偏二甲肼和四氧化二氮反应的化学方程式: ,由此可知,可燃物燃烧时 (选填“一定”或“不一定”)需要氧气助燃。
(2)航天煤油是由 (选填“煤”“石油”或“天然气”)分离而来的产品,这是利用其中各成分的 不同进行分离。
(3)液氧和煤油与肼类燃料相比,其优点是 (写一点)。
(4)液氧在一定条件下变成氧气,下列有关该变化的说法不正确的是 (填字母)。
A.物质的化学性质保持不变
B.变化过程中吸收能量
C.分子间间隔增大
D.发生了化学变化
长征系列运载火箭燃料
长征系列运载火箭是我国自行研制的航天运输工具,运载火箭的保障是所有航天活动的第一步。我国长征系列运载火箭的第一、二级燃料多数采用偏二甲肼(C2H4N2)和四氧化二氮(N2O4)作的“二元推进剂”,在点燃时偏二甲肼和四氧化二氮发生剧烈的反应,生成氮气、水和二氧化碳。偏二甲肼是一种有毒、有腐蚀性的油状液体。因此燃料加注要控制在火箭发射窗口期前24小时左右进行。使用高效、低毒的液氧和煤油替代常规的肼类燃料,是世界航天推进技术的发展趋势,煤油作为常温推进剂,可实现来源广泛、高能量特性、廉价环保、可重复使用、可靠性高,大范围推力调节等突出优势,将为我国空间站建设,载人登月和深空探测提供技术支撑。中国自主研制新一代重型运载火箭“冰箭“,采用无毒、无污染、高性能的液氧和液氢低温燃料,我国成为世界上第三个掌握控制液态氢技术的国家。
阅读文本,完成下列任务:
(1)写出偏二甲肼和四氧化二氮反应的化学方程式: ,由此可知,可燃物燃烧时 (选填“一定”或“不一定”)需要氧气助燃。
(2)航天煤油是由 (选填“煤”“石油”或“天然气”)分离而来的产品,这是利用其中各成分的 不同进行分离。
(3)液氧和煤油与肼类燃料相比,其优点是 (写一点)。
(4)液氧在一定条件下变成氧气,下列有关该变化的说法不正确的是 (填字母)。
A.物质的化学性质保持不变
B.变化过程中吸收能量
C.分子间间隔增大
D.发生了化学变化
17.A~E是初中化学常见的5种物质,A是年产量最多的金属,B为黑色固体,C和E的组成元素相同,“一”表示相连物质间可以反应,“→”表示一种物质生成另一种物质。
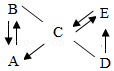
(1)C的用途为 (写一条),D的化学式为 。
(2)B→A反应的化学方程式为 。
(3)E→C反应是 (选填“放热”或“吸热”)反应,C和E的组成元素相同,但是化学性质不同的原因是 。

(1)C的用途为 (写一条),D的化学式为 。
(2)B→A反应的化学方程式为 。
(3)E→C反应是 (选填“放热”或“吸热”)反应,C和E的组成元素相同,但是化学性质不同的原因是 。
18.根据如图回答问题。
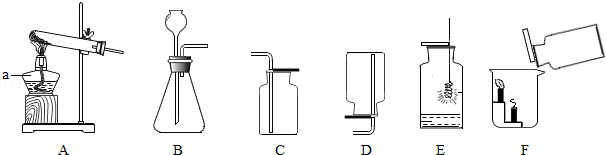
(1)标号a的仪器名称是 。
(2)实验室制取氧气时,应选用的收集装置是 (填字母),如图E所示,铁丝与氧气反应的实验现象是 。
(3)实验室制取二氧化碳时,应选用的发生装置是 (填字母),发生反应的化学方程式是 。如图F所示,将集气瓶中的二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上依次熄灭,说明二氧化碳具有的性质是 。

(1)标号a的仪器名称是 。
(2)实验室制取氧气时,应选用的收集装置是 (填字母),如图E所示,铁丝与氧气反应的实验现象是 。
(3)实验室制取二氧化碳时,应选用的发生装置是 (填字母),发生反应的化学方程式是 。如图F所示,将集气瓶中的二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上依次熄灭,说明二氧化碳具有的性质是 。
19.古文献记载:距今4000~5000年我国古代人们已开始冶铸青铜器(如图1)。青铜器表面常会有一层铜锈,同学们对铜锈开展了以下探究活动。
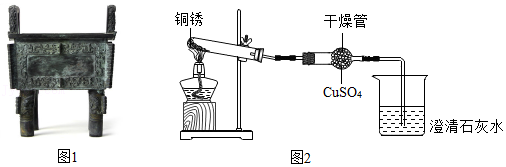
查阅资料:CuSO4(白色)+5H2O═CuSO4•5H2O(蓝色)
活动一:探究铜锈的组成
用图2所示的实验装置隔绝空气加热铜锈,观察到澄清石灰水变浑浊,干燥管内白色粉末变为蓝色,试管中固体由绿色变为黑色。
(1)【交流讨论】由活动一推测,铜锈中含有的元素有 ;烧杯中发生反应的化学方程式为 。
活动二:探究铜生锈的条件
【做出猜想】在活动一的基础上,猜想铜生锈的条件是铜与H2O、CO2同时接触。
【进行实验】
【得出结论】铜生锈的条件是与H2O、CO2同时接触。
【反思评价】
(2)小组同学做出“铜生锈的条件是铜与H2O、CO2同时接触”这一猜想的理由是 。
(3)对比实验①③得到的结论是 。
(4)能说明铜生锈与H2O有关的实验是 (填序号)。
(5)经过反思,小刚同学对所得结论提出疑问:与氧气接触也可能是铜生锈的条件之一。小丽同学认为实验①、④对比即可说明铜生锈与氧气有关。请判断小丽的说法是否正确并说明理由: 。
(6)通过实验证明,铜生锈的条件是铜与氧气、二氧化碳和水同时接触。由此,你对保存铜制品的建议是 。

查阅资料:CuSO4(白色)+5H2O═CuSO4•5H2O(蓝色)
活动一:探究铜锈的组成
用图2所示的实验装置隔绝空气加热铜锈,观察到澄清石灰水变浑浊,干燥管内白色粉末变为蓝色,试管中固体由绿色变为黑色。
(1)【交流讨论】由活动一推测,铜锈中含有的元素有 ;烧杯中发生反应的化学方程式为 。
活动二:探究铜生锈的条件
【做出猜想】在活动一的基础上,猜想铜生锈的条件是铜与H2O、CO2同时接触。
【进行实验】
| 序号 | ① | ② | ③ | ④ |
| 实验 | 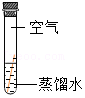 | 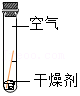 | 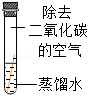 | 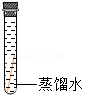 |
| 现象 | 铜片表面有绿色物质 | 无明显现象 | 无明显现象 | 无明显现象 |
【得出结论】铜生锈的条件是与H2O、CO2同时接触。
【反思评价】
(2)小组同学做出“铜生锈的条件是铜与H2O、CO2同时接触”这一猜想的理由是 。
(3)对比实验①③得到的结论是 。
(4)能说明铜生锈与H2O有关的实验是 (填序号)。
(5)经过反思,小刚同学对所得结论提出疑问:与氧气接触也可能是铜生锈的条件之一。小丽同学认为实验①、④对比即可说明铜生锈与氧气有关。请判断小丽的说法是否正确并说明理由: 。
(6)通过实验证明,铜生锈的条件是铜与氧气、二氧化碳和水同时接触。由此,你对保存铜制品的建议是 。
20.中华文化源远流长,早在西汉时期《淮南万毕术》一书中就有“曾青得铁则化为铜”的记载,这是我国现代“湿法炼铜”的先驱。利用此原理,向160kg含硫酸铜的废液中加入足量的铁粉,得到金属铜6.4kg。请计算废液中硫酸铜的溶质质量分数。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解