下载高清试卷
【2021年湖北省武汉市新洲区中考化学一模试卷】-第1页
试卷格式:2021年湖北省武汉市新洲区中考化学一模试卷.PDF
试卷热词:最新试卷、2021年、湖北试卷、武汉市试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷
扫码查看解析
试卷题目
1.下列物质中属于化合物的是( )
- A. 洁净的空气
- B. 澄清石灰水
- C. 过氧化氢
- D. 液态氧
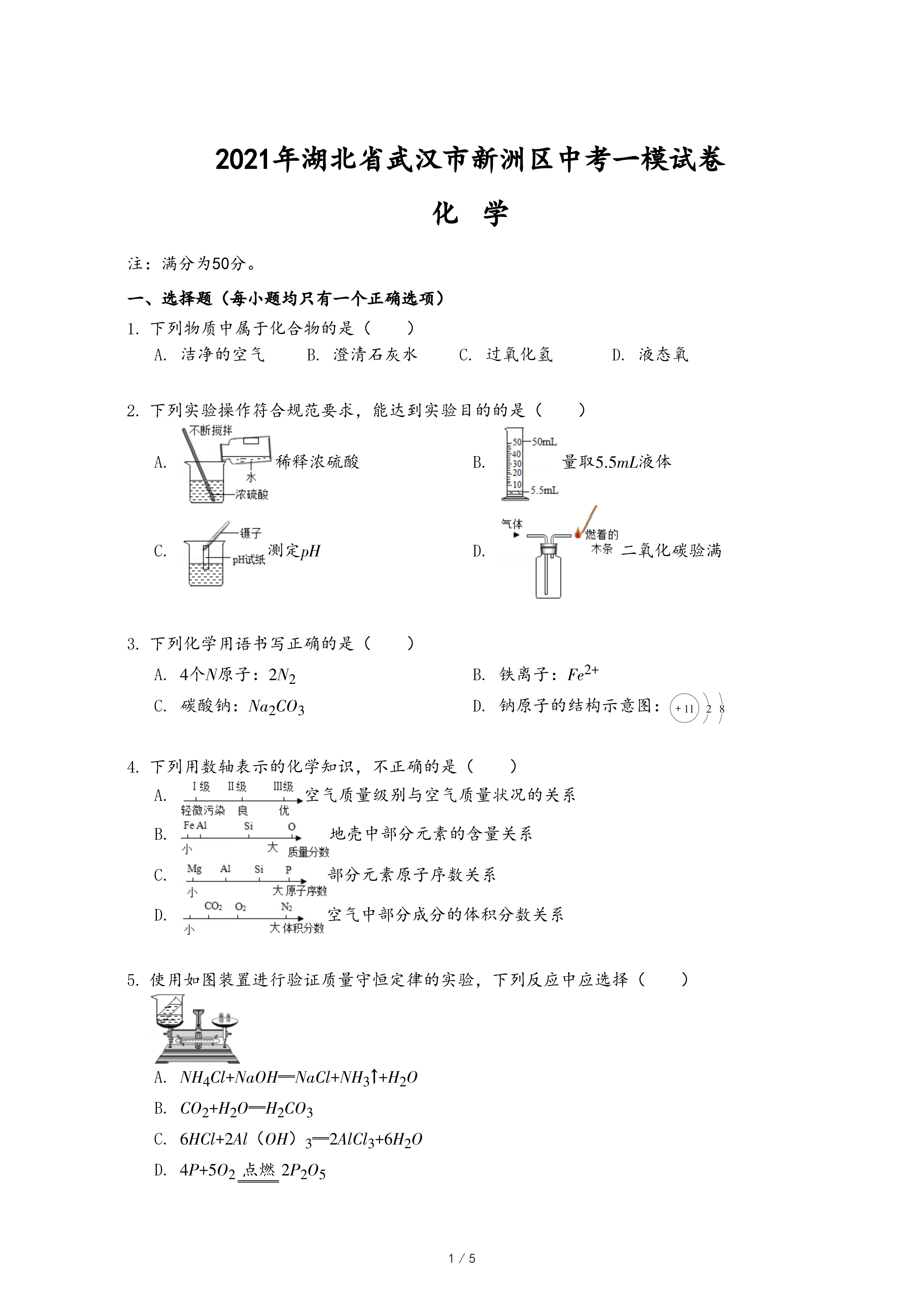
2.下列实验操作符合规范要求,能达到实验目的的是( )
- A.
 稀释浓硫酸
稀释浓硫酸 - B.
 量取5.5mL液体
量取5.5mL液体 - C.
 测定pH
测定pH - D.
 二氧化碳验满
二氧化碳验满
3.下列化学用语书写正确的是( )
- A. 4个N原子:2N2
- B. 铁离子:Fe2+
- C. 碳酸钠:Na2CO3
- D. 钠原子的结构示意图:
4.下列用数轴表示的化学知识,不正确的是( )
- A.
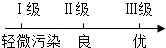 空气质量级别与空气质量状况的关系
空气质量级别与空气质量状况的关系 - B.
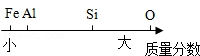 地壳中部分元素的含量关系
地壳中部分元素的含量关系 - C.
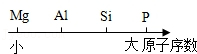 部分元素原子序数关系
部分元素原子序数关系 - D.
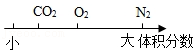 空气中部分成分的体积分数关系
空气中部分成分的体积分数关系
5.使用如图装置进行验证质量守恒定律的实验,下列反应中应选择( )
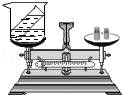

- A. NH4Cl+NaOH═NaCl+NH3↑+H2O
- B. CO2+H2O═H2CO3
- C. 6HCl+2Al(OH)3═2AlCl3+6H2O
- D. 4P+5O22P2O5
点燃
6.下列实验方案不能达到实验目的的是( )
| 实验目的 | 实验方案 | |
| A | 分离硫酸钡和氯化钠固体 | 加足量水溶解、过滤、洗涤、干燥;蒸发结晶 |
| B | 除去氯化钙溶液中混有的少量盐酸 | 加入足量的碳酸钙,过滤 |
| C | 验证铝、铁、铜三种金属的活动性顺序 | 将打磨过的铝丝和洁净的铜丝,分别浸入到硫酸亚铁溶液中,观察现象 |
| D | 鉴别溶液:氯化钡溶液、氢氧化钠溶液、硫酸钠溶液、氯化铵溶液 | 不用其它试剂,将四种溶液分别取样,两两相互混合,观察现象 |
- A. A
- B. B
- C. C
- D. D
7.烧杯中盛有CuSO4和HCl的混合溶液100.0g,向其中逐滴滴加Ba(OH)2溶液,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法正确的是( )
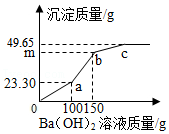

- A. a点对应溶液中有1种溶质
- B. b~c段发生2个反应
- C. HCl在原溶液中的溶质质量分数约为14.6%
- D. m=39.85
8.一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种。为确定其组成,某同学设计了如下实验方案。下列判断正确的是( )
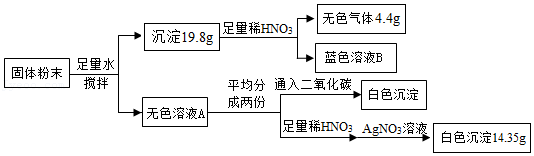

- A. 该混合物中一定含有CaCO3、NaOH、CuCl2、Ca(NO3)2
- B. 蓝色溶液B的溶质有2种
- C. 无色溶液A呈中性
- D. 该混合物中一定含有NaCl,可能含有NaNO3
9.随着化学科学的发展,化学知识在生产生活中有了更加广泛的应用。
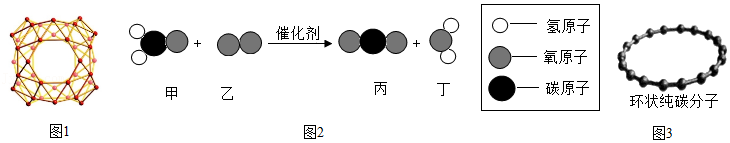
(1)中美科学家携手发现了全硼富勒烯B40团簇(结构如图1所示),它在超导、绿色催化等领域具有重要的应用价值。B40属于 (填字母)。
A.单质
B.化合物
C.有机物
D.混合物
(2)利用催化剂可消除室内装修材料释放的甲醛,如图2所示为该反应的微观示意图。
①甲醛的化学式为 。
②参加反应的甲和生成的丁分子个数比为 。
(3)2019年碳家族再添新成员。某研究小组合成出第一个由18个碳原子构成的环状纯碳分子,其结构如图3所示。尝试写出环状纯碳分子的化学式 。

(1)中美科学家携手发现了全硼富勒烯B40团簇(结构如图1所示),它在超导、绿色催化等领域具有重要的应用价值。B40属于 (填字母)。
A.单质
B.化合物
C.有机物
D.混合物
(2)利用催化剂可消除室内装修材料释放的甲醛,如图2所示为该反应的微观示意图。
①甲醛的化学式为 。
②参加反应的甲和生成的丁分子个数比为 。
(3)2019年碳家族再添新成员。某研究小组合成出第一个由18个碳原子构成的环状纯碳分子,其结构如图3所示。尝试写出环状纯碳分子的化学式 。
10.如图为a、b、c三种固体物质的溶解度曲线。
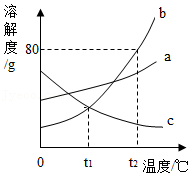
(1)t1℃时,三种物质溶解度的大小顺序是 。
(2)t2℃时,将等质量的b、c两物质加水溶解配成饱和溶液,所得溶液的质量大小关系为mb溶液 mc溶液(填“>”“<”或“=”)。
(3)t2℃时,将55g b加入50g水中充分溶解,所得溶液的质量为 g。
(4)把b物质的不饱和溶液变为饱和溶液,下列说法正确的是 。
A. 溶剂的质量只能变小
B. 溶质质量分数一定变大
C. 溶质的质量可能变大
D. 溶液的质量必然改变
E. 该饱和溶液还可以溶解其他溶质

(1)t1℃时,三种物质溶解度的大小顺序是 。
(2)t2℃时,将等质量的b、c两物质加水溶解配成饱和溶液,所得溶液的质量大小关系为mb溶液 mc溶液(填“>”“<”或“=”)。
(3)t2℃时,将55g b加入50g水中充分溶解,所得溶液的质量为 g。
(4)把b物质的不饱和溶液变为饱和溶液,下列说法正确的是 。
A. 溶剂的质量只能变小
B. 溶质质量分数一定变大
C. 溶质的质量可能变大
D. 溶液的质量必然改变
E. 该饱和溶液还可以溶解其他溶质
11.某无色溶液可能含有氯化钠、氢氧化钠、碳酸钠、硫酸钠、氯化钙中的一种或几种溶质.某化学小组为探究该溶质的成分,进行了如下实验:
Ⅰ.取无色溶液少量,滴加过量氯化钡溶液,过滤,得白色滤渣和无色滤液.
Ⅱ.向步骤Ⅰ所得白色滤渣中加入足量稀硝酸,沉淀全部消失.
Ⅲ.向步骤Ⅰ所得无色滤液中加入足量稀硝酸和硝酸银溶液,产生白色沉淀.
请回答下列问题:
(1)通过步骤Ⅰ、Ⅱ可知该溶液中一定有 ,一定没有 .
(2)步骤Ⅰ中产生沉淀的化学方程式为 .
(3)通过上述实验仍无法判断的物质有 ,要证明其是否存在,可采取的操作是(若有多种物质,任选一种证明) .
Ⅰ.取无色溶液少量,滴加过量氯化钡溶液,过滤,得白色滤渣和无色滤液.
Ⅱ.向步骤Ⅰ所得白色滤渣中加入足量稀硝酸,沉淀全部消失.
Ⅲ.向步骤Ⅰ所得无色滤液中加入足量稀硝酸和硝酸银溶液,产生白色沉淀.
请回答下列问题:
(1)通过步骤Ⅰ、Ⅱ可知该溶液中一定有 ,一定没有 .
(2)步骤Ⅰ中产生沉淀的化学方程式为 .
(3)通过上述实验仍无法判断的物质有 ,要证明其是否存在,可采取的操作是(若有多种物质,任选一种证明) .
12.某兴趣小组同学对碱式碳酸铜的分解产物进行探究.
【查阅资料】
①碱式碳酸铜受热分解的化学方程式为:Cu2(OH)2CO3
CuO+H2O+CO2↑;
②白色的无水硫酸铜遇水会变成蓝色;
③CO还原CuO的实验过程中,固体产物可能有Cu2O(氧化亚铜,红色固体)、铜.
【实验验证】验证碱式碳酸铜的分解产物,可选装置如图所示.
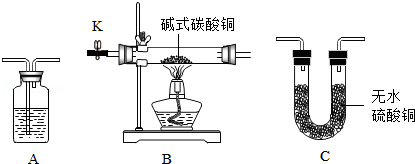
(1)A中的药品是 .
(2)甲同学将装置按 (填字母,且每套装置限用一次)顺序组合进行实验,验证出碱式碳酸铜的分解产物中有二氧化碳和水.
(3)B装置中粉末完全变黑后,乙同学为确认该黑色粉末是氧化铜而不是碳粉,设计如下实验,请完成下表:
【拓展探究】
丙同学利用上述实验后的B装置(包括其中药品),探究CO还原CuO所得固体产物的成分.
【猜想】
猜想Ⅰ是Cu2O(氧化亚铜,红色固体)
猜想Ⅱ是铜;
猜想Ⅲ是铜和氧化亚铜的混合物
【实验探究】实验装置如图
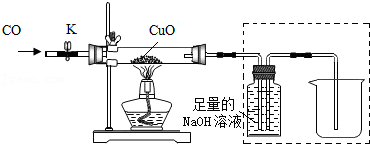
(一)实验过程
打开K,缓缓通入CO气体,一段时间后加热.当黑色固体全部变红后停止加热,继续通入CO气体直至玻璃管冷却.
(二)实验数据
(三)实验结论
(4)通过实验中获得的数据进行计算,猜想 (填“Ⅰ”、“Ⅱ”、“Ⅲ”)正确.
【查阅资料】
①碱式碳酸铜受热分解的化学方程式为:Cu2(OH)2CO3
| △ |
②白色的无水硫酸铜遇水会变成蓝色;
③CO还原CuO的实验过程中,固体产物可能有Cu2O(氧化亚铜,红色固体)、铜.
【实验验证】验证碱式碳酸铜的分解产物,可选装置如图所示.

(1)A中的药品是 .
(2)甲同学将装置按 (填字母,且每套装置限用一次)顺序组合进行实验,验证出碱式碳酸铜的分解产物中有二氧化碳和水.
(3)B装置中粉末完全变黑后,乙同学为确认该黑色粉末是氧化铜而不是碳粉,设计如下实验,请完成下表:
| 实验步骤 | 观察到的现象 | 获得结论 | 有关反应的化学方程式 |
| 取少量黑色粉末于试管中,向其中加入足量的稀硫酸,振荡 | 黑色粉末均为氧化铜 |
【拓展探究】
丙同学利用上述实验后的B装置(包括其中药品),探究CO还原CuO所得固体产物的成分.
【猜想】
猜想Ⅰ是Cu2O(氧化亚铜,红色固体)
猜想Ⅱ是铜;
猜想Ⅲ是铜和氧化亚铜的混合物
【实验探究】实验装置如图

(一)实验过程
打开K,缓缓通入CO气体,一段时间后加热.当黑色固体全部变红后停止加热,继续通入CO气体直至玻璃管冷却.
(二)实验数据
| 反应前 | 反应后 |
| 玻璃管和内盛氧化铜粉末的总质量为62.0g | 玻璃管和内盛红色粉末的总质量为61.7g |
| 玻璃管的质量为60.0g | |
(三)实验结论
(4)通过实验中获得的数据进行计算,猜想 (填“Ⅰ”、“Ⅱ”、“Ⅲ”)正确.
13.为了测定某含杂质7%的黄铜样品中铜的质量分数(黄铜主要成分为铜和锌,并含有少量杂质.杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:
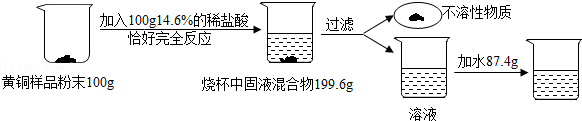
(1)该黄铜样品中铜的质量分数是多少?
(2)向过滤后所得滤液中加入87.4g水,则最终所得溶液之中溶质的质量分数是多少?

(1)该黄铜样品中铜的质量分数是多少?
(2)向过滤后所得滤液中加入87.4g水,则最终所得溶液之中溶质的质量分数是多少?
查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解
