下载高清试卷
【2021年广东省清远市清新区中考化学二模试卷】-第1页
试卷格式:2021年广东省清远市清新区中考化学二模试卷.PDF
试卷热词:最新试卷、2021年、广东试卷、清远市试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷
扫码查看解析
试卷题目
1.在抗击新冠疫情中,下列措施包含化学变化的是( )
- A. 保持安全距离
- B. 佩戴口罩
- C. 用体温计测体温
- D. 用消毒剂消毒
2.分类是学习和研究化学常用的方法。下列物质分类正确的是( )
- A. 混合物:空气、冰水混合物、石油
- B. 氧化物:Fe2O3、Mg(OH)2、CaO
- C. 合金:生铁、青铜、不锈钢
- D. 合成材料:棉花、蚕丝、塑料
3.垃圾分类已成为生活的新时尚。按照垃圾分类“四分法”,废旧金属属于( )
- A.

- B.

- C.

- D.

4.我国第一艘国产航母“山东舰”在建造时需要大量的金属钛,工业上以钛铁矿(主要成分为钛酸亚铁FeTiO3)为原料生产钛,钛酸亚铁FeTiO3中Ti的化合价为( )
- A. +1价
- B. +2价
- C. +3价
- D. +4价
5.化学实验是学习化学的重要方式,下列实验操作正确的是( )
- A.
 称量固体
称量固体 - B.
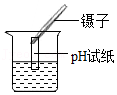 测溶液的pH
测溶液的pH - C.
 、过滤
、过滤 - D.
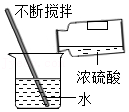 稀释浓硫酸
稀释浓硫酸
6.下列说法正确的是( )
- A. 用肥皂水可以将硬水变成软水
- B. 进入山洞探险要用手电筒做灯火实验
- C. KNO3是一种复合肥
- D. 氧气可以支持燃烧,可作燃料
7.下列化学符号中数字“2”表示的意义不符合的是( )
- A. 2NH4+:二个铵根离子
- B. H2O:一个水分子中含有一个氢分子
- C. Mg2+:一个镁离子带二个单位的正电荷
- D. O氧化铜中铜元素的化合价为正二价+2
8.根据图示信息判断,下列说法正确的是( )


- A. 氯元素的相对原子质量为35.45g
- B. 镁元素位于元素周期表第三周期
- C. x=8时,图4表示稀有气体原子
- D. 镁离子与氯离子的电子层数相等
9.根据下列实验方案进行实验,能达到相应实验目的是( )
- A.
 比较Zn和Fe的金属活动性强弱
比较Zn和Fe的金属活动性强弱 - B.
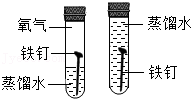 探究铁钉生锈时O2是否参与反应
探究铁钉生锈时O2是否参与反应 - C.
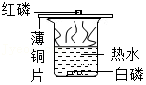 比较红磷和白磷的着火点
比较红磷和白磷的着火点 - D.
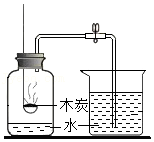 测定空气中O2的含量
测定空气中O2的含量
10.下列除去杂质的方法正确的是( )
| 选项 | 物质 | 所含杂质 | 除杂质的试剂及操作 |
| A | CO2 | HCl | 通入足量的NaOH溶液,干燥 |
| B | Cu(NO3)2溶液 | AgNO3 | 加入足量铜粉,过滤 |
| C | KCl溶液 | K2SO4 | 加入过量的BaCl2溶液、过滤 |
| D | MnO2 | KCl | 加水溶解,过滤,蒸发结晶 |
- A. A
- B. B
- C. C
- D. D
11.我国科学家最近成功合成了世界上首个全氮阴离子盐(化学式为H25N34O3Cl),该物质是超高能材料,在航空航天上可做推进剂。下列有关该物质的说法正确的是( )
- A. 属于氧化物
- B. 由四种非金属元素组成
- C. H25N34O3Cl中原子总数为62
- D. 氢、氮、氧、氯的原子个数比为1:7:8:17
12.“证据推理与模型认知”是化学学科核心素养的重要组成部分。下列推理合理的是( )
- A. 活泼金属与稀盐酸反应产生气泡,则与稀盐酸反应产生气泡的物质一定是活泼金属
- B. 碱溶液能使酚酞溶液变成红色,则能使酚酞溶液变成红色的溶液一定显碱性
- C. 氢氧化钠可与盐酸反应,则能用氢氧化钠治疗胃酸过多
- D. 中和反应一定生成盐和水,有盐和水生成的反应一定是中和反应
13.甲、乙、丙有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是( )
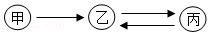
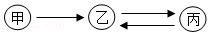
- A. NaOH、Na2CO3、CaCO3
- B. CaCO3、CO2、CO
- C. H2O2、H2O、O2
- D. C、CO2、H2CO3
14.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是( )
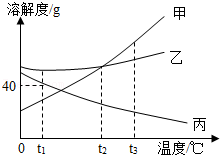

- A. t2℃时,甲、乙两种物质的溶解度相等
- B. 甲的溶解度随温度的升高而增大
- C. 分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙
- D. t1℃时,丙的饱和溶液中溶质的质量分数为40%
15.如图所示的四个图象,能正确反映对应变化关系的是( )
- A.
 表示向饱和氢氧化钙溶液加入少量生石灰
表示向饱和氢氧化钙溶液加入少量生石灰 - B.
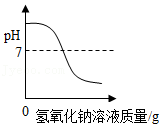 表示在稀硫酸中滴加烧碱溶液
表示在稀硫酸中滴加烧碱溶液 - C.
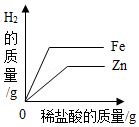 表示在质量相同的铁粉和锌粉中分别滴加过量的稀盐酸
表示在质量相同的铁粉和锌粉中分别滴加过量的稀盐酸 - D.
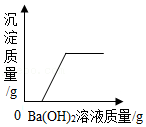 表示在稀盐酸和稀硫酸的混合溶液中滴加Ba(OH)2溶液
表示在稀盐酸和稀硫酸的混合溶液中滴加Ba(OH)2溶液
16.如图是某品牌三种不同包装的牛奶和营养成分表。回答下列问题:

(1)图1中三种包装材料中,属于有机材料的是 (填序号);图2中的“钠”指的是 (填“原子”或“元素”或“单质”)。
(2)该牛奶提供能量的营养素有 种;该牛奶中缺乏的营养素是 。
(3)奶制品一般含有丰富的钙,少年儿童每天摄取足量的钙,可避免患 (填编号)。
A.夜盲症
B.贫血症
C.甲状腺肿大
D.佝偻病
(4)塑料袋装的牛奶用热封法密封,这种塑料是 (填“热固”或“热塑”)性塑料。
(5)日常生活中用塑料袋包装食品有两种模式;一是充氮包装,一是真空包装;其中充氮包装是利用氮气在常温下 稳定的性质,来保存食物。

(1)图1中三种包装材料中,属于有机材料的是 (填序号);图2中的“钠”指的是 (填“原子”或“元素”或“单质”)。
(2)该牛奶提供能量的营养素有 种;该牛奶中缺乏的营养素是 。
(3)奶制品一般含有丰富的钙,少年儿童每天摄取足量的钙,可避免患 (填编号)。
A.夜盲症
B.贫血症
C.甲状腺肿大
D.佝偻病
(4)塑料袋装的牛奶用热封法密封,这种塑料是 (填“热固”或“热塑”)性塑料。
(5)日常生活中用塑料袋包装食品有两种模式;一是充氮包装,一是真空包装;其中充氮包装是利用氮气在常温下 稳定的性质,来保存食物。
17.化学与人类生活密切相关,下列与化学有关的知识请按要求填写。
(1)《天工开物》中记载“铁器淬与胆矾水中,即成铜色也”。书中提及的“胆矾水”为硫酸铜溶液,该反应的化学方程式为 ;该化学反应的基本反应类型是 。
(2)制作USB数据线要用到铁、铜等材料。这主要利用了铁、铜的 性(填“导电”或“导热”)。
(3)
O、
O、
O分别表示氧元素的三种原子,可简写成16O、17O、18O。其中18O在化学原理探究和核化学方面有广泛应用。电解重氧水(H218O)可以获得重氧(18O2),请据如图2回答:
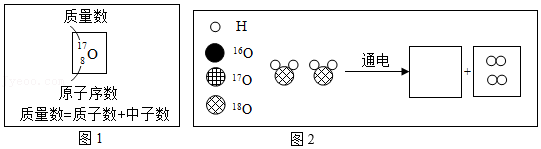
①16O、17O、18O三种原子中, 数目不相等(填“质子”“中子”或“电子”)。
②在如图2的小方框中,把电解H218O恰好完全反应的生成物微观粒子补画齐全。
③写出电解重氧水H218O的化学方程式 。
(1)《天工开物》中记载“铁器淬与胆矾水中,即成铜色也”。书中提及的“胆矾水”为硫酸铜溶液,该反应的化学方程式为 ;该化学反应的基本反应类型是 。
(2)制作USB数据线要用到铁、铜等材料。这主要利用了铁、铜的 性(填“导电”或“导热”)。
(3)
| 16 |
| 8 |
| 17 |
| 8 |
| 18 |
| 8 |

①16O、17O、18O三种原子中, 数目不相等(填“质子”“中子”或“电子”)。
②在如图2的小方框中,把电解H218O恰好完全反应的生成物微观粒子补画齐全。
③写出电解重氧水H218O的化学方程式 。
18.在实验台上有下列仪器,做如下实验。回答下列问题:

(1)a的仪器名称是 。
(2)用高锰酸钾制取并收集较纯净的氧气,用 装置(从仪器A﹣H里选);若用J装置收集并测量氧气的体积,应在 (填“d”或“e”)端连接量筒。
(3)用石灰石和稀盐酸制取并收集二氧化碳,用 装置(从仪器A﹣H里选);若用K装置制取二氧化碳便于控制反应的发生与停止,制取时应将大理石放在 (填“b”或“c”)。写出该反应的化学方程式 。
(4)取5g NaCl配制100g 5%的盐水,发现质量分数大于5%,可能使用量筒量蒸馏水时,观察液面眼睛发生 (填“仰”或“俯”)视。
(5)装置B气密性的检查方法是: 。

(1)a的仪器名称是 。
(2)用高锰酸钾制取并收集较纯净的氧气,用 装置(从仪器A﹣H里选);若用J装置收集并测量氧气的体积,应在 (填“d”或“e”)端连接量筒。
(3)用石灰石和稀盐酸制取并收集二氧化碳,用 装置(从仪器A﹣H里选);若用K装置制取二氧化碳便于控制反应的发生与停止,制取时应将大理石放在 (填“b”或“c”)。写出该反应的化学方程式 。
(4)取5g NaCl配制100g 5%的盐水,发现质量分数大于5%,可能使用量筒量蒸馏水时,观察液面眼睛发生 (填“仰”或“俯”)视。
(5)装置B气密性的检查方法是: 。
19.化学兴趣小组用如图的两个实验探究酸、碱、盐之间的化学反应。
(1)甲实验中,发生反应的化学方程式为 ;乙实验时,观察到的现象是 。
某同学把甲、乙反应后的溶液倒入同一烧杯中,发现溶液显红色,决定继续对烧杯内溶液中溶质的成分进行探究。
【提出问题】反应后所得溶液中溶质的成分是什么?
【查阅资料】Na2SO4、BaCl2溶液呈中性。
(2)【提出猜想】
①烧杯内溶液中的溶质成分可能有:
猜想Ⅰ:Na2CO3、Na2SO4;
猜想Ⅱ ;
猜想Ⅲ:NaOH、Na2SO4、Na2CO3。
【实验探究】
【实验结论】
(3)根据操作a的现象可知,猜想 不成立。若操作b的现象A为“白色沉淀不溶解”,则猜想 成立;若现象A为“白色沉淀部分溶解并产生气泡”,则猜想 成立,沉淀部分溶解的反应方程式为 。
【拓展反思】
(4)该同学认为,若操作a的现象为“溶液红色褪去”,则不需要进行操作b即可得出结论。他的理由是 。
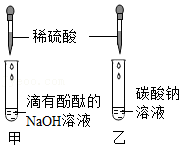
(1)甲实验中,发生反应的化学方程式为 ;乙实验时,观察到的现象是 。
某同学把甲、乙反应后的溶液倒入同一烧杯中,发现溶液显红色,决定继续对烧杯内溶液中溶质的成分进行探究。
【提出问题】反应后所得溶液中溶质的成分是什么?
【查阅资料】Na2SO4、BaCl2溶液呈中性。
(2)【提出猜想】
①烧杯内溶液中的溶质成分可能有:
猜想Ⅰ:Na2CO3、Na2SO4;
猜想Ⅱ ;
猜想Ⅲ:NaOH、Na2SO4、Na2CO3。
【实验探究】
| 实验操作 | 实验现象 |
| a.取烧杯中的溶液于试管中,加入过量BaCl2溶液 | 溶液红色不褪去;产生白色沉淀 |
| b.再向试管中加入足量的稀硝酸 | 溶液红色褪去;出现现象A |
【实验结论】
(3)根据操作a的现象可知,猜想 不成立。若操作b的现象A为“白色沉淀不溶解”,则猜想 成立;若现象A为“白色沉淀部分溶解并产生气泡”,则猜想 成立,沉淀部分溶解的反应方程式为 。
【拓展反思】
(4)该同学认为,若操作a的现象为“溶液红色褪去”,则不需要进行操作b即可得出结论。他的理由是 。

20.碲(Te)广泛用于彩色玻璃和陶瓷工艺。用某工业废渣(主要含有TeO2、少量Ag、Au)为原料制备碲并回收金和银的一种工艺流程如图:

资料:TeO2不溶于水,易溶于较浓的强酸或强碱。
(1)类比CO2与NaOH的反应,写出“碱浸”时发生反应的化学方程式: 。
(2)“碱浸”后过滤所需的玻璃仪器有: 、漏斗、玻璃棒。其中玻璃棒的作用是 。此时滤渣成分为 。
(3)“沉碲”时,缓慢加入硫酸,并不断搅拌。此时发生两个化学反应:一个是过量的NaOH溶液与硫酸的反应、另一个是: +H2SO4═Na2SO4+H2O+ ;为了生成TeO2沉淀需控制溶液的pH在4.5~5.0之间,其原因是 。
(4)“酸溶”后,在TeCl4溶液中通入SO2,反应生成碲和初中化学中两种常见的酸,则该反应的化学方程式是 。

资料:TeO2不溶于水,易溶于较浓的强酸或强碱。
(1)类比CO2与NaOH的反应,写出“碱浸”时发生反应的化学方程式: 。
(2)“碱浸”后过滤所需的玻璃仪器有: 、漏斗、玻璃棒。其中玻璃棒的作用是 。此时滤渣成分为 。
(3)“沉碲”时,缓慢加入硫酸,并不断搅拌。此时发生两个化学反应:一个是过量的NaOH溶液与硫酸的反应、另一个是: +H2SO4═Na2SO4+H2O+ ;为了生成TeO2沉淀需控制溶液的pH在4.5~5.0之间,其原因是 。
(4)“酸溶”后,在TeCl4溶液中通入SO2,反应生成碲和初中化学中两种常见的酸,则该反应的化学方程式是 。
21.某实验小组为了研究在其他条件相同时,反应物的接触面积对反应速率的影响。实验装置如图一所示,他们用等质量不同形状的金属锌(所用金属锌均不含任何杂质)和稀盐酸反应(见下表),实验中使用传感器装置测算生成氢气的体积,绘制氢气体积随时间变化的曲线如图二所示。
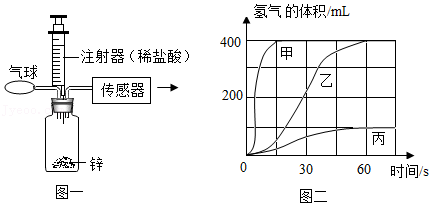
(1)小组按照图一中装置进行的三个实验中,实验 (填实验编号)反应速率最慢,在二中的曲线 (填“甲”、“乙”或“丙”)代表的是实验Ⅲ,从曲线甲、乙、丙得出探究图二中的曲线结论是: 。
(2)分析表中锌和稀盐酸的用量可知: (填物质名称)反应消耗完;请计算以上任意一组实验中生成氢气的质量(写出具体计算过程)。
(3)分析上表数据,请在图三中画出在6.5g锌中加入0~150g稀盐酸过程中,产生氢气质量对应的变化曲线图,并标注必要的数值。


| 实验编号 | 药品 |
| Ⅰ | 6.5g锌块、150g含HCl 7.3%足量的稀盐酸 |
| Ⅱ | 6.5g锌粒、150g含HCl 7.3%足量的稀盐酸 |
| Ⅲ | 6.5g锌粉、150g含HCl 7.3%足量的稀盐酸 |
(1)小组按照图一中装置进行的三个实验中,实验 (填实验编号)反应速率最慢,在二中的曲线 (填“甲”、“乙”或“丙”)代表的是实验Ⅲ,从曲线甲、乙、丙得出探究图二中的曲线结论是: 。
(2)分析表中锌和稀盐酸的用量可知: (填物质名称)反应消耗完;请计算以上任意一组实验中生成氢气的质量(写出具体计算过程)。
(3)分析上表数据,请在图三中画出在6.5g锌中加入0~150g稀盐酸过程中,产生氢气质量对应的变化曲线图,并标注必要的数值。

查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解