下载高清试卷
【2021-2022学年山东省威海市文登区九年级(上)期中化学试卷(五四学制)】-第1页
试卷格式:2021-2022学年山东省威海市文登区九年级(上)期中化学试卷(五四学制).PDF
试卷热词:最新试卷、2022年、山东试卷、威海市试卷、化学试卷、九年级上学期试卷、期中试卷、初中试卷
扫码查看解析
试卷题目
1.一定温度下,一定质量的氢氧化钠固体溶于水制成溶液.下列有关的量不随水的质量改变而改变的是( )
- A. 溶液质量分数
- B. 溶液的pH
- C. 氢氧化钠的溶解度
- D. 最多能吸收二氧化碳的质量
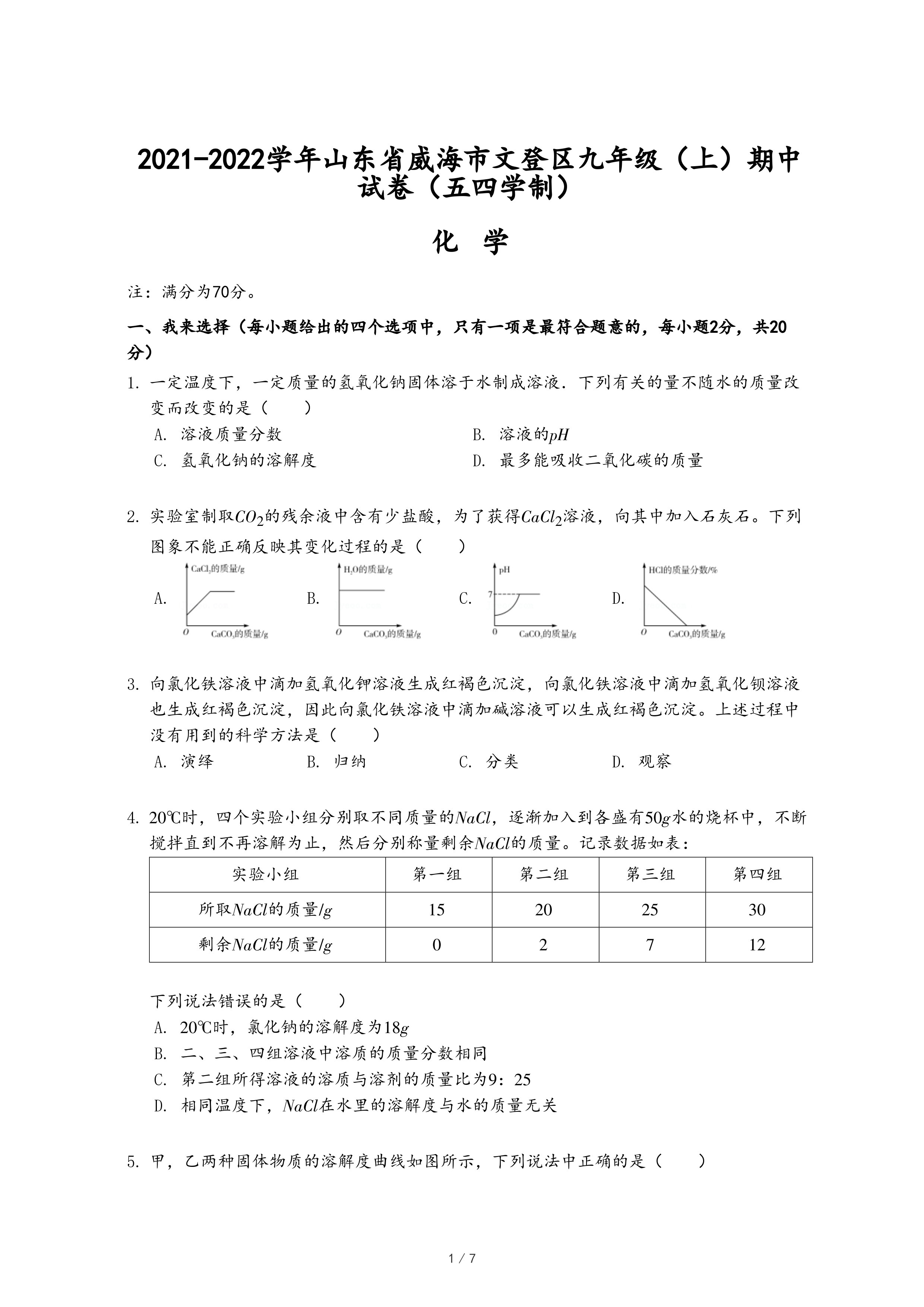
2.实验室制取CO2的残余液中含有少盐酸,为了获得CaCl2溶液,向其中加入石灰石。下列图象不能正确反映其变化过程的是( )
- A.

- B.

- C.

- D.
3.向氯化铁溶液中滴加氢氧化钾溶液生成红褐色沉淀,向氯化铁溶液中滴加氢氧化钡溶液也生成红褐色沉淀,因此向氯化铁溶液中滴加碱溶液可以生成红褐色沉淀。上述过程中没有用到的科学方法是( )
- A. 演绎
- B. 归纳
- C. 分类
- D. 观察
4.20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如表:
下列说法错误的是( )
| 实验小组 | 第一组 | 第二组 | 第三组 | 第四组 |
| 所取NaCl的质量/g | 15 | 20 | 25 | 30 |
| 剩余NaCl的质量/g | 0 | 2 | 7 | 12 |
下列说法错误的是( )
- A. 20℃时,氯化钠的溶解度为18g
- B. 二、三、四组溶液中溶质的质量分数相同
- C. 第二组所得溶液的溶质与溶剂的质量比为9:25
- D. 相同温度下,NaCl在水里的溶解度与水的质量无关
5.甲,乙两种固体物质的溶解度曲线如图所示,下列说法中正确的是( )
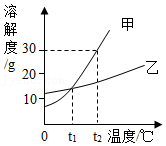

- A. 甲物质的溶解度大于乙物质的溶解度
- B. 分别将t2℃时甲、乙两种物质的溶液降温到t1℃,一定有晶体析出
- C. t2℃时将30g甲物质放入100g水中,所得溶液中溶质的质量分数为30%
- D. 在t1℃时,用甲,乙两种固体和水分别配制等质量的两种物质的饱和溶液,需要量取相同体积的水
6.下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是( )
| 序号 | 实验目的 | 实验过程 |
| ① | 证明变质 | 取少量溶液,滴加盐酸,将生成的气体通入石灰水 |
| ② | 确定成分 | 取少量溶液,加入石灰水,过滤,向滤液中滴加酚酞溶液 |
| ③ | 测定纯度 | 取一定量溶液,加入浓盐酸,用氢氧化钠固体吸收气体,称量 |
| ④ | 除去杂质 | 取溶液,滴加石灰水至恰好完全反应,过滤 |
- A. ②③
- B. ①③
- C. ②④
- D. ①④
7.下列哪种方法不可能用于分离饱和溶液中的溶质和溶剂( )
- A. 过滤
- B. 蒸发
- C. 蒸馏
- D. 结晶
8.小明要配制50g质量分数为14%的氢氧化钠溶液制作“叶脉书签”,下列关于配制该溶液的说法不正确的是( )
①若用氢氧化钠固体配制,需称取氢氧化钠固体7.0g
②用托盘天平称氢氧化钠固体时,在两盘各放一张质量相等的纸
③选用200mL量筒量取所需水的体积
④实验中用到的玻璃仪器有烧杯、量筒、玻璃棒和试剂瓶
⑤用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小
①若用氢氧化钠固体配制,需称取氢氧化钠固体7.0g
②用托盘天平称氢氧化钠固体时,在两盘各放一张质量相等的纸
③选用200mL量筒量取所需水的体积
④实验中用到的玻璃仪器有烧杯、量筒、玻璃棒和试剂瓶
⑤用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小
- A. ①③
- B. ②③⑤
- C. ③⑤
- D. ②④⑤
9.下列依据实验目的所设计的实验方案中,正确的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 除去NaCl溶液中的Na2CO3 | 加适量稀硫酸 |
| B | 除去CaO中的CaCO3 | 加水溶解,过滤 |
| C | 除去CO2中的HCl气体 | 将混合气体通入NaOH溶液 |
| D | 除去KNO3溶液中的KCl | 加适量的AgNO3溶液,过滤 |
- A. A
- B. B
- C. C
- D. D
10.为了探究溶质在水中溶解速率的影响因素,某学习小组设计了如下实验:
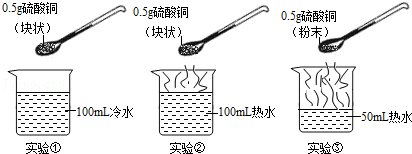
下列说法中正确的是 ( )

下列说法中正确的是 ( )
- A. 对比实验①和②,可探究水的温度对溶质在水中溶解速率的影响
- B. 对比实验②和③,可探究水的温度对溶质在水中溶解速率的影响
- C. 对比实验②和③,可探究固体溶质的形态对溶质在水中溶解速率的影响
- D. 对比实验①和③,可探究固体溶质的形态对溶质在水中溶解速率的影响
11.宏观辨识与微观探析
我们生活在物资的世界,学习化学可以让我们更好的认识和应用物质,下列现象都是由化学变化引起的:
①工业上用石灰水和纯碱溶液制取火碱
②利用可燃冰燃烧放出大量的热
③纯碱溶液能使酚酞试液变红,具有很好的清除油污的效果
④不能用铝制易拉罐盛食醋,会腐蚀容器
(1)宏观物质的微观构成
(2)物质的宏观变化和微观实质
宏观变化是构成物质的微粒相互作用的结果,请写出变化②和变化④的化学方程式是 、 ,变化①中实际参加反应的离子名称是 ,请另写一个与反应①的反应物不同,但反应实质相同的化学方程式 。
我们生活在物资的世界,学习化学可以让我们更好的认识和应用物质,下列现象都是由化学变化引起的:
①工业上用石灰水和纯碱溶液制取火碱
②利用可燃冰燃烧放出大量的热
③纯碱溶液能使酚酞试液变红,具有很好的清除油污的效果
④不能用铝制易拉罐盛食醋,会腐蚀容器
(1)宏观物质的微观构成
| 物质名称 | 金属铝 | 二氧化硫 | 烧碱 | ||
| 化学式 | Ca(OH)2 | ||||
| 构成物质微粒 | Na+、CO32﹣ | ||||
| 物质类别 |
(2)物质的宏观变化和微观实质
宏观变化是构成物质的微粒相互作用的结果,请写出变化②和变化④的化学方程式是 、 ,变化①中实际参加反应的离子名称是 ,请另写一个与反应①的反应物不同,但反应实质相同的化学方程式 。
12.物质的用途主要是由他们的性质决定的,请根据下列碱的用途所体现出的相关化学性质将它们分类。
①用石灰浆刷墙壁
②用氢氧化镁治疗胃酸过多
③用熟石灰改良酸性土壤
④用熟石灰和氯化铵制取氨气
⑤用烧碱溶液吸收硫酸厂产生的二氧化硫

①用石灰浆刷墙壁
②用氢氧化镁治疗胃酸过多
③用熟石灰改良酸性土壤
④用熟石灰和氯化铵制取氨气
⑤用烧碱溶液吸收硫酸厂产生的二氧化硫

13.制做松花蛋所用的配料主要有纯碱、食盐、生石灰、草木灰(主要成分是碳酸钾)、水等物质,制做时需要将它们混合并充分搅拌。
根据所学知识写出能发生反应的化学方程式 、 、 。
根据所学知识写出能发生反应的化学方程式 、 、 。
14.研究物质的性质时,我们会借助多种科学方法,提高研究效率。例如:对比是把两个相反、相对的事物或同一事物相反、相对的两个方面放在一起,用比较的方法加以描述或说明。比较是指对比几种同类事物的异同、高下。
(1)稀盐酸和稀硫酸具有一些相似的化学性质,例如,它们都能使紫色石蕊试液变成 色等,据此,我们可以(对比、比较、归纳、演绎) 出酸类物质具有一些相似的化学性质。通过对稀盐酸和稀硫酸的构成粒子进行(对比、比较、归纳、演绎) ,可以发现它们具有相似化学性质的原因是组成中含有(填粒子符号) 。
(2)氢硫酸(H2S)的水溶液中含有H+,利用(对比、比较、归纳、演绎) 方法,我们可以预测氢硫酸溶液能与下列(填序号) 发生反应。
①氦气
②熟石灰
③铜
④稀盐酸
⑤氧化铜
(1)稀盐酸和稀硫酸具有一些相似的化学性质,例如,它们都能使紫色石蕊试液变成 色等,据此,我们可以(对比、比较、归纳、演绎) 出酸类物质具有一些相似的化学性质。通过对稀盐酸和稀硫酸的构成粒子进行(对比、比较、归纳、演绎) ,可以发现它们具有相似化学性质的原因是组成中含有(填粒子符号) 。
(2)氢硫酸(H2S)的水溶液中含有H+,利用(对比、比较、归纳、演绎) 方法,我们可以预测氢硫酸溶液能与下列(填序号) 发生反应。
①氦气
②熟石灰
③铜
④稀盐酸
⑤氧化铜
15.2021年6月8日是第13个“世界海洋日”,烟台有漫长的海岸线,蕴藏着丰富的海洋资源。某兴趣小组设计的综合利用海水的部分流程图如图,据图回答:
(1)海水制镁。步骤①②③是利用母液制镁的流程,该流程中发生中和反应的化学方程式是 。步骤①中制取氢氧化镁选择向母液中加入石灰乳,而不向海水中直接加入石灰乳,原因是 。
(2)海水晒盐。通常采用 (填“降温”或“蒸发”)结晶的方法使海水中的氯化钠析出。通过步骤④除去粗盐溶液中含有的MgCl2、Na2SO4、CaCl2等可溶性杂质,需要依次加入过量的BaCl2溶液、过量的Na2CO3溶液、过量的NaOH溶液,然后过滤,在滤液中加入适量的稀盐酸。其中加入过量的Na2CO3溶液的目的是 。
(3)海水制碱。步骤⑧⑨是氨碱法制纯碱的流程,步骤⑧中需要向NaCl饱和溶液中先后加入的两种物质是 (写化学式)。步骤⑨中发生反应的化学方程式是 。侯氏制碱法制取的纯碱经常含有氯化钠杂质,如何证明碳酸钠中是否含有氯化钠?(写出实验步骤、现象和结论) 。

(1)海水制镁。步骤①②③是利用母液制镁的流程,该流程中发生中和反应的化学方程式是 。步骤①中制取氢氧化镁选择向母液中加入石灰乳,而不向海水中直接加入石灰乳,原因是 。
(2)海水晒盐。通常采用 (填“降温”或“蒸发”)结晶的方法使海水中的氯化钠析出。通过步骤④除去粗盐溶液中含有的MgCl2、Na2SO4、CaCl2等可溶性杂质,需要依次加入过量的BaCl2溶液、过量的Na2CO3溶液、过量的NaOH溶液,然后过滤,在滤液中加入适量的稀盐酸。其中加入过量的Na2CO3溶液的目的是 。
(3)海水制碱。步骤⑧⑨是氨碱法制纯碱的流程,步骤⑧中需要向NaCl饱和溶液中先后加入的两种物质是 (写化学式)。步骤⑨中发生反应的化学方程式是 。侯氏制碱法制取的纯碱经常含有氯化钠杂质,如何证明碳酸钠中是否含有氯化钠?(写出实验步骤、现象和结论) 。
16.某小组以稀硫酸与氢氧化钠溶液是否能发生反应为课题进行研究.同学向烧杯中的氢氧化钠溶液加入稀硫酸,一会发现忘记滴加指示剂,因此他们停止滴加稀硫酸,并对烧杯内稀硫酸和氢氧化钠溶液是否发生反应进行探究.
(1)小组同学设计了以下实验方案:
(2)写出该反应的化学方程式:
同学们一致讨论认为,不用上述方法,用其他试剂也可以证明稀硫酸与氢氧化钠溶液能发生反应,于是分成甲、乙两组实验.
甲组实验:探究CuSO4溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应.
操作及现象:向氢氧化钠溶液中加入足量稀硫酸时无明显现象,再滴加CuSO4溶液时没有出现沉淀.
(3)结论:通过以上实验,你认为用CuSO4溶液 (填可以或不可以)证明稀硫酸与氢氧化钠溶液能发生反应.
乙组实验:探究BaCl2溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应.
操作及现象:向稀硫酸中加入足量氢氧化钠溶液时无明显现象,再滴加BaCl2溶液时出现白色沉淀.
(4)结论:通过以上实验,你认为用BaCl2溶液 (填可以或不可以)证明稀硫酸与氢氧化钠溶液能发生反应.理由是: .
(1)小组同学设计了以下实验方案:
| 实验步骤 | 实验现象 | 实验结论 |
| 在白瓷板上放一小片pH试纸,用玻璃棒蘸取少量反应后的溶液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读溶液的pH | pH 7(填“>”、“=”或“<”) | 稀硫酸与氢氧化钠溶液发生了反应,且稀硫酸过量了. |
(2)写出该反应的化学方程式:
同学们一致讨论认为,不用上述方法,用其他试剂也可以证明稀硫酸与氢氧化钠溶液能发生反应,于是分成甲、乙两组实验.
甲组实验:探究CuSO4溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应.
操作及现象:向氢氧化钠溶液中加入足量稀硫酸时无明显现象,再滴加CuSO4溶液时没有出现沉淀.
(3)结论:通过以上实验,你认为用CuSO4溶液 (填可以或不可以)证明稀硫酸与氢氧化钠溶液能发生反应.
乙组实验:探究BaCl2溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应.
操作及现象:向稀硫酸中加入足量氢氧化钠溶液时无明显现象,再滴加BaCl2溶液时出现白色沉淀.
(4)结论:通过以上实验,你认为用BaCl2溶液 (填可以或不可以)证明稀硫酸与氢氧化钠溶液能发生反应.理由是: .
17.兴趣小组的同学为探究在空气中久置的某氢氧化钠样品是否变质,设计了如图所示的A、B、C、D四组探究实验。
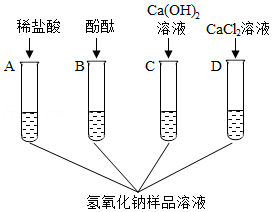
【查阅资料】氯化钙、氯化钡溶液都呈中性。
【实验探究】取适量该氢氧化钠样品,加足量的水溶解,将得到的溶液分别加入到四支试管中,再向四支试管中分别加入稀盐酸(足量)、酚酞试液、氢氧化钙溶液、氯化钙溶液,如图所示:
【分析与结论】
(1)上述四组实验中不能达到实验目的的是 (填字母序号)。
(2)实验A中,观察到 的现象,说明该氢氧化钠样品已经变质。
(3)实验D中,证明该氢氧化钠样品已经变质的反应的化学方程式是 。
(4)要证明该氢氧化钠部分变质,请写出实验步骤、可能的现象及相关推理 。
(5)若实验证明氢氧化钠部分变质,为测定其中氢氧化钠的质量分数,该同学采用沉淀法进行如下操作:①取15g样品于烧杯中,加入足量水配成溶液;②在样品溶液中加入足量的氯化钡溶液;③待反应完全后,过滤。有关数据如表:
请回答下列问题:
①原样品中氢氧化钠的质量分数是 (保留到0.1%)。
②另取样品溶于水,若要除去杂质获取氢氧化钠溶液,可以向其中加入 溶液,然后 (填操作名称)即可。

【查阅资料】氯化钙、氯化钡溶液都呈中性。
【实验探究】取适量该氢氧化钠样品,加足量的水溶解,将得到的溶液分别加入到四支试管中,再向四支试管中分别加入稀盐酸(足量)、酚酞试液、氢氧化钙溶液、氯化钙溶液,如图所示:
【分析与结论】
(1)上述四组实验中不能达到实验目的的是 (填字母序号)。
(2)实验A中,观察到 的现象,说明该氢氧化钠样品已经变质。
(3)实验D中,证明该氢氧化钠样品已经变质的反应的化学方程式是 。
(4)要证明该氢氧化钠部分变质,请写出实验步骤、可能的现象及相关推理 。
(5)若实验证明氢氧化钠部分变质,为测定其中氢氧化钠的质量分数,该同学采用沉淀法进行如下操作:①取15g样品于烧杯中,加入足量水配成溶液;②在样品溶液中加入足量的氯化钡溶液;③待反应完全后,过滤。有关数据如表:
| 反应前 | 反应后 | |
| 烧杯和样品溶液总质量/g | 加入氯化钡溶液质量/g | 过滤后烧杯和溶液总质量/g(不计滤液损失) |
| 105 | 65 | 150.3 |
请回答下列问题:
①原样品中氢氧化钠的质量分数是 (保留到0.1%)。
②另取样品溶于水,若要除去杂质获取氢氧化钠溶液,可以向其中加入 溶液,然后 (填操作名称)即可。
18.小慧称取20g某氯化铜样品放入烧杯中,加入50g水使氯化铜完全溶解,逐滴加入一定溶质质量分数的氢氧化钾溶液,反应生成沉淀的质量与所加氢氧化钾溶液质量的关系如图所示(提示①CuCl2+2KOH═2KCl+Cu(OH)2↓,氯化铜样品中所含杂质既不溶于水,也不参与反应。),试计算:
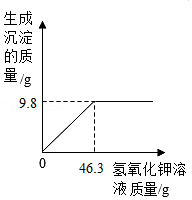
(1)样品中氯化铜的质量为多少克?
(2)当恰好完全反应时,所得溶液的溶质质量分数是多少?

(1)样品中氯化铜的质量为多少克?
(2)当恰好完全反应时,所得溶液的溶质质量分数是多少?
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解