下载高清试卷
【2020年安徽省淮北市中考化学二模试卷】-第1页
试卷格式:2020年安徽省淮北市中考化学二模试卷.PDF
试卷热词:最新试卷、2020年、安徽试卷、淮北市试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷

扫码查看解析
试卷题目
1.下列实验过程中,主要发生化学变化的是( )
- A.
 饱和石灰水受热后变浑浊
饱和石灰水受热后变浑浊 - B.
 品红扩散
品红扩散 - C.
 煤制煤气
煤制煤气 - D.
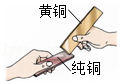 比较硬度
比较硬度
2.化学与我们的日常生活密切相关,下列观点中,不合理的是( )
- A. 用84消毒液对环境进行消毒
- B. 食用加铁酱油预防缺铁性贫血
- C. 加入适量的食盐进行菜品调味
- D. 平时常喝碳酸饮料代替白开水
3.钪(Sc)是一种“工业的维生素”。如图为钪在元素周期表中的相关信息及其原子的结构示意图。下列关于钪的说法正确的是( )
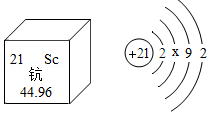

- A. 属非金属元素
- B. 相对原子质量是21
- C. 原子结构示意图中x=10
- D. 原子核内有24个中子
4.以下错误的操作都可能引起玻璃仪器破裂,有4位同学分别进行了纠正,按照他们的方法纠正后玻璃仪器仍可能破裂的是( )
- A.
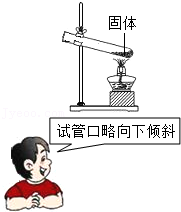
- B.

- C.
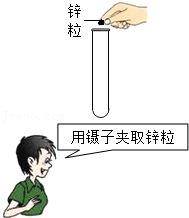
- D.

5.以下是一个化学反应的微观示意图,从示意图中获取的信息不正确的是( )
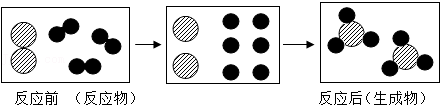

- A. 分子在化学反应中可分为原子
- B. 反应前后元素的种类没有改变
- C. 化学反应前后原子的种类不变
- D. 生成物肯定是一种氧化物
6.今年5月21日是联合国确定的首个“国际茶日”。EGCG(化学式为C22H18O11)是一种绿茶提取物,具有抗菌、抗病毒等作用。下列关于该物质的说法正确的是( )
- A. 属于氧化物
- B. 由碳原子、氢原子、氧原子构成
- C. 碳元素的质量分数最大
- D. 氢元素与氧元素的质量比为18:11
7.推理是一种重要的化学思维方法,以下推理合理的是( )
- A. 因为H2O和H2O2的组成元素相同,所以它们的化学性质相同
- B. 中和反应一定有盐生成,所以有盐生成的反应一定是中和反应
- C. 分子、原子都是不带电的粒子,但是不带电的粒子不一定是分子、原子
- D. 二氧化碳能灭火,所以不燃烧、也不支持燃烧的气体一定是二氧化碳
8.构建模型分类整理是学习化学的重要方法,下列化学知识的归纳,正确的是( )
- A.
 溶液关系
溶液关系 - B.
 净化水的方法
净化水的方法 - C.
 铁合金碳元素含量
铁合金碳元素含量 - D.
 金属活动性
金属活动性
9.下列所示实验设计中,能够达到目的是( )
- A.
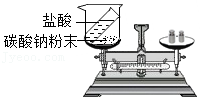 验证质量守恒定律
验证质量守恒定律 - B.
 探究二氧化碳能与水反应
探究二氧化碳能与水反应 - C.
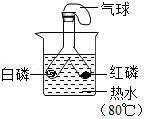 探究燃烧的条件
探究燃烧的条件 - D.
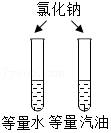 探究溶剂性质对溶解的影响
探究溶剂性质对溶解的影响
10.以下归纳和总结完全正确的一组是( )
| A、对鉴别方法的认识 | B、对安全的认识 |
| ①区分硬水和软水,加肥皂水搅拌②区分棉纤维和羊毛纤维,点燃后闻气味③区分硫酸铵和硫酸钾,加熟石灰粉末研磨 | ①点燃可燃性气体前一定要验纯②煤矿矿井要保持通风、严禁烟火③海鲜食品喷洒甲醛溶液防腐 |
| C、对现象的认识 | D、对防锈的认识 |
| ①气体压缩,气体分子之间的间隔变小②活性炭除去异味,活性炭具有吸附性③喝汽水打嗝,气体溶解度随温度升高而增大 | ①自行车的支架喷油漆防锈②菜刀用后及时洗净擦干③保留铁锈可防止铁进一步锈蚀 |
- A. A
- B. B
- C. C
- D. D
11.已知:常温下CaCl2、NaCl的水溶液均呈中性。向含有HCl与CaCl2的混合溶液中逐滴滴入过量的X,溶液pH与滴入X的量的关系如图所示,则X可能是下列物质中的( )
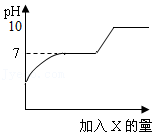

- A. 水
- B. 氢氧化钠溶液
- C. 纯碱溶液
- D. 硝酸银溶液
12.根据如图所示溶解度曲线判断,下列说法正确的是( )


- A. 28℃时,将40g KNO3溶于100g水得到饱和溶液
- B. 将43℃的Na2CO3饱和溶液升高10℃,有晶体析出
- C. 三种物质的饱和溶液由40℃降温至23℃,所得溶液中溶质质量:m(NaCl)=m(KNO3)>m(Na2CO3)
- D. 除去KNO3中混有的Na2CO3,可在40℃配成饱和溶液,再降温结晶、过滤
13.根据如图装置,结合所学化学知识回答下列问题。
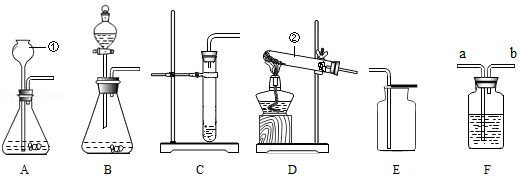
(1)请写出图中标号仪器的名称:① ;② ;
(2)实验室制取少量二氧化碳时,发生装置最好选用 ;如需随时控制生产气体的量并节约药品,发生装置最好选用 (填编号);反应的化学方程式是 。
(3)实验室用高锰酸钾制取氧气时,发生装置应选用 (填编号);写出其反应的化学方程式 。
(4)E装置都可以用来收集氧气,说明氧气具有的性质是 。
(5)如图F是某学生设计的一种有洗气、贮气等用途的装置。 欲除去O2中混有的水蒸气,瓶中可盛 ;当用排水集气法收集氢气时,瓶内先装满水,气体从 (填“a”或“b”,下同)处导管通入。

(1)请写出图中标号仪器的名称:① ;② ;
(2)实验室制取少量二氧化碳时,发生装置最好选用 ;如需随时控制生产气体的量并节约药品,发生装置最好选用 (填编号);反应的化学方程式是 。
(3)实验室用高锰酸钾制取氧气时,发生装置应选用 (填编号);写出其反应的化学方程式 。
(4)E装置都可以用来收集氧气,说明氧气具有的性质是 。
(5)如图F是某学生设计的一种有洗气、贮气等用途的装置。 欲除去O2中混有的水蒸气,瓶中可盛 ;当用排水集气法收集氢气时,瓶内先装满水,气体从 (填“a”或“b”,下同)处导管通入。
14.Fe(OH)3可用于制造医药、颜料等,其胶体可用于净水。化学兴趣小组利用废铁屑来制备Fe(OH)3粉末的流程如图:

提示:①废铁屑主要为表面附有大量铁锈的铁。
②Fe(OH)3难溶于水,加热时会分解生成氧化铁和水。
③H2O2溶液能将FeSO4氧化成Fe2(SO4)3。
(1)将废铁屑粉碎的目的是 ,操作a的名称为 。
(2)滤液Ⅰ的溶质中除了FeSO4外,还有 。(写化学式)
(3)反应Ⅲ中生成Fe(OH)3的化学方程式是 ,该反应的基本反应类型是 。
(4)操作b后对 Fe(OH)3进行洗涤,确认是否洗涤干净的方法是:
①操作 ;
②现象及结论 。
(5)得到的Fe(OH)3经洗涤后只能放在阴凉处晾干,而不能用酒精灯烘干否则会变质,原因是 (用化学方程式表示)。

提示:①废铁屑主要为表面附有大量铁锈的铁。
②Fe(OH)3难溶于水,加热时会分解生成氧化铁和水。
③H2O2溶液能将FeSO4氧化成Fe2(SO4)3。
(1)将废铁屑粉碎的目的是 ,操作a的名称为 。
(2)滤液Ⅰ的溶质中除了FeSO4外,还有 。(写化学式)
(3)反应Ⅲ中生成Fe(OH)3的化学方程式是 ,该反应的基本反应类型是 。
(4)操作b后对 Fe(OH)3进行洗涤,确认是否洗涤干净的方法是:
①操作 ;
②现象及结论 。
(5)得到的Fe(OH)3经洗涤后只能放在阴凉处晾干,而不能用酒精灯烘干否则会变质,原因是 (用化学方程式表示)。
15.酱油在使用及储藏过程中颜色会变深,逐渐降低品质。实验小组通过实验研究温度、氧气、光照3个因素对酱油颜色的影响。
【查阅资料】①通过色差仪检测L*值可监控酱油颜色变化,酱油颜色越深,L*值越小。
②保鲜瓶具有的特点是挤出盛放的物质后,空气不会进入。
【实验准备】
将等量样品(同品牌、同批次、初始L*值为43.82的酱油)分装到500 mL的不同容器中,密封。
【进行实验】
实验1:将装有样品的多个透明玻璃瓶置于不同温度的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。
实验2:将装有样品的两个容器置于28℃的恒温箱中。每15天,分别倒出100 mL酱油,剩余样品放回恒温箱。用色差仪检测倒出样品的L*值,结果如下。
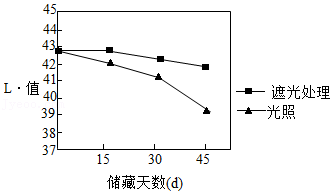
实验3:将装有样品的多个容器置于28℃的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。
【解释与结论】
(1)实验1得出的结论是 。
(2)实验2的目的是 。
(3)实验3欲研究光照对酱油颜色的影响,应选用的容器是 。
(4)家庭常使用透明玻璃瓶盛放酱油。解释“在相同时间内,使用过的酱油比未开封的酱油颜色深”可依据的实验是 (填编号)。
【反思与评价】
(5)结合本实验,你对使用或储藏酱油的建议是 。
(6)酱油在酿造过程中,有时会产生过量的铵盐(如NH4Cl)影响酱油的口感。可用碳酸钠除去铵盐,原理如下,补全该反应的化学方程式。
Na2CO3 +2NH4Cl═2NaCl+2NH3↑+H2O+ 。
【查阅资料】①通过色差仪检测L*值可监控酱油颜色变化,酱油颜色越深,L*值越小。
②保鲜瓶具有的特点是挤出盛放的物质后,空气不会进入。
【实验准备】
将等量样品(同品牌、同批次、初始L*值为43.82的酱油)分装到500 mL的不同容器中,密封。
【进行实验】
实验1:将装有样品的多个透明玻璃瓶置于不同温度的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。
| 编号 | 温度 | 15天 | 30天 | 45天 |
| 1﹣1 | 5℃ | 43.77 | 43.53 | 42.91 |
| 1﹣2 | 28℃ | 43.71 | 43.19 | 42.85 |
| 1﹣3 | 45℃ | 43.67 | 42.55 | 40.89 |
实验2:将装有样品的两个容器置于28℃的恒温箱中。每15天,分别倒出100 mL酱油,剩余样品放回恒温箱。用色差仪检测倒出样品的L*值,结果如下。
| 编号 | 容器 | 15天 | 30天 | 45天 |
| 2﹣1 | 透明玻璃瓶 | 43.45 | 42.36 | 41.30 |
| 2﹣2 | 透明保鲜瓶 | 43.72 | 42.98 | 42.53 |
实验3:将装有样品的多个容器置于28℃的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。

【解释与结论】
(1)实验1得出的结论是 。
(2)实验2的目的是 。
(3)实验3欲研究光照对酱油颜色的影响,应选用的容器是 。
(4)家庭常使用透明玻璃瓶盛放酱油。解释“在相同时间内,使用过的酱油比未开封的酱油颜色深”可依据的实验是 (填编号)。
【反思与评价】
(5)结合本实验,你对使用或储藏酱油的建议是 。
(6)酱油在酿造过程中,有时会产生过量的铵盐(如NH4Cl)影响酱油的口感。可用碳酸钠除去铵盐,原理如下,补全该反应的化学方程式。
Na2CO3 +2NH4Cl═2NaCl+2NH3↑+H2O+ 。
16.化学小组进行如图1所示实验:将稀盐酸、稀硫酸分别加入到装有少量氧化铜粉末的试管甲、乙中,微热,观察到黑色固体完全溶解,试管甲中的溶液显绿色,试管乙中的溶液显蓝色。激发了他们的兴趣,进行如下探究活动。

(1)写出氧化铜与稀盐酸反应的化学方程式 。
探究一:为什么CuCl2溶液显绿色而CuSO4溶液显蓝色?
【查阅资料】氯化铜溶液与硝酸银溶液反应的化学方程式为:CuCl2 +2AgNO3═2AgCl↓+Cu(NO3)2
【猜想与假设】①硫酸铜溶液显蓝色与硫酸根离子有关;②氯化铜溶液显绿色与氯离子有关。
【实验1】
(2)取少量氧化铜粉末于试管中,加入一定量的稀硝酸,加热,观察到黑色固体完全溶解,溶液显 色,说明硫酸铜溶液显蓝色与硫酸根离子无关,与铜离子有关。
【实验2】
(3)小组的操作:取试管乙中的溶液滴加一定量的 ,观察到溶液由蓝色变绿色,则猜想②成立。
(4)请你再设计一个实验证明猜想②成立。实验方案:取试管甲中的溶液, (请简述实验操作与现象)。
探究二:氯化铜溶液显绿色是否与溶液的浓度有关。
【若正确回答下列问题加3分,总分不超过40分】
【实验3】步骤Ⅰ.用托盘天平称取无水氯化铜固体5.0g置于小烧杯中;
步骤Ⅱ.往小烧杯中加入一定量的蒸馏水,搅拌,观察溶液的颜色并记录。
室温下的实验现象及数据记录如下表:
(5)上述实验可以得到的结论是 。
(6)仅从上述实验数据判断,为配制蓝色的氯化铜溶液,其溶液中溶质质量分数不超过 (数据精确到0.1%)。

(1)写出氧化铜与稀盐酸反应的化学方程式 。
探究一:为什么CuCl2溶液显绿色而CuSO4溶液显蓝色?
【查阅资料】氯化铜溶液与硝酸银溶液反应的化学方程式为:CuCl2 +2AgNO3═2AgCl↓+Cu(NO3)2
【猜想与假设】①硫酸铜溶液显蓝色与硫酸根离子有关;②氯化铜溶液显绿色与氯离子有关。
【实验1】
(2)取少量氧化铜粉末于试管中,加入一定量的稀硝酸,加热,观察到黑色固体完全溶解,溶液显 色,说明硫酸铜溶液显蓝色与硫酸根离子无关,与铜离子有关。
【实验2】
(3)小组的操作:取试管乙中的溶液滴加一定量的 ,观察到溶液由蓝色变绿色,则猜想②成立。
(4)请你再设计一个实验证明猜想②成立。实验方案:取试管甲中的溶液, (请简述实验操作与现象)。
探究二:氯化铜溶液显绿色是否与溶液的浓度有关。
【若正确回答下列问题加3分,总分不超过40分】
【实验3】步骤Ⅰ.用托盘天平称取无水氯化铜固体5.0g置于小烧杯中;
步骤Ⅱ.往小烧杯中加入一定量的蒸馏水,搅拌,观察溶液的颜色并记录。
室温下的实验现象及数据记录如下表:
| 加入水的体积/mL | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
| 溶液颜色 | 深绿 | 墨绿 | 墨绿 | 蓝绿 | 绿色 | 深蓝 | 蓝色 | 蓝色 | 浅蓝 | 淡蓝 |
(5)上述实验可以得到的结论是 。
(6)仅从上述实验数据判断,为配制蓝色的氯化铜溶液,其溶液中溶质质量分数不超过 (数据精确到0.1%)。
17.在潜水艇中常用过氧化钠(Na2O2)吸收人呼出的二氧化碳并产生氧气,以供呼吸之用,其反应原理为:2Na2O2+2CO2═2Na2CO3+O2,若潜水艇中携带有8吨含杂质2.5%(杂质不参加反应)的过氧化钠Na2O2,理论上可产生氧气多少吨?
查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解