下载高清试卷
【2021-2022学年山东省淄博市周村区九年级(上)期末化学试卷(五四学制)】-第1页
试卷格式:2021-2022学年山东省淄博市周村区九年级(上)期末化学试卷(五四学制).PDF
试卷热词:最新试卷、2022年、山东试卷、淄博市试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷
扫码查看解析
试卷题目
1.下列物质不属于溶液的是( )
- A. 生理盐水
- B. 液氧
- C. 消毒酒精
- D. 盐酸
2.下列关于溶液的说法错误的是( )
- A. 溶液具有均一、稳定性
- B. 固体物质溶于水时,一般扩散的过程吸热,水合的过程放热
- C. 用胆矾、生石灰和水混制的波尔多液属于溶液
- D. 一定温度下,固体物质的溶解度不随水的质量改变而改变
3.掌握物质的性质和用途,为人类美好生活开启智慧之旅,下列说法不正确的是( )
- A. 氢氧燃料电池是将化学能转化为电能的装置
- B. 硒元素有“智力之花”美称
- C. 研制绿色环保电池利于减少电池造成的污染
- D. 煤、石油、天然气是不可再生的化石燃料
4.两个烧杯中分别盛装X、Y的饱和溶液,两支试管中分别装有NaOH和NH4NO3固体,向两支试管中分别滴加适量水,现象如图一所示,结合图二判断下列说法正确的是( )
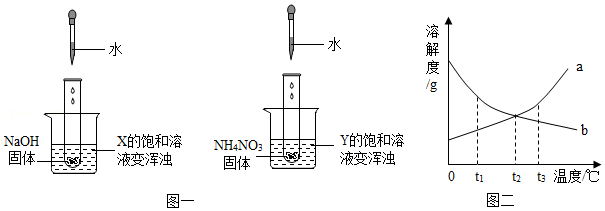

- A. Y的溶解度曲线为b曲线
- B. 降温可使X的饱和溶液变浑浊
- C. X的饱和溶液从t2℃降温到t1℃,溶质的质量分数变大
- D. t3℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y
5.化学与我们的生活息息相关。下列说法正确的是( )
- A. 食物中的纤维素对人体毫无意义
- B. 微量元素在人体内的需求量很少,不需要从外界摄取
- C. 霉变食品经高温蒸煮后可以食用
- D. 青少年只要做到均衡膳食,一般不需要额外补充营养
6.下列说法正确的是( )
- A. 尿素CO(NH2)2能使作物枝叶繁茂,还能提高产量,属于复合化肥
- B. 研制、生产可降解塑料能有效解决“白色污染”问题
- C. 合金的性能与各成分金属的性能相同
- D. 蔗糖属于高分子化合物
7.下列能使无色酚酞试液变红的是( )
- A. 生石灰
- B. 氢氧化铜
- C. 氯化钠
- D. 石灰石
8.已知金属钴(Co)的活动性与铁相似,下列物质间不能发生反应的是( )
- A. 钴与稀盐酸
- B. 钴与氯化铜溶液
- C. 钴与氢氧化钠溶液
- D. 氯化钴溶液与硝酸银溶液
9.某校化学小组在利用盐酸和氢氧化钠两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图1所示,二者恰好完全反应的微观示意图如图2所示。下列说法不正确的是( )
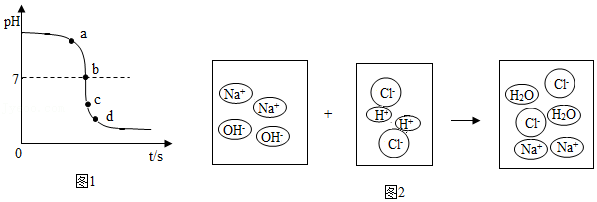

- A. 该实验是将稀盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中
- B. 图1中a点所示溶液中含有的溶质是NaCl和HCl
- C. 图1中由c点到d点的变化过程中没有发生化学反应
- D. 该反应的实质是H+和OH﹣结合生成H2O
10.人体胃液的pH=2左右,而小肠内溶液的pH=8左右,消化液中的哪种粒子能使胃内容物到了小肠后pH发生了这么大的变化( )
- A. Na+
- B. Cl﹣
- C. HCO3﹣
- D. H2O
11.为了探究X、Y、Z三种金属的活动性强弱,某兴趣小组完成了如下实验:把Y投入X的硝酸盐溶液中,Y表面有X析出,溶液质量增大;把X投入Z的硝酸盐溶液中,得到X的硝酸盐,溶液质量减小。下列说法错误的是( )
- A. 金属的活动性强弱与其原子失去电子的能力有关
- B. 元素的相对原子质量可能是:Z>Y>X
- C. 金属活动性顺序是:Y>X>Z
- D. X、Y、Z可能依次是:Cu、Fe、Ag
12.某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤出的固体中加入少量的稀盐酸,无气泡产生,则下列有关说法中正确的是( )
- A. 滤出的固体中可能含有铜和银
- B. 滤出的固体中一定含有银和铜,一定不含有铁
- C. 滤液中一定含有硝酸亚铁,一定没有硝酸银
- D. 滤液中一定含有有硝酸亚铁,可能含有硝酸银和硝酸铜
13.向AgNO3溶液中加入一定量的Mg粉和Cu粉,充分反应后过滤,得到滤渣和蓝色的滤液。关于该滤渣和滤液有下列分析,其中正确的是( )
- A. 向滤渣中加入稀盐酸,可能有气泡产生
- B. 滤液中一定有Cu(NO3)2、一定不含AgNO3、可能有Mg(NO3)2
- C. 反应后溶液的质量一定增加
- D. 该过程至少发生两个化学反应
14.N95口罩对防止新冠病毒在人与人之间传播起到了很好作用,制造N95口罩的原材料是聚丙烯纤维,聚丙烯纤维属于( )
- A. 无机非金属材料
- B. 有机高分子材料
- C. 复合材料
- D. 金属材料
15.推理是一种重要的学习方法。下列推理中正确的是( )
- A. 铝的金属活动性比铁强,所以铝制品比铁制品更容易锈蚀
- B. 盐是由金属离子和酸根离子组成的,NH4NO3中没有金属离子,不属于盐
- C. 复分解反应生成两种化合物,但生成两种化合物的反应不一定是复分解反应
- D. 有一些金属与稀硫酸反应放出气体,所以与稀硫酸反应放出气体的物质一定是金属
16.M是一种金属元素,M2+与其它几种离子构成的化合物的溶解性见表,根据以上信息,判断下列反应肯定不能发生的是( )
| O2﹣ | OH﹣ | CO32﹣ | Cl﹣ | SO42﹣ | NO3﹣ | |
| M2+ | 难溶 | 难溶 | 难溶 | 易溶 | 易溶 | 易溶 |
- A. MCl2+NaOH
- B. MSO4+Ba(NO3)2
- C. M(NO3)2+NaCl
- D. MO+H2SO4
17.下列关于金属的说法正确的是( )
- A. 目前世界上年产量最多的金属是铝
- B. 金刚石和不锈钢都是金属材料
- C. 钛合金与人体具有很好的“相容性”,可用来制造人造骨
- D. 武德合金的熔点高,可用于制造保险丝
18.在化学实验中关注“气泡”情况很重要,下列说法中错误的是( )
- A. 除去氯化钠中少量碳酸钠:滴加稀硫酸至不再产生气泡即可
- B. 金属和酸反应:当其它条件都相同时,产生气泡速度越快,则金属越活泼
- C. 复分解反应条件之一:生成物中有气体(气泡)产生
- D. 检查装置气密性:导气管伸入水中,手握容器外壁,有气泡冒出,则气密性好
19.下列离子在pH=2的溶液中能大量共存,且为无色溶液的是( )
- A. NH4+ Cl﹣ K+ NO3﹣
- B. CO32﹣ Na+ Cl﹣ K+
- C. Fe3+ Mg2+ NO3﹣ Cl﹣
- D. Na+ Ag+ NO3﹣ Cl﹣
20.除去下列物质中少量杂质(括号内为杂质)的方法中正确的是( )
- A. CaCl2溶液(盐酸)﹣﹣加入过量氧化钙固体,过滤
- B. CaO固体(CaCO3)﹣﹣将固体高温煅烧
- C. Na2CO3溶液(Na2SO4)﹣﹣加适量的硝酸钡溶液过滤
- D. H2(HCl)混合气体﹣﹣通过饱和NaHCO3溶液
21.如图是A、B、C三种物质的溶解度曲线,据图回答:
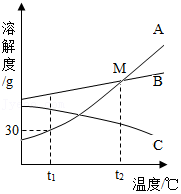
(1)t1℃时A、B、C三种物质的溶解度由大到小的顺序是 。
(2)M点表示的意义是 。
(3)t1℃,将30g A物质加入到50g水中不断搅拌,形成溶液的质量是 g,所得溶液的溶质质量分数为 (结果精确到0.1%)。
(4)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大到小的顺序是 。
(5)如果A中含有少量的B,可采用 方法提纯A。

(1)t1℃时A、B、C三种物质的溶解度由大到小的顺序是 。
(2)M点表示的意义是 。
(3)t1℃,将30g A物质加入到50g水中不断搅拌,形成溶液的质量是 g,所得溶液的溶质质量分数为 (结果精确到0.1%)。
(4)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大到小的顺序是 。
(5)如果A中含有少量的B,可采用 方法提纯A。
22.稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒﹣﹣氧化钇的一种工艺如图:

(1)操作I的名称是 。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是 。
(3)“分离提纯”是为了除去滤液1中的 (填化学式)。
(4)“调pH”时加入碱液使溶液的pH (填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是 ,此反应属于基本反应类型中的 反应。

(1)操作I的名称是 。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是 。
(3)“分离提纯”是为了除去滤液1中的 (填化学式)。
(4)“调pH”时加入碱液使溶液的pH (填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是 ,此反应属于基本反应类型中的 反应。
23.及时归纳是学好科学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的科学性质(图中编号①﹣④),请归纳有关知识。
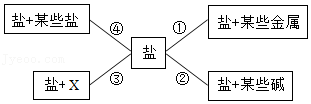
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象 ,化学方程式为 。
(2)在性质③中,X代表 类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学方程式(写一个) 。

(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象 ,化学方程式为 。
(2)在性质③中,X代表 类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学方程式(写一个) 。
24.综合利用海洋资源将是未来的发展趋势,如图是某设计院设计的综合利用海水的流程图。据图回答问题:
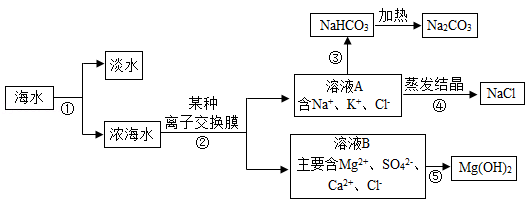
(1)步骤①是从海水中获得淡水的过程,工业上常采用的方法是膜法或多级闪急蒸馏法,分别是利用了混合体系中各物质 或 不同进行分离。
(2)过程②中“某种离子交换膜”可以使带一个单位电荷的离子透过。从而除去浓海水中的Mg2+、SO42﹣、Ca2+,若用化学沉淀法依次除去Mg2+、SO42﹣、Ca2+,需要的三种离子分别是 (写离子符号)。
(3)过程③是氨碱法制纯碱的一个流程,需要向饱和食盐水中先后加入的两种物质是 (写化学式)。
(4)过程④采用蒸发结晶的方法获得氯化钠,而不采用冷却热饱和溶液的方法,是因为 。
(5)如果要充分利用海边的贝壳资源,过程⑤生成氢氧化镁的化学方程式是 。

(1)步骤①是从海水中获得淡水的过程,工业上常采用的方法是膜法或多级闪急蒸馏法,分别是利用了混合体系中各物质 或 不同进行分离。
(2)过程②中“某种离子交换膜”可以使带一个单位电荷的离子透过。从而除去浓海水中的Mg2+、SO42﹣、Ca2+,若用化学沉淀法依次除去Mg2+、SO42﹣、Ca2+,需要的三种离子分别是 (写离子符号)。
(3)过程③是氨碱法制纯碱的一个流程,需要向饱和食盐水中先后加入的两种物质是 (写化学式)。
(4)过程④采用蒸发结晶的方法获得氯化钠,而不采用冷却热饱和溶液的方法,是因为 。
(5)如果要充分利用海边的贝壳资源,过程⑤生成氢氧化镁的化学方程式是 。
25.实验是科学探究的重要方式,请结合图示回答下列问题:
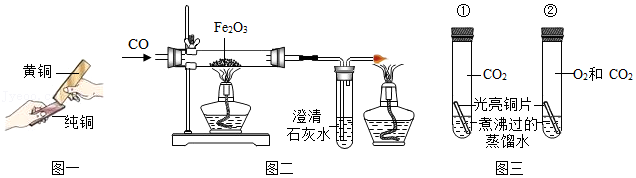
(1)图一是某同学将外形相完全相同的铜片和黄铜片相互刻划,该实验的目的是为了比较纯铜和黄铜 的大小,留下明显划痕的是 。
(2)图二是一氧化碳还原氧化铁的实验装置图。实验过程中玻璃管内出现的现象是 ,发生反应的化学反应方程式 。
(3)图三所示装置是探究铜生锈的部分实验。铜锈的主要成分是碱式碳酸铜,一段时间后,试管①中铜片保持光亮,试管②中铜片出现绿色锈渍。对比实验现象得出的结论是 。
(4)如图四所示装置是四种金属活动性顺序的探究实验。
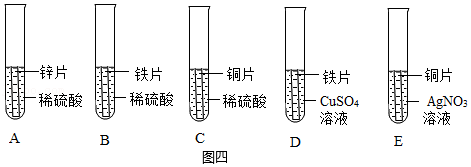
运用控制变量法设计实验方案是化学研究的重要方法。在A、B、C三个实验中,需要控制的实验条件除了金属与稀硫酸的接触面积、稀硫酸的体积、温度以外还需要控制的条件是 。写出试管E中发生反应的化学方程式 。试管D中产生的现象为 。大家认为从中选择四个实验即可验证锌、铁、铜、银的金属活动性顺序。这四个实验的两种组合是 、 。

(1)图一是某同学将外形相完全相同的铜片和黄铜片相互刻划,该实验的目的是为了比较纯铜和黄铜 的大小,留下明显划痕的是 。
(2)图二是一氧化碳还原氧化铁的实验装置图。实验过程中玻璃管内出现的现象是 ,发生反应的化学反应方程式 。
(3)图三所示装置是探究铜生锈的部分实验。铜锈的主要成分是碱式碳酸铜,一段时间后,试管①中铜片保持光亮,试管②中铜片出现绿色锈渍。对比实验现象得出的结论是 。
(4)如图四所示装置是四种金属活动性顺序的探究实验。

运用控制变量法设计实验方案是化学研究的重要方法。在A、B、C三个实验中,需要控制的实验条件除了金属与稀硫酸的接触面积、稀硫酸的体积、温度以外还需要控制的条件是 。写出试管E中发生反应的化学方程式 。试管D中产生的现象为 。大家认为从中选择四个实验即可验证锌、铁、铜、银的金属活动性顺序。这四个实验的两种组合是 、 。
26.为研究酸碱盐的性质某同学做了如下几组实验。
(1)无明显现象的实验序号是 。反应实质相同的两组实验的序号是 。
(2)写出实验②反应的化学方程式 。
(3)实验结束后将所有废液倒入一个干净的废液缸中,得到白色沉淀和上层清液。
①上层清液中一定不含有的物质是 。
②取少量上层清液于试管中,加入少量的Na2CO3溶液,无明显现象。这说明清液中也不含有的离子是 。
③取少量上层清液于另一个试管中,加入过量的氯化钙溶液静置,有白色沉淀生成,说明原清液中一定含有的物质是 。再向此时试管中的溶液中滴加几滴酚酞试液,酚酞试液变为红色,说明溶液中一定含有的物质是 。
除了用酚酞试液检验该物质的存在,还可以选择下列物质中的 。(填字母序号)
A.盐酸 B.硫酸铜溶液 C.氧化铁 D.氯化铵溶液
| 实验序号 | ① | ② | ③ | ④ |
| 实验药品 | HClNaOH | HClNa2CO3 | Ca (OH)2Na2CO3 | CaCl2Na2CO3 |
(1)无明显现象的实验序号是 。反应实质相同的两组实验的序号是 。
(2)写出实验②反应的化学方程式 。
(3)实验结束后将所有废液倒入一个干净的废液缸中,得到白色沉淀和上层清液。
①上层清液中一定不含有的物质是 。
②取少量上层清液于试管中,加入少量的Na2CO3溶液,无明显现象。这说明清液中也不含有的离子是 。
③取少量上层清液于另一个试管中,加入过量的氯化钙溶液静置,有白色沉淀生成,说明原清液中一定含有的物质是 。再向此时试管中的溶液中滴加几滴酚酞试液,酚酞试液变为红色,说明溶液中一定含有的物质是 。
除了用酚酞试液检验该物质的存在,还可以选择下列物质中的 。(填字母序号)
A.盐酸 B.硫酸铜溶液 C.氧化铁 D.氯化铵溶液
27.某兴趣小组在实验室发现盛有固体氢氧化钠的试剂瓶破裂瓶盖处有“白毛”状物质(如图)。
(1)根据所学知识,他们推断“白毛”状固体物质中含有碳酸钠,依据是 (用化学方程式表示)。
(2)既能证明氢氧化钠变质,又能除去变质氢氧化钠中的杂质,该试剂是 (填字母)。
A.稀盐酸
B.Ca(OH)2溶液
C.CaCl2溶液
D.稀硫酸
(3)他们取4g白色固体,加水配成40g溶液倒入烧杯中,将100g氯化钡溶液分成五等份,分5次加入烧杯中,充分反应后测得数据如表:
求4g白色固体中碳酸钠的质量。(写出计算过程,结果保留两位小数)

(1)根据所学知识,他们推断“白毛”状固体物质中含有碳酸钠,依据是 (用化学方程式表示)。
(2)既能证明氢氧化钠变质,又能除去变质氢氧化钠中的杂质,该试剂是 (填字母)。
A.稀盐酸
B.Ca(OH)2溶液
C.CaCl2溶液
D.稀硫酸
(3)他们取4g白色固体,加水配成40g溶液倒入烧杯中,将100g氯化钡溶液分成五等份,分5次加入烧杯中,充分反应后测得数据如表:
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 加入氯化钡溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
| 烧杯中所得溶液的质量/g | 58.03 | 76.06 | 94.09 | 114.09 | 134.09 |
求4g白色固体中碳酸钠的质量。(写出计算过程,结果保留两位小数)

28.黄铜(铜和锌的合金)被广泛用于生活和生产中,铜的质量分数在59%﹣65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母粉碎后放入烧杯中,另取80克稀硫酸,分四次等质量加入,每次均充分反应,实验过程数据记录如表。
分析上述数据,请回答下列问题:
(1)第4次实验结束后溶液的pH 7(选填“>”、“=”或“<”)。
(2)通过计算说明该黄铜螺母的材料性能是否优良?
(3)所用稀硫酸的溶质质量分数是多少?(写出计算过程)
| 实验次数 | 1 | 2 | 3 | 4 |
| 稀硫酸的用量/克 | 20 | 20 | 20 | 20 |
| 剩余固体的质量/克 | 17.4 | 14.8 | 12.2 | 12 |
分析上述数据,请回答下列问题:
(1)第4次实验结束后溶液的pH 7(选填“>”、“=”或“<”)。
(2)通过计算说明该黄铜螺母的材料性能是否优良?
(3)所用稀硫酸的溶质质量分数是多少?(写出计算过程)
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解