下载高清试卷
【2021-2022学年江苏省镇江市句容市九年级(上)期末化学试卷】-第1页
试卷格式:2021-2022学年江苏省镇江市句容市九年级(上)期末化学试卷.PDF
试卷热词:最新试卷、2022年、江苏试卷、镇江市试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷
扫码查看解析
试卷题目
1.下列属于纯净物的是( )
- A. 空气
- B. 盐水
- C. 液氮
- D. 生铁
2.下列化学用语正确的是( )
- A. 锌离子—Zn2+
- B. 氦气—He2
- C. 2个氢原子—H2
- D. 二氧化氮—N2O
3.下列物质的用途主要与其化学性质有关的是( )
- A. 木材用作制桌椅
- B. 盐酸用于除水垢
- C. 活性炭用于除臭
- D. 金属丝用作导线
4.下列做法不正确的是( )
- A. 回收金属,再生减污
- B. 植树造林,防沙降尘
- C. 煤气泄漏,关阀开窗
- D. 禁用农药,保护水源
5.下列归类正确的是( )
| 选项 | 归类 | 内容 |
| A | 常见合金 | 黄铜、硬铝、不锈钢 |
| B | 清洁能源 | 石油、氢能、太阳能 |
| C | 常见氧化物 | 水、双氧水、氢氧化钾 |
| D | 大气污染物 | 粉尘、氮氧化物、二氧化碳 |
- A. A
- B. B
- C. C
- D. D
6.如图是粗略测定粗盐中氯化钠含量的部分操作(杂质不溶于水),其中操作不规范的是( )


- A. 甲:称量
- B. 乙:溶解
- C. 丙:过滤
- D. 丁:蒸发
7.下列实验设计正确的是( )
- A. 用托盘天平称取5.62g蔗糖
- B. 用观察颜色的方法区分黄金和黄铜(铜锌合金)
- C. 用KMnO4溶液区分SO2和CO2
- D. 用活性炭使硬水转化为软水
8.下列排序正确的是( )
- A. 溶解时放出的热量:
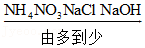
- B. 氮元素的化合价:

- C. 地壳中元素含量:

- D. 金属活动性顺序:
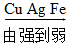
9.下列指定反应的化学方程式正确的是( )
- A. 磷在氧气中燃烧:P+O2P2O5
点燃 - B. 铜丝插入硝酸银溶液中;Cu+AgNO3═CuNO3+Ag
- C. 用双氧水制氧气:H2O2H2↑+O2↑
MnO2 - D. 工业上用NaOH溶液吸收NO和NO2的反应:NO+NO2+2NaOH═2NaNO2+H2O
10.如图是甲转化为丙的微观过程。下列说法正确的是( )


- A. 转化①为置换反应
- B. 转化②中乙和H2O2的分子个数比为1:1
- C. 整个转化过程中共有2种氧化物
- D. 甲、乙、丙中硫元素的质量分数依次增大
11.下列对实验现象的描述或实验操作正确的是( )
- A. 加热铜绿固体由黑色变为绿色
- B. 红磷在空气中燃烧,产生大量白雾
- C. 用高压水枪灭火可降低可燃物着火点
- D. 滴瓶上的滴管使用后无需用蒸馏水清洗,直接放回原滴瓶
12.2021年《化学教育》第3期,报道了一种“氧化铜还原实验”一体化装置,如图所示,下列说法错误的是( )
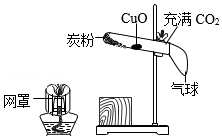

- A. 用酒精灯加热氧化铜部位,无明显现象,证明二氧化碳不能还原氧化铜
- B. 先用酒精灯加热炭粉再加热氧化铜,黑色氧化铜变为红色,证明炭粉还原氧化铜
- C. 加热炭粉过程中发生反应CO2+C2CO
高温 - D. 气球可防止有害气体外逸,污染空气
13.下列物质的转化在给定条件下均能一步实现的是( )
- A. CuCuSO4稀H2SO4Cu(OH)2NaOH溶液
- B. H2OH2通电H2O2O2/点燃
- C. CaCO3CO2稀HClCOC/高温
- D. KMnO4O2△Fe2O3Fe/点燃
14.下列实验操作中能达到实验目的的是( )
| 选项 | 物质 | 目的 | 主要实验操作 |
| A | CO2和N2 | 鉴别 | 分别用燃着的木条试验,观察现象 |
| B | CaCO3中含有CaCl2 | 检验 | 取样,加入适量稀盐酸,观察现象 |
| C | MnO2和KCl的混合物 | 分离 | 溶解、过滤、洗涤固体并烘干,蒸发滤液 |
| D | CO2中混有的少量CO | 除杂 | 通入氧气,点燃 |
- A. A
- B. B
- C. C
- D. D
15.分解水制氢的一种原理如图。下列关于该原理的说法不正确的是( )
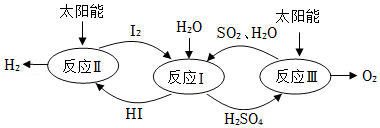

- A. 该反应实现了太阳能向化学能的转化
- B. 反应Ⅱ的类型为分解反应
- C. 反应Ⅰ的化学方程式为I2+2H2O+SO22HI+H2SO4
一定条件 - D. 理论上,每分解36g H2O,需向体系内再补充64gSO2
16.下列说法不正确的是( )
- A. 不饱和溶液变为饱和溶液,溶质质量分数一定变大
- B. 在同一化合物中,金属元素显正价,非金属元素不一定显负价
- C. 同种元素的原子和离子具有相同的质子数
- D. 由一种元素组成的物质可能是单质,一定不是化合物
17.15℃时,将质量都为xg的KNO3、KCl两种固体物质,分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到15℃,现象如图1、2所示。下列说法不正确的是( )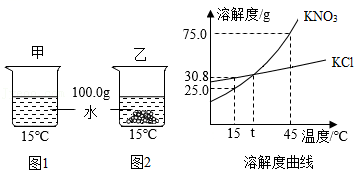

- A. 乙中加入的固体是KNO3
- B. 固体质量:25.0<x≤30.8
- C. 将甲、乙两烧杯的温度从15℃升高到t℃,两溶液都是不饱和溶液
- D. 将KNO3、KCl的饱和溶液从45℃降温到15℃,析出晶体质量一定是KNO3>KCl
18.向16.8g铁粉中先加入200g稀硫酸,充分反应后再逐滴加入一定量的硫酸铜溶液,反应过程中所得剩余固体质量与加入物质的质量关系如图所示,下列说法正确的是( )
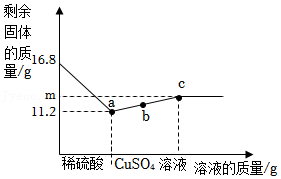

- A. 稀硫酸中硫酸质量分数为9.8%
- B. a点和b点溶液中的溶质种类相同
- C. m=12
- D. 向c点中固体中加入稀硫酸,有气泡产生
19.下列各组物质,常温下不用其他试剂就无法区分的是( )
- A. 酒精 盐酸 石蕊
- B. FeCl2溶液 双氧水 CuSO4溶液
- C. 红磷 硫磺 炭粉
- D. MgCl2溶液 氯化钾溶液 食盐水
20.将24.0g Fe2O3与CO在密闭容器中加热一段时间后得到Fe、FexOy混合物20g,将此混合物溶于100.0g稀H2SO4,正好完全反应产生0.2g H2,FexOy能与稀H2SO4反应但不生成H2。下列说法正确的是( )
- A. 混合物中含5.6g铁元素
- B. FexOy为Fe3O4
- C. 生成CO2 11g
- D. 该稀硫酸溶质的质量分数为9.8%
21.用化学符号表示:
(1)3个氮原子 ;
(2)人体中含量最多的物质 ;
(3)2个钠离子 ;
(4)人体 元素吸收过多,易引起白内障。
(1)3个氮原子 ;
(2)人体中含量最多的物质 ;
(3)2个钠离子 ;
(4)人体 元素吸收过多,易引起白内障。
22.选择下列适当的物质填空(选填序号):
A.氧气 B.硝酸铵 C.石灰石 D.氢氧化钠 E.食盐 F.活性炭 G.洗洁精 H.武德合金
(1)可用作制保险丝的是 ;
(2)炼铁造渣所用矿石是 ;
(3)可用作医疗急救的是 ;
(4)厨房中作调味品的是 ;
(5)生活中作乳化剂的是 ;
(6)溶于水温度升高的是 。
A.氧气 B.硝酸铵 C.石灰石 D.氢氧化钠 E.食盐 F.活性炭 G.洗洁精 H.武德合金
(1)可用作制保险丝的是 ;
(2)炼铁造渣所用矿石是 ;
(3)可用作医疗急救的是 ;
(4)厨房中作调味品的是 ;
(5)生活中作乳化剂的是 ;
(6)溶于水温度升高的是 。
23.利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如图所示。
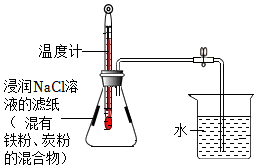
(1)铁的锈蚀是 反应(选填“吸热”或“放热”)。
(2)氯化钠的作用是 。

(1)铁的锈蚀是 反应(选填“吸热”或“放热”)。
(2)氯化钠的作用是 。
24.利用废水(含有ZnSO4和CuSO4)制取七水硫酸锌(ZnSO4•7H2O),同时回收Cu的流程如图所示:

(1)试剂X可用 (选填序号)。
a.Zn
b.Cu
(2)实验室中进行操作1、2时,所用玻璃仪器有 、玻璃棒和烧杯。
(3)操作3为蒸发浓缩、 、过滤等。
(4)操作3后续还要洗涤、低温干燥,其中洗涤剂不可选用 (选填序号)(ZnSO4在0度时的溶解度是41.8g,在100℃的溶解度为81.0g)。
a.冰水
b.热水
c.饱和ZnSO4溶液

(1)试剂X可用 (选填序号)。
a.Zn
b.Cu
(2)实验室中进行操作1、2时,所用玻璃仪器有 、玻璃棒和烧杯。
(3)操作3为蒸发浓缩、 、过滤等。
(4)操作3后续还要洗涤、低温干燥,其中洗涤剂不可选用 (选填序号)(ZnSO4在0度时的溶解度是41.8g,在100℃的溶解度为81.0g)。
a.冰水
b.热水
c.饱和ZnSO4溶液
25.NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。

(1)该转化中有 种元素化合价发生改变。
(2)还原反应的化学方程式: 。

(1)该转化中有 种元素化合价发生改变。
(2)还原反应的化学方程式: 。
26.请结合如图回答问题:

(1)仪器名称:① ,② 。
(2)用氯酸钾和二氧化锰制取氧气,可选用装置 (选填序号)和D组合,反应的化学方程式为 ,二氧化锰的作用是 。
(3)实验室可用B或C装置制CO2,反应的化学方程式为 ,C相对于B装置的优点有 。若用E装置收集H2,气体应从 (选填“a”或“b”)端通入。
(4)在装置C中连接压强传感器(如图F)测定装置C内压强变化,图G记录压强随时间变化情况。反应时,关闭导管上的活塞,试管中液面逐渐 (选填“上升”或“下降”)。随后,再打开导管上的活塞,压强传感器的读数变化如图G中 段(选填序号)。

①ab ②bc ③cd

(1)仪器名称:① ,② 。
(2)用氯酸钾和二氧化锰制取氧气,可选用装置 (选填序号)和D组合,反应的化学方程式为 ,二氧化锰的作用是 。
(3)实验室可用B或C装置制CO2,反应的化学方程式为 ,C相对于B装置的优点有 。若用E装置收集H2,气体应从 (选填“a”或“b”)端通入。
(4)在装置C中连接压强传感器(如图F)测定装置C内压强变化,图G记录压强随时间变化情况。反应时,关闭导管上的活塞,试管中液面逐渐 (选填“上升”或“下降”)。随后,再打开导管上的活塞,压强传感器的读数变化如图G中 段(选填序号)。

①ab ②bc ③cd
27.过碳酸钠(xNa2CO3•yH2O2)可做供氧剂等,加水时缓慢产生气泡;在其中加稀硫酸等酸溶液或在其水溶液中加MnO2,均迅速出现大量气泡。
【资料】①过碳酸钠具有碳酸钠和过氧化氢的双重化学性质。
②Na2CO3+H2SO4═Na 2SO4+H2O+CO2↑
③碱石灰能吸收水和二氧化碳
(1)【猜想】过碳酸钠与稀硫酸产生的气体可能是:①CO2; ② ; ③CO2和O2。
【实验】将过碳酸钠与稀硫酸产生的气体先通入足量澄清石灰水,再将带火星的小木条靠近剩余气体。
(2)“实验”中石灰水浑浊、木条 (填现象),说明猜想③正确。
为确定组成,加足量稀硫酸于过碳酸钠中,使产生所有气体X缓缓通过下图装置,并缓慢通一段时间N2以测定生成气体质量。

(3)装置中浓硫酸的作用是 “缓慢通一段时间N2”目的是 。
(4)实验数据记录于上表中、据表中数据计算:xNa2CO3•yH2O2中x﹕y= 。
(5)若先通X,后加热铜网,则所测 x﹕y的值 (选填“偏小”、“不变”或“偏大”)。
(6)【拓展】有关过碳酸钠(xNa2CO3•yH2O2)的说法正确的是 (选填序号)。
①须防水保存 ②酸及MnO2均能使其失效 ③x:y的值越大,其供氧效果越佳
【资料】①过碳酸钠具有碳酸钠和过氧化氢的双重化学性质。
②Na2CO3+H2SO4═Na 2SO4+H2O+CO2↑
③碱石灰能吸收水和二氧化碳
(1)【猜想】过碳酸钠与稀硫酸产生的气体可能是:①CO2; ② ; ③CO2和O2。
【实验】将过碳酸钠与稀硫酸产生的气体先通入足量澄清石灰水,再将带火星的小木条靠近剩余气体。
(2)“实验”中石灰水浑浊、木条 (填现象),说明猜想③正确。
为确定组成,加足量稀硫酸于过碳酸钠中,使产生所有气体X缓缓通过下图装置,并缓慢通一段时间N2以测定生成气体质量。
| 装置 | 反应前质量/g | 反应后质量/g |
| 铜网 | 22.0 | 24.4 |
| 碱石灰 | 120.0 | 124.4 |

(3)装置中浓硫酸的作用是 “缓慢通一段时间N2”目的是 。
(4)实验数据记录于上表中、据表中数据计算:xNa2CO3•yH2O2中x﹕y= 。
(5)若先通X,后加热铜网,则所测 x﹕y的值 (选填“偏小”、“不变”或“偏大”)。
(6)【拓展】有关过碳酸钠(xNa2CO3•yH2O2)的说法正确的是 (选填序号)。
①须防水保存 ②酸及MnO2均能使其失效 ③x:y的值越大,其供氧效果越佳
28.现有一包固体粉末,可能含有炭粉、CuSO4、NH4HCO3、CaCO3、MnO2的一种或几种。现做如下实验:
(1)取少量固体加热,无氨味,则原固体中一定不含 。
(2)另取少量固体溶于足量稀盐酸中,有气泡产生,同时得到无色澄清液体和黑色固体;则原固体中一定不含 ,一定含有 。
(3)取(2)中黑色固体,加入少量5%的双氧水,有大量气泡产生,则原固体中还含有 。
(4)待(3)中不再产生气泡,仍有固体剩余,则原固体中 (填“一定“、“一定不”或“可能”)含有炭粉。
(1)取少量固体加热,无氨味,则原固体中一定不含 。
(2)另取少量固体溶于足量稀盐酸中,有气泡产生,同时得到无色澄清液体和黑色固体;则原固体中一定不含 ,一定含有 。
(3)取(2)中黑色固体,加入少量5%的双氧水,有大量气泡产生,则原固体中还含有 。
(4)待(3)中不再产生气泡,仍有固体剩余,则原固体中 (填“一定“、“一定不”或“可能”)含有炭粉。
29.(一)认识镁的性质
(1)海水中含有大量的钠元素与镁元素,这两种元素最本质的区别是 不同(填“质子数”、“中子数”或“电子数”)。
(2)在化学反应中,镁原子易失去2个电子,形成镁离子的化学符号 。
(3)烟花、照明弹中都用到镁粉作原料,原因是镁粉燃烧时 ,写出反应的化学方程式 。
(二)制备过氧化镁
过氧化镁(MgO2)是一种重要的化工原料,医学上可治疗消化不良、胃胀等症状。工业常以菱镁矿(MgCO3) 为原料来制备,生产工艺部分流程如图所示:
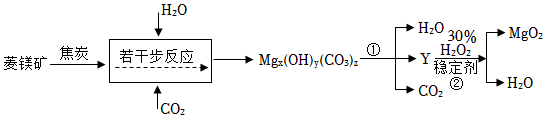
(4)反应时将菱镁矿石粉碎的目的 。
(5)生产流程中,Mgx(OH)y(CO3)z性质与碱式碳酸铜相似,受热会生成三种氧化物,则物质Y的化学式 。
(6)过氧化镁(MgO2)中氧元素的化合价为 价,反应②中加入稳定剂来防止H2O2分解,写出反应②的化学方程式 。
(三)碱式碳酸镁定量测定
碱式碳酸镁Mgx(OH)y(CO3)z是一种白色固体,举重运动员常将其粉末抹在手上以增大摩擦力。为确定固体的组成,进行如下实验(假设每一步都吸收完全):
[资料]浓硫酸吸收水蒸气
[实验]
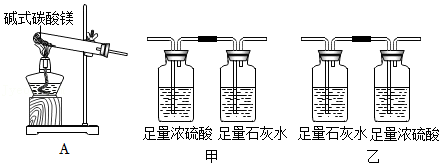
(7)实验前需进行的操作:连接好装置,首先要 。
(8)称取一定质量固体样品于A装置中,将生成的气体缓缓通过上图的 (选填“甲”或“乙”)装置,持续加热至完全分解,最终得到MgO质量为30.0g,足量浓硫酸和足量石灰水装置最终分别增重2.7g、26.4g。
(9)足量石灰水的作用是 ,写出该反应的化学方程式 。
(10)已知化学反应前后元素的种类和质量不变,计算出固体样品中镁元素的质量为 g,碱式碳酸镁的化学式为 。
(1)海水中含有大量的钠元素与镁元素,这两种元素最本质的区别是 不同(填“质子数”、“中子数”或“电子数”)。
(2)在化学反应中,镁原子易失去2个电子,形成镁离子的化学符号 。
(3)烟花、照明弹中都用到镁粉作原料,原因是镁粉燃烧时 ,写出反应的化学方程式 。
(二)制备过氧化镁
过氧化镁(MgO2)是一种重要的化工原料,医学上可治疗消化不良、胃胀等症状。工业常以菱镁矿(MgCO3) 为原料来制备,生产工艺部分流程如图所示:
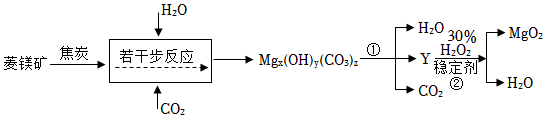
(4)反应时将菱镁矿石粉碎的目的 。
(5)生产流程中,Mgx(OH)y(CO3)z性质与碱式碳酸铜相似,受热会生成三种氧化物,则物质Y的化学式 。
(6)过氧化镁(MgO2)中氧元素的化合价为 价,反应②中加入稳定剂来防止H2O2分解,写出反应②的化学方程式 。
(三)碱式碳酸镁定量测定
碱式碳酸镁Mgx(OH)y(CO3)z是一种白色固体,举重运动员常将其粉末抹在手上以增大摩擦力。为确定固体的组成,进行如下实验(假设每一步都吸收完全):
[资料]浓硫酸吸收水蒸气
[实验]

(7)实验前需进行的操作:连接好装置,首先要 。
(8)称取一定质量固体样品于A装置中,将生成的气体缓缓通过上图的 (选填“甲”或“乙”)装置,持续加热至完全分解,最终得到MgO质量为30.0g,足量浓硫酸和足量石灰水装置最终分别增重2.7g、26.4g。
(9)足量石灰水的作用是 ,写出该反应的化学方程式 。
(10)已知化学反应前后元素的种类和质量不变,计算出固体样品中镁元素的质量为 g,碱式碳酸镁的化学式为 。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解