下载高清试卷
【2021-2022学年天津市红桥区九年级(上)期末化学试卷】-第1页
试卷格式:2021-2022学年天津市红桥区九年级(上)期末化学试卷.PDF
试卷热词:最新试卷、2022年、天津试卷、红桥区试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷

扫码查看解析
试卷题目
1.今年全国两会,“碳达峰”和“碳中和”首次写入政府工作报告,成为舆论热词。“碳中和”是指单位或个人在定时间内直接或间接产生的二氧化碳排放总量,通过二氧化碳去除手段,抵消这部分碳排放,达到“净零排放”目的。以下措施不能实现“碳中和”目标的是( )
- A. 推广使用新能源汽车
- B. 尽量乘坐公交车
- C. 植树造林,增加植被面积
- D. 露天焚烧农作物秸秆以增加肥效
2.把少量下列物质分别放入水中,充分搅拌,能得到溶液的是( )
- A. 硝酸钾
- B. 植物油
- C. 面粉
- D. 泥土
3.如图所示实验操作,正确的是( )
- A.
 称量固体氢氧化钠
称量固体氢氧化钠 - B.
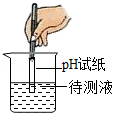 测溶液pH
测溶液pH - C.
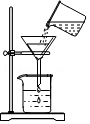 过滤
过滤 - D.
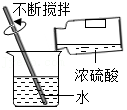 稀释浓硫酸
稀释浓硫酸
4.森林灭火有效方法之一,是在大火蔓延路线的前方清理出一片隔离带,大火会逐渐熄灭,该灭火方法的原理是( )
- A. 隔离空气
- B. 隔离可燃物
- C. 降低温度到着火点以下
- D. 隔离氧气
5.将浓盐酸和浓硫酸敞口放置在空气中一段时间后,关于两者溶质质量分数的变化,描述正确的是( )
- A. 两者溶质质量分数都变大
- B. 两者溶质质量分数都不变
- C. 两者溶质质量分数都变小
- D. 浓盐酸溶质质量分数变小,浓硫酸溶质质量分数变大
6.下列有关溶液的说法不正确的是( )
- A. 洗涤剂去油污主要利用了乳化作用
- B. 溶液一定是无色的,且溶剂一定是水
- C. NH4NO3固体溶于水时会出现吸热现象
- D. 一种溶剂可同时溶解多种溶质,形成混合溶液
7.下列排序正确的是( )
- A. 空气中物质含量:

- B. 溶液的pH:

- C. 利用金属的年代:

- D. 氮元素化合价:
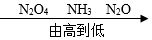
8.下列物质能用于鉴别氢氧化钠溶液和稀盐酸的是( )
- A. 铜粉
- B. CO2
- C. 澄清石灰水
- D. 铁粉
9.在探究金属X、Y、Cu的活动性顺序时,将铜片分别插入X和Y的盐溶液中,一段时间后发现:插入X的盐溶液的铜片表面有黑色固体析出,插入Y的盐溶液的铜片表面无明显变化,那么上述金属的活动性顺序为( )
- A. X>Y>Cu
- B. X>Cu>Y
- C. Cu>X>Y
- D. Y>Cu>X
10.下列关于二氧化碳和一氧化碳的描述,完全正确的是( )
- A. 组成:CO2、CO均由碳元素和氧元素组成
- B. 性质:CO2、CO密度均大于空气
- C. 用途:CO2可用于人工降雨;CO可用于气体肥料
- D. 危害:CO2会导致酸雨;CO会引起雾霾
11.利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述错误的是( )


- A. 由实验①②可验证燃烧需要氧气
- B. 由实验②③可推知着火点高低:红磷>白磷
- C. 利用水浴控温可调节可燃物的着火点
- D. ①③两支试管内的白磷和红磷可回收再利用
12.类比、迁移和推理是化学学习常用的思维方法,下列有关推理正确的是( )
- A. 二氧化锰在氯酸钾分解反应中都作催化剂,所以二氧化锰可作一切化学反应的催化剂
- B. 合金是由一种金属跟其它金属(或非金属)熔合而成的具有金属特性的物质,所以合金熔点比其中任何一种金属都低、硬度比其中任何一种金属都大、性能更好
- C. 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
- D. 由一种元素组成的物质一定是单质
13.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
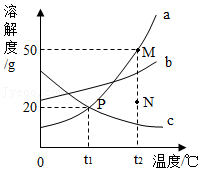

- A. t1℃时,将5g a加入到20g水中充分搅拌,可得到25ga的饱和溶液
- B. t2℃时将N点的a溶液转变为M点的a溶液,可加水实现
- C. 将t1℃时c的饱和溶液升温到t2℃,其溶质质量分数不变
- D. t2℃时,分别将a、b、c的饱和溶液恒温蒸发相同质量的水,a析出固体的质量最大
14.下列各图象能正确反映其对应变化关系的是( )
- A.
 电解水实验生成两种气体的质量
电解水实验生成两种气体的质量 - B.
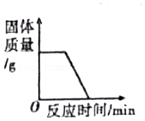 加热碳和氧化铜的混合物
加热碳和氧化铜的混合物 - C.
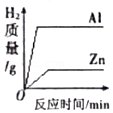 用等量铝和锌与等质量分数、足量的稀硫酸反应
用等量铝和锌与等质量分数、足量的稀硫酸反应 - D.
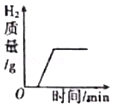 向打磨后铝箔中加入稀盐酸
向打磨后铝箔中加入稀盐酸
15.铁粉与氧化镁的混合物15.2g与200g溶质质量分数为14.7%的硫酸恰好完全反应,经测定反应后硫酸镁的质量为12g,则下列说法正确的是( )
- A. 产生氢气的质量为0.4g
- B. 混合物中氧化镁的质量为8g
- C. 混合物中铁粉的质量为10g
- D. 混合物中铁元素与镁元素质量比为14:3
16.世界是物质的。从①汞②氢氧化钙③盐酸④干冰⑤氯化钠中选择合适物质的化学式填空。
(1)人体胃液中含有的酸是 ;
(2)可用于人工降雨的物质是 ;
(3)可用来改良酸性土壤的碱是 ;
(4)氯化钠溶液中的溶质是 ;
(5)水银温度计中的单质是 。
(1)人体胃液中含有的酸是 ;
(2)可用于人工降雨的物质是 ;
(3)可用来改良酸性土壤的碱是 ;
(4)氯化钠溶液中的溶质是 ;
(5)水银温度计中的单质是 。
17.许多生活用品都是由金属材料制成的。
(1)金属铜常用来做导线,是利用了铜良好的延展性和 性。
(2)在铁制品表面喷漆可以防锈,其原理是 。
(3)为了验证镁、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是 (填序号)。
①将镁、银分别浸入到硫酸铜溶液中
②将银分别浸入到硫酸镁、硫酸铜溶液中
③将铜、银分别浸入到硫酸镁溶液中
④将铜分别浸入到硫酸镁、硝酸银溶液中
(4)铝热剂是修建铁路时常用的焊接材料,其反应原理是铝在高温条件下与氧化铁反应得到融熔的铁与另一种氧化物,该反应的化学方程式是 。
(5)光亮的铁片放入硫酸铜溶液中反应一段时间后,反应的实验现象是 。试管内溶液质量与反应前相比 (填“增大”、“不变”或“减小”)。
(1)金属铜常用来做导线,是利用了铜良好的延展性和 性。
(2)在铁制品表面喷漆可以防锈,其原理是 。
(3)为了验证镁、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是 (填序号)。
①将镁、银分别浸入到硫酸铜溶液中
②将银分别浸入到硫酸镁、硫酸铜溶液中
③将铜、银分别浸入到硫酸镁溶液中
④将铜分别浸入到硫酸镁、硝酸银溶液中
(4)铝热剂是修建铁路时常用的焊接材料,其反应原理是铝在高温条件下与氧化铁反应得到融熔的铁与另一种氧化物,该反应的化学方程式是 。
(5)光亮的铁片放入硫酸铜溶液中反应一段时间后,反应的实验现象是 。试管内溶液质量与反应前相比 (填“增大”、“不变”或“减小”)。
18.请根据所学化学知识填写下列空白:
燃烧是人类最早有意识利用的化学反应,火的使用标志着人类文明的伟大进步。
(1)原始人利用木柴燃烧释放的 烘烤食物。现在,人们仍然利用燃料燃烧蒸煮食物,家用液化气的成分之一丙烯(C3H6)燃烧的化学方程式为 。
(2)在大棚中燃烧沼气可以提高作物产量,沼气的主要成分燃烧的微观示意图如图:
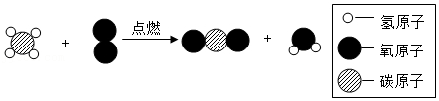
下列说法正确的有 。
A.参加反应的 与
与 的质量比为16:32
的质量比为16:32
B.反应前后各元素的化合价都不变
C.点燃沼气前,需要检验纯度防止发生爆炸
D.生成的 可做气体肥料
可做气体肥料
(3)为减少温室气体排放,人们积极寻找不含碳元素的燃料,经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景。
①NH3中氮元素和氢元素的质量比为 。
②将NH3燃烧反应的化学方程式补充完整:4NH3+3O2
6H2O+ 。
(4)一定质量的甲烷燃烧时氧气不充足,生成CO、CO2和水蒸气的混合气体20.8g,经测定其中水的质量为10.8g,则反应消耗氧气的质量为 g。
燃烧是人类最早有意识利用的化学反应,火的使用标志着人类文明的伟大进步。
(1)原始人利用木柴燃烧释放的 烘烤食物。现在,人们仍然利用燃料燃烧蒸煮食物,家用液化气的成分之一丙烯(C3H6)燃烧的化学方程式为 。
(2)在大棚中燃烧沼气可以提高作物产量,沼气的主要成分燃烧的微观示意图如图:

下列说法正确的有 。
A.参加反应的
 与
与 的质量比为16:32
的质量比为16:32B.反应前后各元素的化合价都不变
C.点燃沼气前,需要检验纯度防止发生爆炸
D.生成的
 可做气体肥料
可做气体肥料(3)为减少温室气体排放,人们积极寻找不含碳元素的燃料,经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景。
①NH3中氮元素和氢元素的质量比为 。
②将NH3燃烧反应的化学方程式补充完整:4NH3+3O2
| 点燃 |
(4)一定质量的甲烷燃烧时氧气不充足,生成CO、CO2和水蒸气的混合气体20.8g,经测定其中水的质量为10.8g,则反应消耗氧气的质量为 g。
19.写出下列反应的化学方程式:
(1)氢氧化镁中和胃酸过多: 。
(2)铝制品耐腐蚀的原因: 。
(3)铜与硝酸汞溶液反应: 。
(1)氢氧化镁中和胃酸过多: 。
(2)铝制品耐腐蚀的原因: 。
(3)铜与硝酸汞溶液反应: 。
20.某化学兴趣小组开展的氢氧化钠性质系列探究活动如图所示。

(1)实验①观察到氢氧化钠表面 。
(2)实验②观察到紫色石蕊溶液变成 色,实验③观察到无色酚酞溶液变成 色。由此得出:碱溶液能使指示剂变色。
(3)实验④:如图是氢氧化钠与盐酸反应的微观模拟示意图:
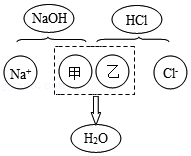
从微观的角度分析,甲、乙两处应填入的离子符号分别为 、 。
(4)实验⑥⑦为用软矿泉水瓶所做的对比实验,装 的软矿泉水瓶变瘪更明显,原因是 (用化学方程式表示)。

(1)实验①观察到氢氧化钠表面 。
(2)实验②观察到紫色石蕊溶液变成 色,实验③观察到无色酚酞溶液变成 色。由此得出:碱溶液能使指示剂变色。
(3)实验④:如图是氢氧化钠与盐酸反应的微观模拟示意图:

从微观的角度分析,甲、乙两处应填入的离子符号分别为 、 。
(4)实验⑥⑦为用软矿泉水瓶所做的对比实验,装 的软矿泉水瓶变瘪更明显,原因是 (用化学方程式表示)。
21.现有木炭、一氧化碳、氧化铜、氧化铁、稀硫酸五种物质,它们之间发生的反应,可用“A+B→C+D”表示。
(1)若A为单质,则A是 。A与B在高温下反应,可观察到固体粉末由黑色逐渐变红,则B是 ,其反应类型为 。
(2)若A为气体化合物。A与B在高温下反应,可观察到固体粉末由红色逐渐变黑,则B是 。
(3)若A溶液pH<7。A与B在常温下反应,可观察到溶液由无色变为黄色,则A与B反应的化学方程式为 。
(1)若A为单质,则A是 。A与B在高温下反应,可观察到固体粉末由黑色逐渐变红,则B是 ,其反应类型为 。
(2)若A为气体化合物。A与B在高温下反应,可观察到固体粉末由红色逐渐变黑,则B是 。
(3)若A溶液pH<7。A与B在常温下反应,可观察到溶液由无色变为黄色,则A与B反应的化学方程式为 。
22.化学是一门以实验为基础的学科。请结合下列实验装置回答问题。
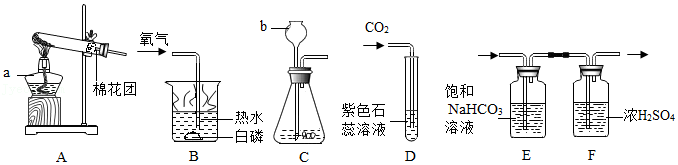
(1)写出图中所示实验仪器的名称:a ;b 。
(2)写出A装置用高锰酸钾制取氧气的化学方程式 。
(3)连接A、B装置,观察到B装置热水中的白磷燃烧,由白磷燃烧的事实说明燃烧需要的条件之一是 。
(4)王刚同学利用C、D装置进行CO2的实验室制取、性质实验。C中发生的化学反应方程式为 ;D中观察到的实验现象为 。
(5)实验C中产生的CO2常含有氯化氢和水蒸气,李静同学利用如图E、F装置除去杂质,得到纯净、干燥的CO2气体,E中饱和NaHCO3溶液的作用是 。

(1)写出图中所示实验仪器的名称:a ;b 。
(2)写出A装置用高锰酸钾制取氧气的化学方程式 。
(3)连接A、B装置,观察到B装置热水中的白磷燃烧,由白磷燃烧的事实说明燃烧需要的条件之一是 。
(4)王刚同学利用C、D装置进行CO2的实验室制取、性质实验。C中发生的化学反应方程式为 ;D中观察到的实验现象为 。
(5)实验C中产生的CO2常含有氯化氢和水蒸气,李静同学利用如图E、F装置除去杂质,得到纯净、干燥的CO2气体,E中饱和NaHCO3溶液的作用是 。
23.某中学化学兴趣小组利用如图装置制备氢气,并验证氢气的性质(D处硫酸铜固体遇水会由白色逐渐变为蓝色),按要求回答以下问题:
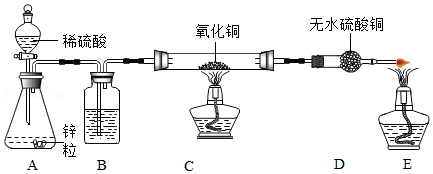
(1)化学实验现有质量分数为98%的浓硫酸,需配制245g质量分数9.8%的稀硫酸,配制步骤如下:①计算:所需质量分数98%的浓硫酸 g;②量取;③稀释。稀释浓硫酸所用的玻璃仪器有 。
(2)该兴趣小组制备氢气的化学方程式为 。
(3)装置B的作用 。
(4)下列有关实验操作或现象描述不正确的是 。
A.实验开始时,应先通入氢气,然后再点燃C处酒精灯
B.E处酒精灯的作用是点燃未反应的氢气
C.实验结束时,应先停止通入氢气,然后熄灭C处酒精灯
(5)实验结束后,发现部分氧化铜粉末未被还原,已知反应前氧化铜质量为10克,反应结束后混合固体质量为9.2克,则被氢气还原的氧化铜的质量为 。

(1)化学实验现有质量分数为98%的浓硫酸,需配制245g质量分数9.8%的稀硫酸,配制步骤如下:①计算:所需质量分数98%的浓硫酸 g;②量取;③稀释。稀释浓硫酸所用的玻璃仪器有 。
(2)该兴趣小组制备氢气的化学方程式为 。
(3)装置B的作用 。
(4)下列有关实验操作或现象描述不正确的是 。
A.实验开始时,应先通入氢气,然后再点燃C处酒精灯
B.E处酒精灯的作用是点燃未反应的氢气
C.实验结束时,应先停止通入氢气,然后熄灭C处酒精灯
(5)实验结束后,发现部分氧化铜粉末未被还原,已知反应前氧化铜质量为10克,反应结束后混合固体质量为9.2克,则被氢气还原的氧化铜的质量为 。
24.现配制50g溶质质量分数为15%的氯化钠溶液。
(1)配制50g溶质质量分数为15%的氯化钠溶液所需氯化钠的质量为 g;
(2)操作步骤如图所示:
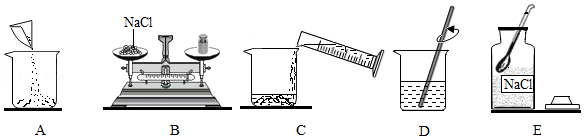
①上述操作步骤的正确顺序是 (填字母序号);
②B操作过程中若天平指针向左偏转,则应 ,直至指针指向分度盘中间;
(3)下列错误操作可能导致溶质质量分数小于15%的是 (填序号)。
①所称取的氯化钠固体不纯
②向烧杯中倒水溶解时部分水洒出
③装瓶时部分溶液洒出
④量取水时仰视读数
(1)配制50g溶质质量分数为15%的氯化钠溶液所需氯化钠的质量为 g;
(2)操作步骤如图所示:

①上述操作步骤的正确顺序是 (填字母序号);
②B操作过程中若天平指针向左偏转,则应 ,直至指针指向分度盘中间;
(3)下列错误操作可能导致溶质质量分数小于15%的是 (填序号)。
①所称取的氯化钠固体不纯
②向烧杯中倒水溶解时部分水洒出
③装瓶时部分溶液洒出
④量取水时仰视读数
25.我国高铁建设走在世界前列,修建高铁需要大量铁矿石来炼铁,进而炼钢。
(1)下列三种铁矿石的主要成分Fe2O3、Fe3O4、FeCO3中,含铁量最高的是 。
(2)要炼出含铁89.6%的生铁1000t,至少需要含氧化铁80%的赤铁矿 吨。若高炉气体不加处理,理论上会向大气中排放CO2 吨。
(1)下列三种铁矿石的主要成分Fe2O3、Fe3O4、FeCO3中,含铁量最高的是 。
(2)要炼出含铁89.6%的生铁1000t,至少需要含氧化铁80%的赤铁矿 吨。若高炉气体不加处理,理论上会向大气中排放CO2 吨。
26.某工厂现有废硫酸9.8t(H2SO4的质量分数为10%),试计算:
(1)该9.8t废硫酸中H2SO4的质量为 t;
(2)可以用该厂的废硫酸去中和处理另一工厂的废碱液(主要成分为NaOH),请写出中和过程中发生的化学反应方程式 ;
(3)如果用该9.8t废硫酸可以恰好中和废碱液20t,求废碱液中NaOH的质量分数。(写出计算过程)
(1)该9.8t废硫酸中H2SO4的质量为 t;
(2)可以用该厂的废硫酸去中和处理另一工厂的废碱液(主要成分为NaOH),请写出中和过程中发生的化学反应方程式 ;
(3)如果用该9.8t废硫酸可以恰好中和废碱液20t,求废碱液中NaOH的质量分数。(写出计算过程)
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解