下载高清试卷
【2021-2022学年广东实验中学九年级(上)期末化学试卷】-第1页
试卷格式:2021-2022学年广东实验中学九年级(上)期末化学试卷.PDF
试卷热词:最新试卷、2022年、广东试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷

扫码查看解析
试卷题目
1.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
- A. 面粉
- B. 氯化钠
- C. 汽油
- D. 花生油
2.甲、乙两种物质的溶解度曲线如图所示.下列说法正确的是( )
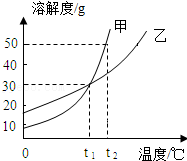

- A. t1℃时甲和乙的饱和溶液,升温到t2℃时仍是饱和溶液
- B. 甲和乙的溶解度相等
- C. t1℃时,甲和乙各30g分别加入100g水中,均形成饱和溶液
- D. t2℃时,在100g水中加入60g甲,形成不饱和溶液
3.向如图所示烧杯内加入一种物质,轻轻搅拌溶解后,发现粘水的塑料片和烧杯底部冻结在一起,则加入的物质可能是( )
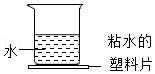

- A. 硝酸铵
- B. 氧化钙
- C. 氢氧化钠
- D. 氯化钠
4.如图是利用海水提取粗盐的过程,根据海水晒盐的过程。下列分析正确的是( )
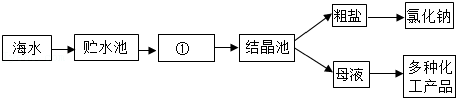

- A. 海水进入贮水池、①、结晶池发生了化学变化
- B. 在①中,海水中氯化钠的质量逐渐增加
- C. 析出晶体后的母液是氯化钠的不饱和溶液
- D. 在①中,海水中水的质量逐渐减少
5.打开碳酸饮料的瓶盖,能听到“咝”的一声,有气体冲出,下列图示能正确解释这个现象的是( )
- A.
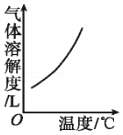
- B.
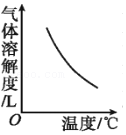
- C.
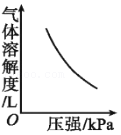
- D.

6.下列物质中,能用金属跟稀酸反应直接制得的是( )
- A. 硫酸铜
- B. 氯化镁
- C. 氯化铁
- D. 硫酸银
7.厕所用的清洁剂中含有盐酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有气体产生,这种气体是( )
- A. 二氧化硫
- B. 二氧化碳
- C. 氢气
- D. 氧气
8.金属X在溶液中的活动性是 Ag<X<H<Al,下列对金属X化学性质的预测正确的是( )
- A. X能与AgNO3溶液反应
- B. 高温条件下不与O2反应
- C. X能与Al2(SO4)3溶液反应
- D. X能与稀盐酸反应
9.铁生锈是生活中常见现象如图可探究铁生锈与水有关的是( )
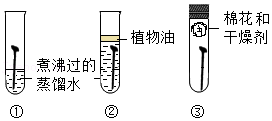

- A. ①③
- B. ①②
- C. ②③
- D. ②
10.实验小组探究盐酸和氢氧化钠反应过程中pH的变化规律,得到如图所示的曲线。有关该实验事实的说法正确的是( )
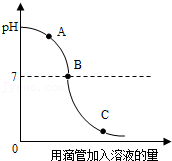

- A. 该实验是将氢氧化钠溶液滴入盐酸中
- B. B点表示盐酸和氢氧化钠恰好完全反应
- C. C点时的溶液能使紫色石蕊溶液变蓝
- D. A点时,溶液中的溶质是氢氧化钠
11.下列说法正确的是( )
- A. 将pH试纸直接浸入待测液中测其pH
- B. 不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,再涂上3%~5%的氢氧化钠溶液
- C. 氢氧化钠固体在空气中易潮解易变质,需要密闭保存
- D. 打开盛有浓硫酸的试剂瓶瓶盖,在空气中形成白雾
12.“劳动创造幸福,实干成就伟业。”下列劳动所涉及的化学知识正确的是( )
| 选项 | 劳动项目 | 化学知识 |
| A | 用明矾处理较浑浊的天然水 | 明矾主要起杀菌消毒作用 |
| B | 可用氢氧化钠改良酸性土壤 | 氢氧化钠能与酸反应 |
| C | 在盐田中晾晒海水,得到粗盐 | 粗盐除去泥沙即可得到纯净的氯化钠 |
| D | 煮水时,若水的硬度大,易结垢 | 硬水中含有较多可溶性钙、镁化合物 |
- A. A
- B. B
- C. C
- D. D
13.除去下列物质中的少量杂质,所选用试剂和操作方法都正确的是( )
| 选项 | 物质 | 杂质 | 所用试剂和操作方法 |
| A | H2O | NaCl | 向水中加入活性炭吸附 |
| B | CO2 | CO | 通过灼热的氧化铜充分反应 |
| C | NH3 | 水蒸气 | 通入浓硫酸 |
| D | Ca(OH)2 | CaCO3 | 加入适量稀盐酸 |
- A. A
- B. B
- C. C
- D. D
14.北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜 方法,其主要生产流程如图所示。下列解释合理的是( )
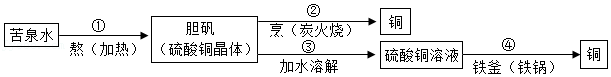

- A. ①通过蒸发溶剂可获得晶体
- B. ②是通过化合反应获得铜
- C. ③所得硫酸铜溶液一定是饱和的
- D. ④说明铁元素变成了铜元素
15.(1)常温下,铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化膜,反应的化学方程式是 ;
(2)服用含氢氧化铝[Al(OH)3]的药物可以治疗胃酸过多,反应的化学方程式为 。
(3)高温条件下一氧化碳能把铁从磁铁矿石(主要成分为 Fe3O4)中还原出来,反应的化学方程式是 。
(4)常温下,将 CO2气体持续通入饱和的氢氧化钠溶液中,已知发生反应:
①CO2+2NaOH═Na2CO3+H2O,②Na2CO3+CO2+H2O═2NaHCO3↓。
请尝试写出该过程的实验现象 。
(5)高溴酸(HBrO4)是溴的常见化合物,具有极强的酸性和氧化性。高溴酸溶液中存在的主要离子是 (填化学符号)从物质分类的角度分析,高溴酸属于 (填字母)。
A、混合物
B、纯净物
C、氧化物
D、酸
E、盐
(6)阅读短文,回答问题:
21 世纪的能源金属——锂(Li)
锂是一种银白色金属,质软,密度比所有的油和液态烃都小,故应存放于液态石蜡中;与稀硫酸迅速反应并生成硫酸锂(Li2SO4)和氢气;与水反应生成氢氧化锂和氢气,并且放出热量。我国的锂矿资源十分丰富,目前,以我国的锂盐产量计算,仅江西的云母锂矿就可供开采上百年。1800 年,意大利人伏达发明世界上第一个电池,后来后人根据伏达的电池陆续发明了干电池、铅蓄电池。锂电池是 21 世纪才研制并开发的优质能源,是很有前途的动力电池。当前手机中广泛使用的电池,主要是高能锂电池。用锂电池发电来开动汽车,行车费只有普通汽油发动机汽车的
。镁锂合金是高强度轻质合金,被称为“明天的宇航合金”,广泛用于航空航天工业。总的来讲,锂电池对环境的影响不大,不论生产、使用和报废都不会产生任何铅、汞、镉等有毒有害重金属元素和物质。
写出锂着火了不能用水灭火的原因(化学方程式表示): 。
镁锂合金的熔点比锂的熔点 。
(2)服用含氢氧化铝[Al(OH)3]的药物可以治疗胃酸过多,反应的化学方程式为 。
(3)高温条件下一氧化碳能把铁从磁铁矿石(主要成分为 Fe3O4)中还原出来,反应的化学方程式是 。
(4)常温下,将 CO2气体持续通入饱和的氢氧化钠溶液中,已知发生反应:
①CO2+2NaOH═Na2CO3+H2O,②Na2CO3+CO2+H2O═2NaHCO3↓。
请尝试写出该过程的实验现象 。
(5)高溴酸(HBrO4)是溴的常见化合物,具有极强的酸性和氧化性。高溴酸溶液中存在的主要离子是 (填化学符号)从物质分类的角度分析,高溴酸属于 (填字母)。
A、混合物
B、纯净物
C、氧化物
D、酸
E、盐
(6)阅读短文,回答问题:
21 世纪的能源金属——锂(Li)
锂是一种银白色金属,质软,密度比所有的油和液态烃都小,故应存放于液态石蜡中;与稀硫酸迅速反应并生成硫酸锂(Li2SO4)和氢气;与水反应生成氢氧化锂和氢气,并且放出热量。我国的锂矿资源十分丰富,目前,以我国的锂盐产量计算,仅江西的云母锂矿就可供开采上百年。1800 年,意大利人伏达发明世界上第一个电池,后来后人根据伏达的电池陆续发明了干电池、铅蓄电池。锂电池是 21 世纪才研制并开发的优质能源,是很有前途的动力电池。当前手机中广泛使用的电池,主要是高能锂电池。用锂电池发电来开动汽车,行车费只有普通汽油发动机汽车的
| 1 |
| 3 |
写出锂着火了不能用水灭火的原因(化学方程式表示): 。
镁锂合金的熔点比锂的熔点 。
16.小宇用质量分数为 98%的浓硫酸溶液,配制 49g 质量分数为 20%的稀硫酸溶液。(注:98%浓硫酸的密度为 1.84g/cm3;水的密度为 1.0g/cm3)
(1)经计算,需要 98%浓硫酸溶液体积 mL;需要水为 g。(计算结果保留一位小数)
(2)量取液体过程中所需要的玻璃仪器为 (填字母)。
A、10mL 量筒
B、50mL 量筒
C、100mL 量筒
D、胶头滴管
(3)下列属于上述硫酸溶液配制过程中正确的实验操作是 (填字母)。

(4)将配制好的稀硫酸转移到细口瓶中,盖好瓶塞并贴上标签,请完成标签内容 。

(5)如果不慎将浓硫酸沾到皮肤或者衣服上,应立即 然后涂上 3%~5%的碳酸氢钠溶液。
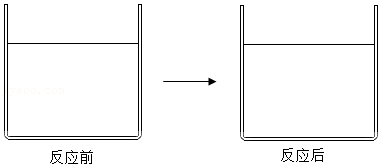
(6)在稀硫酸中加入过量的镁条,充分反应,画出反应前后溶液中存在的离子示意图,并进行必要的标注:
。
(1)经计算,需要 98%浓硫酸溶液体积 mL;需要水为 g。(计算结果保留一位小数)
(2)量取液体过程中所需要的玻璃仪器为 (填字母)。
A、10mL 量筒
B、50mL 量筒
C、100mL 量筒
D、胶头滴管
(3)下列属于上述硫酸溶液配制过程中正确的实验操作是 (填字母)。

(4)将配制好的稀硫酸转移到细口瓶中,盖好瓶塞并贴上标签,请完成标签内容 。

(5)如果不慎将浓硫酸沾到皮肤或者衣服上,应立即 然后涂上 3%~5%的碳酸氢钠溶液。
(6)在稀硫酸中加入过量的镁条,充分反应,画出反应前后溶液中存在的离子示意图,并进行必要的标注:
。

17.二氧化碲(TeO2)是性能优良的声光晶体材料。用某工业废渣(主要含有 TeO2,还有少量 Cu、Ag)为原料制备纯净的 TeO2的一种工艺流程如图:
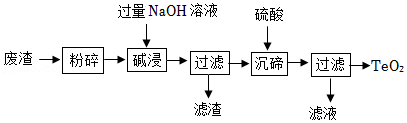
已知:TeO2微溶于水,能与 NaOH 发生反应。H2TeO3不稳定易分解。回答下列问题:
(1)根据所学知识,将含碲物质进行分类,各举一例填入如图(写化学式)。
单质 氧化物 酸 盐
(2)粉碎的目的是 。
(3)类比 CO2和 NaOH 反应,写出“碱浸”时发生反应的化学方程式 。
(4)“碱浸”后过滤,此时滤渣成分为 。
(5)请用类比的方法判断“沉碲”时加入硫酸后发生的化学反应方程式 。

已知:TeO2微溶于水,能与 NaOH 发生反应。H2TeO3不稳定易分解。回答下列问题:
(1)根据所学知识,将含碲物质进行分类,各举一例填入如图(写化学式)。
单质 氧化物 酸 盐
(2)粉碎的目的是 。
(3)类比 CO2和 NaOH 反应,写出“碱浸”时发生反应的化学方程式 。
(4)“碱浸”后过滤,此时滤渣成分为 。
(5)请用类比的方法判断“沉碲”时加入硫酸后发生的化学反应方程式 。
18.NaCl在生产和生活中具有广泛的用途,是一种重要的资源。通过晾晒海水可以得到粗盐和母液(苦卤)。如图为母液中最主要的四种盐(NaCl、KCl、MgCl2、MgSO4)的溶解度曲线图。回答下列问题:
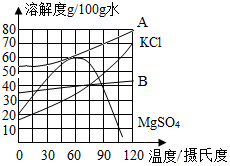
(1)①90℃时,四种盐中MgCl2的溶解度最大,则表示MgCl2溶解度曲线的是 (填“A”或“B”),此时饱和MgCl2溶液的质量分数为 (请写出计算表达式即可)。
②四种盐中溶解度受温度变化的影响最小的是 (填化学式)。
(2)60℃时,若母液中的NaCl、KCl、MgCl2、MgSO4都已达到饱和,为了获得较纯净的MgSO4晶体,可采用的方法是 。
(3)工业上常通过加入碱溶液与母液中的Mg2+反应来制取Mg(OH)2沉淀。为了探究获得较高Mg2+沉淀率的反应条件,进行下列对比实验(每组实验取250mL母液):
①反应过程中需测定溶液的pH,则测定溶液pH的操作是:先在玻璃片上放一小片pH试纸,然后用 ,再将试纸显示的颜色与标准比色卡比较,读取溶液的pH。
②实验b和d对比,可得到的结论是 。
③表格中x的数值可能为 (填编号)。
A.95.8
B.92.1
C.97.2
D.93.1

(1)①90℃时,四种盐中MgCl2的溶解度最大,则表示MgCl2溶解度曲线的是 (填“A”或“B”),此时饱和MgCl2溶液的质量分数为 (请写出计算表达式即可)。
②四种盐中溶解度受温度变化的影响最小的是 (填化学式)。
(2)60℃时,若母液中的NaCl、KCl、MgCl2、MgSO4都已达到饱和,为了获得较纯净的MgSO4晶体,可采用的方法是 。
(3)工业上常通过加入碱溶液与母液中的Mg2+反应来制取Mg(OH)2沉淀。为了探究获得较高Mg2+沉淀率的反应条件,进行下列对比实验(每组实验取250mL母液):
| 实验序号 | 反应温度/℃ | 反应时间/min | 反应pH值 | Mg2+的沉淀率/% |
| a | 40 | 60 | 10 | 90.1 |
| b | 40 | 60 | 12 | 92.7 |
| c | 40 | 90 | 12 | 93.6 |
| d | 50 | 60 | 12 | 96.4 |
| e | 50 | 90 | 12 | x |
①反应过程中需测定溶液的pH,则测定溶液pH的操作是:先在玻璃片上放一小片pH试纸,然后用 ,再将试纸显示的颜色与标准比色卡比较,读取溶液的pH。
②实验b和d对比,可得到的结论是 。
③表格中x的数值可能为 (填编号)。
A.95.8
B.92.1
C.97.2
D.93.1
19.硫化氢(H2S)是一种有毒气体,其密度比空气大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)与稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体。试回答: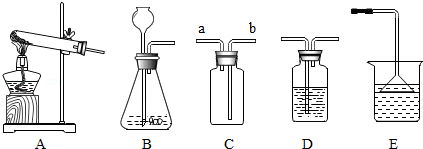
(1)实验室制取硫化氢的化学反应方程式为 。
(2)根据装置图回答下列问题:
①制取硫化氢气体的发生装置可以选用 。
②若用C装置收集硫化氢气体,进气口应为 。
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是 ,现象是
④做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置E吸收,E中的试剂应该为 。

(1)实验室制取硫化氢的化学反应方程式为 。
(2)根据装置图回答下列问题:
①制取硫化氢气体的发生装置可以选用 。
②若用C装置收集硫化氢气体,进气口应为 。
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是 ,现象是
④做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置E吸收,E中的试剂应该为 。
20.维生素C又名抗坏血酸,易溶于水,易被氧化,遇热易被破坏。人体缺乏维生素C可能引发多种疾病。请预测维生素C溶液的化学性质,限选试剂有维生素C片、蒸馏水、紫色石蕊溶液、氢氧化钠溶液、碳酸钠溶液、锌片、铜片。
(1)配制维生素C溶液。将维生素C片研碎放入烧杯中,溶于蒸馏水制成溶液。如果要加速维生素C片在水中的溶解,操作方法是 (填字母)。
A.常温下搅拌
B.边加热边搅拌
不选择另一种操作的原因是 。
(2)请你预测维生素C溶液的化学性质,利用限选试剂设计实验验证。
(1)配制维生素C溶液。将维生素C片研碎放入烧杯中,溶于蒸馏水制成溶液。如果要加速维生素C片在水中的溶解,操作方法是 (填字母)。
A.常温下搅拌
B.边加热边搅拌
不选择另一种操作的原因是 。
(2)请你预测维生素C溶液的化学性质,利用限选试剂设计实验验证。
| 预测 | 验证预测的实验操作与预期现象 |
| 例:维生素C溶液能与酸碱指示剂反应 | 取少量维生素C溶液于试管中,加入几滴紫色石蕊溶液振荡,如果发现紫色石蕊溶液变红,则预测成立。 |
| ①维生素C溶液能与________(填物质类别,下同)反应 | 取少量维生素C溶液于试管中,________,如果发现________,则预测成立。 |
| ②维生素C溶液能与________反应 | 取少量维生素C溶液于试管中,________,如果发现________,则预测成立。 |
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解