下载高清试卷
【2021-2022学年山东省济宁市任城区九年级(上)期中化学试卷(五四学制)】-第1页
试卷格式:2021-2022学年山东省济宁市任城区九年级(上)期中化学试卷(五四学制).PDF
试卷热词:最新试卷、2022年、山东试卷、济宁市试卷、化学试卷、九年级上学期试卷、期中试卷、初中试卷

扫码查看解析
试卷题目
1.下列关于溶液的叙述正确的是( )
- A. 溶液都是均一、稳定的液体
- B. 溶液一定是无色的,且溶剂一定是水
- C. 外界条件不改变,溶质不会从溶液中分离出来
- D. 饱和溶液就是不能再溶解任何物质的溶液
2.下列物质露置在空气中一段时间后,因为发生化学变化而质量增加的是( )
- A. 浓硫酸
- B. 浓盐酸
- C. 氢氧化钠
- D. 石灰石
3.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品( )
- A. 食盐
- B. 味精
- C. 食醋
- D. 香油
4.物质的性质决定其用途。下列物质的性质与用途对应关系不正确的是( )
- A. 氧化钙能与水反应,可做食品干燥剂
- B. 熟石灰能吸收空气中的二氧化碳,可以用来改良酸性土壤
- C. 洗洁精对油污有乳化作用,可用于去除油污
- D. 盐酸能与氧化铁反应,可用来去除铁锈
5.将20g溶质质量分数为98%的浓硫酸稀释成20%的稀硫酸,下列说法不正确的是( )
- A. 实验步骤:计算、量取、溶解、装瓶贴签
- B. 稀释溶解时将浓硫酸沿器壁慢慢注入水中,并不断搅拌
- C. 浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
- D. 细口瓶中的稀硫酸在使用中不慎洒出一部分,剩余溶液的溶质质量分数减小
6.如图是KCl、KNO3两种固体物质的溶解度曲线,下列说法正确的是( )
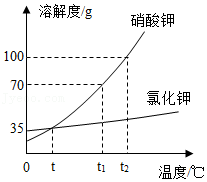

- A. KNO3的溶解度大于KCl的溶解度
- B. t1℃时KNO3的溶解度是70
- C. 在t1℃时,100g KNO3饱和溶液和100g KCl饱和溶液,KCl饱和溶液中的溶剂质量大于KNO3饱和溶液中的溶剂质量
- D. 在t2℃时,欲使KNO3、KCl两种物质的溶液分别降到t℃时,析出晶体的质量KCl一定小于KNO3
7.一些物质的近似pH如图所示,下列有关说法正确的是( )


- A. 鸡蛋清的碱性比肥皂水的碱性强
- B. 厕所清洁剂不会腐蚀大理石地面
- C. 厕所清洁剂与炉具清洁剂不能混合使用
- D. 人被蚊虫叮咬后,在肿包处涂抹牛奶就可减轻痛痒
8.鉴别氢氧化钠溶液和澄清的石灰水的四组方案,一定能达到实验目的的是( )
- A.

- B.
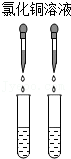
- C.
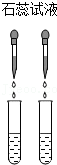
- D.

9.海洋是人类巨大的资源宝库,下列说法正确的是( )
- A. 淡化海水常用的方法有蒸发结晶法和反渗透法
- B. 利用海底蕴藏的大量“可燃冰”作燃料,不会加剧温室效应
- C. 海水淡化只能得到淡水,剩余物质不再有利用价值
- D. 为检验蒸馏法得到的冷凝水样中是否含有氯化钠,可向试样中滴加几滴硝酸银溶液
10.推理是学习化学的一种重要方法。下列的推理正确的是( )
- A. 某溶液不能使酚酞溶液变色,说明该溶液一定显酸性
- B. 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
- C. 酸和碱的溶液能与指示剂反应,则所有的酸和碱都能使指示剂变色
- D. 稀盐酸、稀硫酸都能使石蕊试液变红,则稀硝酸也能使石蕊溶液变红
11.如图是氢氧化钠与盐酸恰好完全反应的微观示意图,下列结论不正确的是( )


- A. 该反应属于复分解反应
- B. 反应前后水分子个数不发生变化
- C. 反应前后所有元素的化合价均无变化
- D. 该反应的微观实质是H+和OH﹣结合生成H2O
12.除去下列物质中的少量杂质(括号内为杂质),所选试剂正确的是( )
- A. CO2(H2O):浓硫酸
- B. HCl(H2SO4):适量的硝酸钡溶液
- C. CaO粉末(CaCO3):足量的蒸馏水
- D. NaOH溶液(Na2CO3):稀盐酸
13.下列实验不能达到实验目的的是( )
- A.
 利用此实验比较不同物质在同种溶剂中的溶解性
利用此实验比较不同物质在同种溶剂中的溶解性 - B.
 实验探究氢氧化钠和盐酸能否反应
实验探究氢氧化钠和盐酸能否反应 - C.
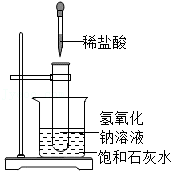 利用此实验验证稀盐酸和氢氧化钠溶液反应放热
利用此实验验证稀盐酸和氢氧化钠溶液反应放热 - D.
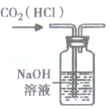 除去二氧化碳中混有的HCl气体
除去二氧化碳中混有的HCl气体
14.已知某溶液X是下列四种溶液中的一种,取三份等量的该溶液,分别向其中滴加NaOH溶液、稀盐酸、AgNO3溶液中的各一种,产生的现象如表所述。则该溶液X是下列各项中的( )
| 加入的物质 | NaOH溶液 | 稀盐酸 | AgNO3溶液 |
| 实验现象 | 蓝色沉淀 | 无明显现象 | 白色沉淀 |
- A. Na2CO3溶液
- B. 稀硝酸
- C. NaCl溶液
- D. CuCl2溶液
15.向盛有一定质量稀盐酸的四个烧杯中,分别逐渐加入金属镁、Fe2O3固体、Cu(OH)2固体、Na2CO3溶液至过量。下列图像能正确反映其对应变化关系的是( )
- A.
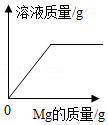
- B.

- C.
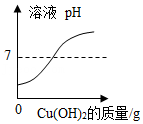
- D.
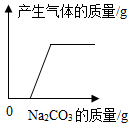
16.化学就在我们身边,它能改善我们的生活。请回答下列问题:
(1)某同学的部分体液的pH如图所示。
①图中碱性最强的体液是 。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平[主要成分为Al(OH)3]治疗,其原理用化学方程式表示为 。
(2)众志成城、全民抗疫。
①疫情期间,某食品公司向医院捐赠了一批“即热米饭”,该“即热米饭”用生石灰和水的反应作为热源,请写出化学方程式 。
(3)维生素C又名抗坏血酸,在酸性环境下稳定,高温下不稳定。它主要存在于水果和黄瓜等蔬菜中,能增强人体对疾病的抵抗能力。
①根据信息可知,维生素C溶液显 (填“酸性”、“中性”或“碱性”)。
②在下列物质中,能与维生素C溶液发生反应的是 (填选项序号)。
a.食盐
b.苛性钠
c.硫酸钠
③为较好吸收利用维生素C,食用黄瓜时宜 (填“凉拌”或“煮熟”)。
(4)酿酒厂生产白酒时,常加入适量稀盐酸来控制酸度,发酵后完成蒸馏即可得白酒。盐酸也可以控制酸度,且价格比硫酸低。此处不用盐酸的原因是 。
(5)小明在家发现两根锈铁钉,带到实验室里,将其放入稀盐酸中,观察到 ,反应的化学方程式为 。小明未将金属立即取出,过了段时间后,又看到金属表面有气泡出现,则该反应的方程式为 。

(1)某同学的部分体液的pH如图所示。
①图中碱性最强的体液是 。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平[主要成分为Al(OH)3]治疗,其原理用化学方程式表示为 。
(2)众志成城、全民抗疫。
①疫情期间,某食品公司向医院捐赠了一批“即热米饭”,该“即热米饭”用生石灰和水的反应作为热源,请写出化学方程式 。
(3)维生素C又名抗坏血酸,在酸性环境下稳定,高温下不稳定。它主要存在于水果和黄瓜等蔬菜中,能增强人体对疾病的抵抗能力。
①根据信息可知,维生素C溶液显 (填“酸性”、“中性”或“碱性”)。
②在下列物质中,能与维生素C溶液发生反应的是 (填选项序号)。
a.食盐
b.苛性钠
c.硫酸钠
③为较好吸收利用维生素C,食用黄瓜时宜 (填“凉拌”或“煮熟”)。
(4)酿酒厂生产白酒时,常加入适量稀盐酸来控制酸度,发酵后完成蒸馏即可得白酒。盐酸也可以控制酸度,且价格比硫酸低。此处不用盐酸的原因是 。
(5)小明在家发现两根锈铁钉,带到实验室里,将其放入稀盐酸中,观察到 ,反应的化学方程式为 。小明未将金属立即取出,过了段时间后,又看到金属表面有气泡出现,则该反应的方程式为 。

17.甲、乙两种固体的溶解度曲线如图1所示:

(1)t2℃时,溶解度大小关系为:甲 (填“<”“=”或“>”)乙。
(2)根据图2实验现象,推测加入的“某固体”是图1中的 (填“甲”或“乙”)物质。
(3)t3℃时,若将甲溶液由N点转变为M点状态,可采取 的方法(写一种)。
(4)根据图1和图2信息,判断下列说法正确的是 。
A.图2中b、d的溶液一定是不饱和状态,c的溶液一定是饱和状态
B.若要让溶液d恰好达到饱和状态,需要加入该固体8g
C.t3℃时,N点表示乙的不饱和溶液
D.c溶液中溶质的质量分数是37.5%

(1)t2℃时,溶解度大小关系为:甲 (填“<”“=”或“>”)乙。
(2)根据图2实验现象,推测加入的“某固体”是图1中的 (填“甲”或“乙”)物质。
(3)t3℃时,若将甲溶液由N点转变为M点状态,可采取 的方法(写一种)。
(4)根据图1和图2信息,判断下列说法正确的是 。
A.图2中b、d的溶液一定是不饱和状态,c的溶液一定是饱和状态
B.若要让溶液d恰好达到饱和状态,需要加入该固体8g
C.t3℃时,N点表示乙的不饱和溶液
D.c溶液中溶质的质量分数是37.5%
18.对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如图对比实验。
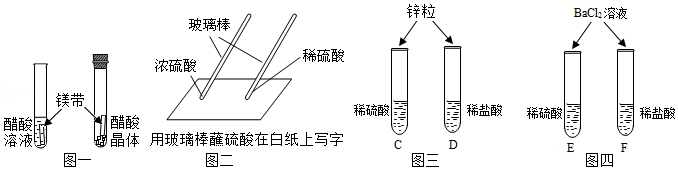
(1)图一实验中,观察到醋酸晶体试管内 ,醋酸溶液试管中镁带表面冒气泡。因此酸的很多反应通常在水溶液中才能完成。
(2)图二实验中,观察到 (填“浓”或“稀”)硫酸使白纸炭化。即使是同种酸,由于 不同,它们的性质不完全相同。
(3)图三实验中,观察到两支试管中均有 产生,不同的酸具有相似的性质,这是因为酸的组成中都含有 (填微粒符号)。
(4)图四实验E试管中产生 ,F试管中无明显现象。不同的 会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸,写出氯化钡和硫酸反应的化学方程式 。

(1)图一实验中,观察到醋酸晶体试管内 ,醋酸溶液试管中镁带表面冒气泡。因此酸的很多反应通常在水溶液中才能完成。
(2)图二实验中,观察到 (填“浓”或“稀”)硫酸使白纸炭化。即使是同种酸,由于 不同,它们的性质不完全相同。
(3)图三实验中,观察到两支试管中均有 产生,不同的酸具有相似的性质,这是因为酸的组成中都含有 (填微粒符号)。
(4)图四实验E试管中产生 ,F试管中无明显现象。不同的 会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸,写出氯化钡和硫酸反应的化学方程式 。
19.海洋中蕴含着丰富的资源,人们可以从海水中获取很多物质。
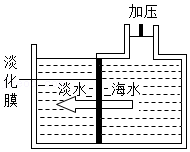
(1)海水淡化:膜分离技术可用于淡化海水(如图所示),通过膜的主要微粒是 。
(2)海水制镁:从海水或卤水中制备金属镁流程如图。

①为了使海水中含量较低的镁元素富集,加入的试剂a为 ,该反应的化学方程式为 ,基本反应类型为 反应,此过程富集元素的同时也达到了 的目的。
②加入试剂b发生反应的化学方程式为 。
③下列有关电解过程中能量转化的说法,正确的是 (填序号)。
A.电能转化为化学能
B.化学能转化为电能
C.潮汐能转化为化学能
(3)海水晒盐:海水中含有氯化钠、氯化钙等物质,如图是从海水中提取氯化钠的大致过程和氯化钠、氯化钙的溶解度表。

①将粗盐从海水中结晶出来的方法是 ,将粗盐和母液分离的操作是 。
②经长时间日晒,氯化钙不易大量结晶析出的原因是 。
③根据海水晒盐的原理,下列说法中不正确的是 (填序号)。
A.海水进入贮水池,海水的成分基本不变
B.在蒸发池里,海水中水的质量逐渐增加
C.析出晶体后的母液是氯化钠的不饱和溶液
(1)海水淡化:膜分离技术可用于淡化海水(如图所示),通过膜的主要微粒是 。

(2)海水制镁:从海水或卤水中制备金属镁流程如图。

①为了使海水中含量较低的镁元素富集,加入的试剂a为 ,该反应的化学方程式为 ,基本反应类型为 反应,此过程富集元素的同时也达到了 的目的。
②加入试剂b发生反应的化学方程式为 。
③下列有关电解过程中能量转化的说法,正确的是 (填序号)。
A.电能转化为化学能
B.化学能转化为电能
C.潮汐能转化为化学能
(3)海水晒盐:海水中含有氯化钠、氯化钙等物质,如图是从海水中提取氯化钠的大致过程和氯化钠、氯化钙的溶解度表。

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 氯化钙 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
①将粗盐从海水中结晶出来的方法是 ,将粗盐和母液分离的操作是 。
②经长时间日晒,氯化钙不易大量结晶析出的原因是 。
③根据海水晒盐的原理,下列说法中不正确的是 (填序号)。
A.海水进入贮水池,海水的成分基本不变
B.在蒸发池里,海水中水的质量逐渐增加
C.析出晶体后的母液是氯化钠的不饱和溶液
20.实验室有失去标签的两瓶无色溶液,分别是氢氧化钡溶液和稀硫酸。为了鉴别它们设计如下鉴别方法:先把两瓶溶液分别贴上标签A、B,然后进行实验。
(1)
化学小组同学对方法2进一步探究,设计了如下实验方案。
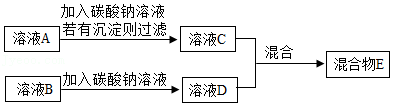
溶液C和溶液D混合,可能有以下三种情况:
(2)若有气泡产生,写出反应的化学方程式 ;
(3)若有沉淀产生,通过现象可推出溶液C中的溶质除了生成物NaOH外,还有 ;写出溶液A→溶液C发生反应的化学方程式 ;
(4)若无明显现象,混合物E中所含溶质种类最多时,写出所有溶质的化学式 。
(1)
| 加入的试剂 | 实验现象 | 实验结论 | |
| 方法1 | 锌粒 | A中无明显现象;B中产生气泡 | A是 溶液;B是 溶液 |
| 方法2 | 碳酸钠溶液 | A中 ;B中 。 |
化学小组同学对方法2进一步探究,设计了如下实验方案。

溶液C和溶液D混合,可能有以下三种情况:
(2)若有气泡产生,写出反应的化学方程式 ;
(3)若有沉淀产生,通过现象可推出溶液C中的溶质除了生成物NaOH外,还有 ;写出溶液A→溶液C发生反应的化学方程式 ;
(4)若无明显现象,混合物E中所含溶质种类最多时,写出所有溶质的化学式 。
21.据图回答下列有关实验的问题:

(1)如图1,操作一现象:加入硝酸铵后,一会儿发现烧杯与塑料片粘在一起,其原因是硝酸铵晶体溶于水时 热量,使溶液的温度降到0℃以下,塑料片上的水结成冰。操作二现象:烧杯与塑料片分离,其原因是 。
(2)如图2,探究二氧化碳能否与水、饱和石灰水、氢氧化钠溶液反应。小明分别振荡三个软质塑料瓶,观察到塑料瓶都变瘪且变瘪的程度由大到小的顺序为A>B>C。
①小明认为通过塑料瓶变瘪就可证明二氧化碳与三种物质都能发生反应,你认为小明的结论 (填“是或否”)正确,理由是 。
②小华取C瓶溶液少量,滴加紫色的石蕊试液,看到 现象,说明CO与水反应生成了酸。对“无明显现象发生”的化学反应,小华的探究思路和方法是 。
③B瓶中发生的还有 现象能证明反应发生。对比A瓶与 瓶的实验现象,可证明二氧化碳能与氢氧化钠溶液发生反应且溶质的溶解性更强,该反应的化学方程式为 。

(1)如图1,操作一现象:加入硝酸铵后,一会儿发现烧杯与塑料片粘在一起,其原因是硝酸铵晶体溶于水时 热量,使溶液的温度降到0℃以下,塑料片上的水结成冰。操作二现象:烧杯与塑料片分离,其原因是 。
(2)如图2,探究二氧化碳能否与水、饱和石灰水、氢氧化钠溶液反应。小明分别振荡三个软质塑料瓶,观察到塑料瓶都变瘪且变瘪的程度由大到小的顺序为A>B>C。
①小明认为通过塑料瓶变瘪就可证明二氧化碳与三种物质都能发生反应,你认为小明的结论 (填“是或否”)正确,理由是 。
②小华取C瓶溶液少量,滴加紫色的石蕊试液,看到 现象,说明CO与水反应生成了酸。对“无明显现象发生”的化学反应,小华的探究思路和方法是 。
③B瓶中发生的还有 现象能证明反应发生。对比A瓶与 瓶的实验现象,可证明二氧化碳能与氢氧化钠溶液发生反应且溶质的溶解性更强,该反应的化学方程式为 。
22.(1)某小组同学将一定量的稀硫酸滴加到盛有NaOH溶液的小烧杯中,实验中未观察到明显现象,请教老师后,发现他们在滴加稀硫酸前忘了加入酸碱指示剂,导致无法判断反应情况,于是他们对试管中溶液的中和程度进行探究。该反应的化学方程式为 。针对反应后溶液中溶质是什么,大家纷纷提出猜想:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
实验探究:
(2)小雷同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 。
(3)为了验证其余猜想,小组其他同学利用烧杯中的溶液,并选用老师提供的pH试纸、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。
得出结论:通过探究,全组同学一致确定猜想二是正确的。
评价反思:
(4)老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出实验探究(3)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:①实验操作中的错误是 。②实验方案中也有一个是错误的,错误的原因是 。
继续探究:
(5)请你再设计一个方案证明猜想二正确,方案是(“实验步骤”中选择的药品不可以用酸碱指示剂,不可与上述实验方案中药品类别重复,“结论”的表述中能用化学方程式表示的要写出化学方程式):
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
实验探究:
(2)小雷同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 。
(3)为了验证其余猜想,小组其他同学利用烧杯中的溶液,并选用老师提供的pH试纸、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 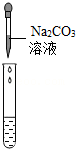 | 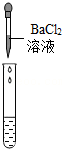 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
得出结论:通过探究,全组同学一致确定猜想二是正确的。
评价反思:
(4)老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出实验探究(3)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:①实验操作中的错误是 。②实验方案中也有一个是错误的,错误的原因是 。
继续探究:
(5)请你再设计一个方案证明猜想二正确,方案是(“实验步骤”中选择的药品不可以用酸碱指示剂,不可与上述实验方案中药品类别重复,“结论”的表述中能用化学方程式表示的要写出化学方程式):
| 步骤 | 现象 | 结论 |
23.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的氢氧化钠溶液逐滴加入到样品中,边加边搅拌,随着氢氧化钠溶液的加入,溶液pH的变化情况如图所示。请回答:

(1)a点溶液中含有的离子是 。
(2)pH=7时,消耗氢氧化钠质量为 g。
(3)计算稀硫酸中溶质的质量分数。(计算结果精确至0.1%)

(1)a点溶液中含有的离子是 。
(2)pH=7时,消耗氢氧化钠质量为 g。
(3)计算稀硫酸中溶质的质量分数。(计算结果精确至0.1%)
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解