下载高清试卷
【2022年四川省泸州市龙马潭区中考化学一模试卷】-第1页
试卷格式:2022年四川省泸州市龙马潭区中考化学一模试卷.PDF
试卷热词:最新试卷、2022年、四川试卷、泸州市试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷

扫码查看解析
试卷题目
1.以下叙述涉及的变化是化学变化的是( )
- A. 我国嫦娥五号在月球上成功采集到了1731g月壤
- B. 通过戴活性炭口罩防雾霾
- C. 2021年,黑龙江风电、光伏发电量比2015年增长了3倍
- D. 森林固碳是减缓气候变化的重要途径
2.在全国抗击“新冠肺炎“的“战疫“中用了大量的“84“来消毒杀菌。过”84”是一种高效消毒剂,主要成分为次氯酸钠(NaClO)。下列有关叙述正确的是( )
- A. NaClO是一种氧化物
- B. 相对分子质量为74.5
- C. NaClO中氯元素的化合价为﹣1价
- D. NaClO中氧元素的质量分数最高
3.疫情防控,全员配合。测量体温是疫情防控中重要的手段。下列有关水银体温计的说法正确的是( )
- A. 体温计中的汞属于非金属单质
- B. 体温计中的汞有毒,不小心打碎温度计应该及时通风,可以撒上硫磺粉处理
- C. 当温度升高时汞原子不断运动,温度不变时汞原子静止
- D. 体温计的原理是温度改变时汞原子大小发生改变
4.化学与生活密切相关。下列有关物质的性质与用途说法错误的是( )
- A. 氧气具有氧化性,是可燃物燃烧的催化剂
- B. 铜的导电性优良,被广泛用于电子制造业
- C. 根据土壤酸碱性和植物生长的需要,可以向土壤中撒熟石灰改良酸性土壤
- D. 医疗上可以用碳酸氢钠治疗胃酸过多
5.水是初中化学学习和研究的重要物质。下列有关水的说去错误的是( )
- A. 中和反应一定有水生成
- B. 水通电分解得到两种单质
- C. 农药、化肥的施用会造成水体污染,应该禁止施用
- D. 自然界水循环的途径是水的三态变化
6.日本福岛多次发生放射性碘泄露的事故。可以服用不具有放射性的碘﹣127以降低放射性碘﹣131对人体的伤害,其原子结构示意图如图。以下说法正确的是( )
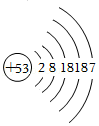

- A. 碘﹣127的核电荷数与碘﹣131的核电荷数不同
- B. 碘﹣127 原子与碘﹣131原子的相对原子质量相同
- C. 由碘元素组成的纯净物的化学式为I
- D. 碘元素的化学性质与氯元素的化学性质相似
7.下列化学方程式与叙述不相符的是( )
- A. NaOH+HCl═NaCl+H2O(该原理用于除去CO2中的HCl)
- B. CaCO3+H2O+CO2═Ca(HCO3)2(溶洞形成的原因)
- C. Ba(NO3)2+H2SO4═BaSO4↓+2HNO3(盐酸却不与Ba(NO3)2反应,说明没有体现酸的通性,是它们的酸根离子不同的原因)
- D. NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl(氨碱法制纯碱过程中先析出NaHCO3是因为相同条件下,NaHCO3的溶解度比NH4Cl更小)
8.下列实验目与实验设计方案相符的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 区分铁和天然矿石四氧化三铁 |  |
| B | 验证铁钉生锈需要氧气 |  |
| C | 干燥并且收集一瓶氢气 | 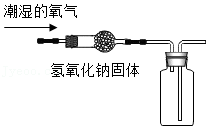 |
| D | 验证氢氧化钠与稀盐酸的中和反应是放热反应 | 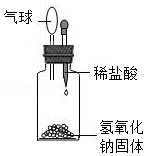 |
- A. A
- B. B
- C. C
- D. D
9.第二十四届冬季奥林匹克运动会于2022年2月在北京和张家口联合举行。此次冬奥会的理念之一是“绿色冬奥“。请运用所学知识回答以下问题:
(1)冬奥会火炬为“飞扬“,采用氢气作为燃料,氢气在空气中燃烧需要的条件是 ;氢气燃烧实现“零排放”的原因 (用化学方程式解释),将氢气存储在高压燃料罐中,此做法说明 (用微粒的知识解释);火炬外壳采用了自研的碳纤维增强陶瓷基复合材料,火炬外壳应具备的性质为 (填写一点即可)。
(2)冬奥速滑场馆“冰丝带“是通过对CO2施加一定高压后,二氧化碳会变成超临界状态的流体,这些流体通过不锈钢制冷管输送到冰面下的制冷管中,以达到降温制冷的目的。下列说法不正确的是 。
A.气态二氧化碳转变为超临界流体是一个吸收热量的过程
B.不锈钢制冷管属于金属材料
C.二氧化碳是大气污染物之一
D.二氧化碳在跨临界制冷循环过程中二氧化碳分子的构成发生了变化
(3)疫情防控是冬奥会重要的一部分。场馆用低温消毒剂C9H16Cl2N4进行消毒,该物质中氯、氮元素的质量比为 。
(4)冬奥会颁奖礼仪服内胆里添加了黑科技材料——石墨烯发热材料。石墨烯一层层叠起来就是石墨(C),厚1毫米的石墨大约包含300万层石墨烯。石墨烯的化学性质与石墨类似,石墨烯属于 (填“单质“、“混合物“、“化合物“),石墨烯完全燃烧的化学方程式为 。
(1)冬奥会火炬为“飞扬“,采用氢气作为燃料,氢气在空气中燃烧需要的条件是 ;氢气燃烧实现“零排放”的原因 (用化学方程式解释),将氢气存储在高压燃料罐中,此做法说明 (用微粒的知识解释);火炬外壳采用了自研的碳纤维增强陶瓷基复合材料,火炬外壳应具备的性质为 (填写一点即可)。
(2)冬奥速滑场馆“冰丝带“是通过对CO2施加一定高压后,二氧化碳会变成超临界状态的流体,这些流体通过不锈钢制冷管输送到冰面下的制冷管中,以达到降温制冷的目的。下列说法不正确的是 。
A.气态二氧化碳转变为超临界流体是一个吸收热量的过程
B.不锈钢制冷管属于金属材料
C.二氧化碳是大气污染物之一
D.二氧化碳在跨临界制冷循环过程中二氧化碳分子的构成发生了变化
(3)疫情防控是冬奥会重要的一部分。场馆用低温消毒剂C9H16Cl2N4进行消毒,该物质中氯、氮元素的质量比为 。
(4)冬奥会颁奖礼仪服内胆里添加了黑科技材料——石墨烯发热材料。石墨烯一层层叠起来就是石墨(C),厚1毫米的石墨大约包含300万层石墨烯。石墨烯的化学性质与石墨类似,石墨烯属于 (填“单质“、“混合物“、“化合物“),石墨烯完全燃烧的化学方程式为 。
10.用微粒的观点认识物质是学习化学的重要方法。
(1)原子结构模型是科学家根据自己的认识,对原子结构的形象描述。如图是人类发现和认识原子结构的历史过程:①为卢瑟福行星运转式原子模型;②汤姆生葡萄干面包式原子模型;③为道尔顿实心球式原子模型;④为玻尔轨道式原子模型。原子结构模型演变的顺序为 ;

(2)硅是自然界含量丰富的元素,硅与我们的生活密切相关,除电子产品的材料中含有硅外,建造房屋的水泥、日常使用的碗碟等,也都是由含硅物质制造出来的。硅是由 (填“分子”、“原子”或“离子”)构成的物质;硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源。与“氢能源”相比,“硅能源”具有 等更加优越的特点,从而得到全球的关注和期待。
(1)原子结构模型是科学家根据自己的认识,对原子结构的形象描述。如图是人类发现和认识原子结构的历史过程:①为卢瑟福行星运转式原子模型;②汤姆生葡萄干面包式原子模型;③为道尔顿实心球式原子模型;④为玻尔轨道式原子模型。原子结构模型演变的顺序为 ;

(2)硅是自然界含量丰富的元素,硅与我们的生活密切相关,除电子产品的材料中含有硅外,建造房屋的水泥、日常使用的碗碟等,也都是由含硅物质制造出来的。硅是由 (填“分子”、“原子”或“离子”)构成的物质;硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源。与“氢能源”相比,“硅能源”具有 等更加优越的特点,从而得到全球的关注和期待。
11.如图是依据物质类别和物质中某元素的化合价构建的物质间的转化关系(“→”表示物质间的转化,“—”表示物质之间相互反应),已知A~F是由氢、碳、氯、氧、钙、铁六种元素中的一种或几种元素组成的物质。完成下列问题:
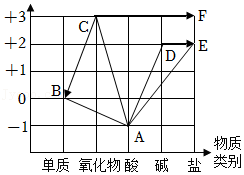
(1)D的名称是 ;
(2)A与E是实验室制取二氧化碳的反应原理,请写出化学方程式 ;
(3)C→B是工业炼铁的原理,请设计实验说明反应后的产物中含有物质B,实验方案是: 。

(1)D的名称是 ;
(2)A与E是实验室制取二氧化碳的反应原理,请写出化学方程式 ;
(3)C→B是工业炼铁的原理,请设计实验说明反应后的产物中含有物质B,实验方案是: 。
12.天蓝地绿水清的良好生态环境已成为最普惠的民生福祉。保护生态环境、人人有责。
(1)纽扣电池是生活中常用的电源,如图1是银锌纽扣电池的构造示意图,回答下列问题。
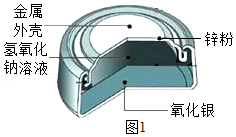
①回收废旧电池的重要意义是 ;
A.节约金属资源
B.增加金属产量
C.减少环境污染
②该电池中涉及铁、锌、银三种金属。三种金属的由强到弱的活动性顺序为 。为了验证它们的金属活动性强弱,甲同学取质量相同的铁片、锌片、银片,分别加入足量的相同浓度的稀盐酸中;乙同学另取铁片放入硝酸锌溶液中。结合他俩收集到的下列证据中,能得出三种金属活动性顺序的是 。
A.甲同学的实验中,银表面没有气泡产生
B.甲同学的实验中,放铁片的试管最终产生气泡的量比放锌片的试管产生的气泡多
C.乙同学的实验中,铁表面没有明显现象产生
(2)二氧化碳过多会引起温室效应。某纳米纤维化剂可将二氧化碳转化为液体燃料甲醇(CH3OH),其微观示意图如2所示(图中的微粒恰好完全反应)。
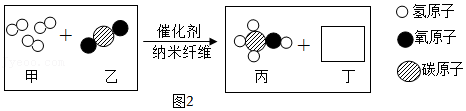
请根据图示写出丁物质的化学式 。
(1)纽扣电池是生活中常用的电源,如图1是银锌纽扣电池的构造示意图,回答下列问题。

①回收废旧电池的重要意义是 ;
A.节约金属资源
B.增加金属产量
C.减少环境污染
②该电池中涉及铁、锌、银三种金属。三种金属的由强到弱的活动性顺序为 。为了验证它们的金属活动性强弱,甲同学取质量相同的铁片、锌片、银片,分别加入足量的相同浓度的稀盐酸中;乙同学另取铁片放入硝酸锌溶液中。结合他俩收集到的下列证据中,能得出三种金属活动性顺序的是 。
A.甲同学的实验中,银表面没有气泡产生
B.甲同学的实验中,放铁片的试管最终产生气泡的量比放锌片的试管产生的气泡多
C.乙同学的实验中,铁表面没有明显现象产生
(2)二氧化碳过多会引起温室效应。某纳米纤维化剂可将二氧化碳转化为液体燃料甲醇(CH3OH),其微观示意图如2所示(图中的微粒恰好完全反应)。

请根据图示写出丁物质的化学式 。
13.铝是当前应用最广泛的金属材料之一,铝的化合物在日常生活和工农业生产中世有着重要的用途。请回答下列问题:
(1)某市有一座铝冶炼厂,它是以氧化铝为原料,在熔融状态下电解生成铝和一种常见的气体,反应的化学方程式为 ,电解熔融氧化铝的过程是由 能转化为 能。
(2)某实验小组探究铝与盐酸反应的反应速率与哪些因素有关。
资料:反应速率的大小会受温度和反应物浓度的影响。
①实验过程中观察到的实验现象是:“向打磨过的铝片加入盐酸,开始铝片表面出现少量气泡,接着气泡越来越多,然后看到溶液上方出现‘水雾’现象,甚至于使酸液‘沸腾’起来。”由此说明该反应是一个 热反应,反应的化学方程式为 。
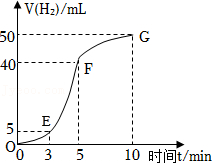
②实验结束后,课外兴趣小组成员将产生氢气的体积与时间关系作了如图所示。试判断OE、EF、FG这三段时间内产生氢气的速率大小,速率从大到小的顺序为 (用OE、EF、FG表示),产生这样速率大小的原因是 。
(1)某市有一座铝冶炼厂,它是以氧化铝为原料,在熔融状态下电解生成铝和一种常见的气体,反应的化学方程式为 ,电解熔融氧化铝的过程是由 能转化为 能。
(2)某实验小组探究铝与盐酸反应的反应速率与哪些因素有关。
资料:反应速率的大小会受温度和反应物浓度的影响。
①实验过程中观察到的实验现象是:“向打磨过的铝片加入盐酸,开始铝片表面出现少量气泡,接着气泡越来越多,然后看到溶液上方出现‘水雾’现象,甚至于使酸液‘沸腾’起来。”由此说明该反应是一个 热反应,反应的化学方程式为 。
②实验结束后,课外兴趣小组成员将产生氢气的体积与时间关系作了如图所示。试判断OE、EF、FG这三段时间内产生氢气的速率大小,速率从大到小的顺序为 (用OE、EF、FG表示),产生这样速率大小的原因是 。

14.硫酸镁通过抑制细胞对钙的吸收而使支气管平滑肌松弛,有助于危重哮喘时症状的缓解。工业上常用碳酸镁矿石(主要成分是难溶于水的碳酸镁,杂质不溶于水也不与酸反应)与稀硫酸反应来制备硫酸镁。以下是制备流程如图1及硫酸镁在不同温度时的溶解度图示。
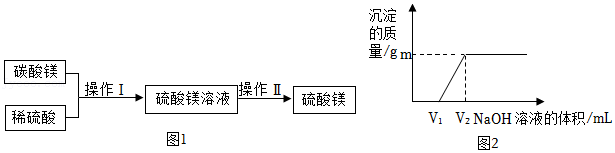
(1)操作Ⅰ的名称是 。
(2)小明模拟工业制备硫酸镁晶体,将碳酸镁矿石和稀硫酸充分反应后过滤,发现滤液中含有硫酸。为了测定所得滤液中硫酸镁和硫酸的质量比,他取少量滤液倒从烧杯,将溶质质量分数为10%的的氢氧化钠溶液逐渐加入,如图2所示,是随着氢氧化钠溶液的滴加产生沉淀质量的变化图示。除要知道氢氧化钠溶液的密度外,实验中还需要图中的哪两个数据 ,才可计算硫酸镁与硫酸的质量比?请写出V1→V2发生反应的化学方程式 。
(3)小明将除去杂质后的滤液加热至90℃,得到硫酸镁浓溶液,继续加热,观察到晶体快速析出。其原因可能是 。
(4)80℃时,饱和的硫酸镁溶液的溶质质量分数为 (列出计算式即可)。
| 温度(℃) | 60 | 80 | 90 | 100 |
| 硫酸镁溶解度(克) | 54.6 | 55.8 | 52.9 | 50.4 |

(1)操作Ⅰ的名称是 。
(2)小明模拟工业制备硫酸镁晶体,将碳酸镁矿石和稀硫酸充分反应后过滤,发现滤液中含有硫酸。为了测定所得滤液中硫酸镁和硫酸的质量比,他取少量滤液倒从烧杯,将溶质质量分数为10%的的氢氧化钠溶液逐渐加入,如图2所示,是随着氢氧化钠溶液的滴加产生沉淀质量的变化图示。除要知道氢氧化钠溶液的密度外,实验中还需要图中的哪两个数据 ,才可计算硫酸镁与硫酸的质量比?请写出V1→V2发生反应的化学方程式 。
(3)小明将除去杂质后的滤液加热至90℃,得到硫酸镁浓溶液,继续加热,观察到晶体快速析出。其原因可能是 。
(4)80℃时,饱和的硫酸镁溶液的溶质质量分数为 (列出计算式即可)。
15.胆矾(CuSO4•5H2O,相对分子质量为250)广泛应用于生产生活中。
(1)北宋《浸铜要略序》载“山麓又胆泉(硫酸铜溶液),土人汲以浸铁,数日辄类朽木,刮取其屑,锻炼成铜”请用方程式表示反应原理 。
(2)某实验小组将25g胆矾放在坩埚内加热,固体质量与成分随温度变化曲线如图1所示:
资料:氧化亚铜,化学式Cu2O,红色至红褐色结晶或粉末,不溶于水及有机溶剂,可溶于稀盐酸、稀硫酸等,在稀硫酸溶液中反应生成为二价铜和铜单质。
①加热至 ℃时,CuSO4开始分解。

实验小组的同学认为加热到1000℃以上固体产物中的物质可能是氧化铜和氧化亚铜的混合物。为了检验氧化亚铜中是否含有氧化铜,实验小组的同学展开了实验:
方案1:将反应后得到的Cu2O样品溶于足量稀硫酸。
②甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质。乙同学认为此推论不合理,原因是 ;甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质。
方案2:甲同学认为采用如2所示装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d(碱石灰)装置反应前后增重的质量(若氧化亚铜中混有氧化铜,则生成的水的质量不同),可计算,从而确定样品中是否含有氧化铜。
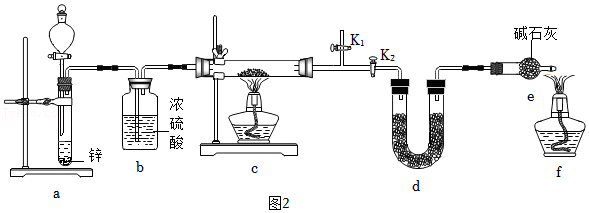
③为了使进入c装置中的气体是纯净干燥的氢气,则装置a中所加的酸是 (填化学式),装置e中碱石灰的作用是 。
④点燃装置c中酒精灯之前需进行的具体操作是 (提示:涉及到K1、K2的操作)。
⑤熄灭酒精灯c之后,仍需通一段时间H2至试管冷却,原因是 。
⑥加热至1000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,该气体是 ,若CuO完全分解时产生该气体的质量是多少? (请写出计算过程)
(1)北宋《浸铜要略序》载“山麓又胆泉(硫酸铜溶液),土人汲以浸铁,数日辄类朽木,刮取其屑,锻炼成铜”请用方程式表示反应原理 。
(2)某实验小组将25g胆矾放在坩埚内加热,固体质量与成分随温度变化曲线如图1所示:
资料:氧化亚铜,化学式Cu2O,红色至红褐色结晶或粉末,不溶于水及有机溶剂,可溶于稀盐酸、稀硫酸等,在稀硫酸溶液中反应生成为二价铜和铜单质。
①加热至 ℃时,CuSO4开始分解。

实验小组的同学认为加热到1000℃以上固体产物中的物质可能是氧化铜和氧化亚铜的混合物。为了检验氧化亚铜中是否含有氧化铜,实验小组的同学展开了实验:
方案1:将反应后得到的Cu2O样品溶于足量稀硫酸。
②甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质。乙同学认为此推论不合理,原因是 ;甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质。
方案2:甲同学认为采用如2所示装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d(碱石灰)装置反应前后增重的质量(若氧化亚铜中混有氧化铜,则生成的水的质量不同),可计算,从而确定样品中是否含有氧化铜。

③为了使进入c装置中的气体是纯净干燥的氢气,则装置a中所加的酸是 (填化学式),装置e中碱石灰的作用是 。
④点燃装置c中酒精灯之前需进行的具体操作是 (提示:涉及到K1、K2的操作)。
⑤熄灭酒精灯c之后,仍需通一段时间H2至试管冷却,原因是 。
⑥加热至1000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,该气体是 ,若CuO完全分解时产生该气体的质量是多少? (请写出计算过程)
查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解