下载高清试卷
【2021年福建省宁德市中考化学适应性试卷】-第1页
试卷格式:2021年福建省宁德市中考化学适应性试卷.PDF
试卷热词:最新试卷、2021年、福建试卷、宁德市试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷

扫码查看解析
试卷题目
1.下列变化过程不涉及化学反应的是( )
- A. 夏天从海水中晒盐
- B. 从含SiO2的沙子中提炼高纯Si
- C. 司母戊鼎表面出现铜绿
- D. O3在紫外线作用下转化为O2
2.“性质决定用途,用途体现性质”。下列物质的用途主要体现其物理性质的是( )
- A. 焦炭用于炼铁
- B. 液氮用作制冷剂
- C. 甲烷用作燃料
- D. 氧气用于医疗急救
3.化学与生活息息相关。下列做法你认为恰当的是( )
- A. 为延长食品保质期,在食品中添加大量防腐剂
- B. 为节约粮食,将霉变的大米煮熟后食用
- C. 为使发面食品松软可口,可添加适量碳酸氢钠
- D. 大量使用农药化肥以提高农作物产量
4.化学用语是学习化学的重要工具,下列化学用语书写正确的是( )
- A. 两个氧分子﹣﹣2O
- B. 钙离子﹣﹣Ca+2
- C. 3个亚铁离子﹣﹣3Fe3+
- D. 溴化钠﹣﹣NaBr
5.下列关于燃烧与灭火的说法正确的是( )
- A. 柴油发动机通过喷油嘴将柴油气化进入汽缸,是为了增大与空气的接触面积
- B. 为解决“白色污染”问题,应将废旧塑料袋焚烧处理
- C. 室内失火,立即打开门窗排出浓烟
- D. 地铁的自动喷淋系统,喷水灭火原因主要是水蒸发吸热,使着火点降低
6.如图是甲在乙中燃烧前后分子种类变化的微观示意图,下列叙述正确的是( )
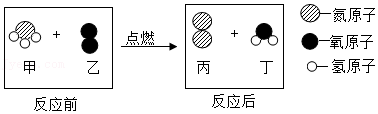

- A. 反应后原子的数目减少
- B. 甲与乙反应的质量比是17:32
- C. 丙、丁的分子个数比是2:3
- D. 该反应属于置换反应
7.宏观辨识与微观探析是化学学科的核心素养之一。下列对宏观事实的微观解释正确的是( )
| 选项 | 宏观事实 | 微观解释 |
| A | 氧气经压缩可以储存在钢瓶中 | 压强增大,分子运动速率增大 |
| B | 一氧化碳和二氧化碳化学性质不同 | 分子构成不同 |
| C | 氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质 | 两种溶液中都含有氢元素和氧元素 |
| D | 水电解生成氢气和氧气 | 水由氢分子和氧分子构成 |
- A. A
- B. B
- C. C
- D. D
8.下列处理方法利用了中和反应原理的是( )
- A. 用硫酸处理工业废水中的碱
- B. 用纯碱除去面团发酵时产生的酸
- C. 用稀盐酸除去铁钉表面的铁锈
- D. 用纯碱和熟石灰制取烧碱
9.化学就在我们身边,人类的生活离不开化学。

(1)图1中用消石灰画跑道,消石灰的化学式为 。
(2)图2是某运动衫标签,由面料成分可知该运动衫具有的优点是 (写一条即可)。
(3)图3是发令枪在发令时产生大量白烟,发令枪中“火药”的主要成分可能是 。
(4)疫情防控中,各级政府部门宣布了“口罩令”,要求大家出入公共场所必须戴口罩,图4是一款医用口罩。根据图中信息回答下列问题。
①口罩的制作材料中,属于有机合成材料的是 (填序号);
②轻压铝制鼻条可使其贴合面部,铝能制成细丝,利用了铝的 性;
③使用过的废弃口罩应投放进的垃圾桶为 (填字母)。

(1)图1中用消石灰画跑道,消石灰的化学式为 。
(2)图2是某运动衫标签,由面料成分可知该运动衫具有的优点是 (写一条即可)。
(3)图3是发令枪在发令时产生大量白烟,发令枪中“火药”的主要成分可能是 。
(4)疫情防控中,各级政府部门宣布了“口罩令”,要求大家出入公共场所必须戴口罩,图4是一款医用口罩。根据图中信息回答下列问题。
①口罩的制作材料中,属于有机合成材料的是 (填序号);
②轻压铝制鼻条可使其贴合面部,铝能制成细丝,利用了铝的 性;
③使用过的废弃口罩应投放进的垃圾桶为 (填字母)。

10.“宏观辨识与微观探析”是化学学科的核心素养之一。在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
(1)如图1是两个微粒的结构模型示意图,这两个微粒是否属于同种元素? (填“是”或“否”),依据是 。
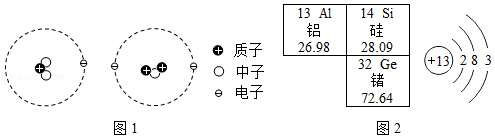
(2)如图2是元素周期表的部分内容和铝原子结构示意图,据图回答下列问题:
①下列说法正确的有 (填字母)。
A.表中元素都是金属元素
B.铝的相对原子质量是26.98g
C.铝原子在化学反应中易失去电子变成Al3+
D.锗原子中质子数等于中子数
E.铝原子最外层3个电子能量最高
②图2中空白处元素原子的质子数为 ;小明根据元素周期表预测该元素组成的单质R与铝有相似的化学性质,他的依据应是 。
③若要比较R与Al的活动性强弱,实验方案为 。
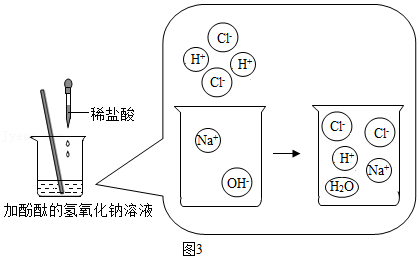
(3)根据氢氧化钠溶液和稀盐酸反应的微观示意图,回答问题:反应中,数目减少的离子是 (填符号);验证反应后溶液中稀盐酸有剩余,下列操作可行的是 (填字母)。
A.取样,加入CuO粉末
B.取样,滴加NaOH溶液
C.取样,加入CaCO3粉末
D.取样,滴加AgNO3溶液
(1)如图1是两个微粒的结构模型示意图,这两个微粒是否属于同种元素? (填“是”或“否”),依据是 。

(2)如图2是元素周期表的部分内容和铝原子结构示意图,据图回答下列问题:
①下列说法正确的有 (填字母)。
A.表中元素都是金属元素
B.铝的相对原子质量是26.98g
C.铝原子在化学反应中易失去电子变成Al3+
D.锗原子中质子数等于中子数
E.铝原子最外层3个电子能量最高
②图2中空白处元素原子的质子数为 ;小明根据元素周期表预测该元素组成的单质R与铝有相似的化学性质,他的依据应是 。
③若要比较R与Al的活动性强弱,实验方案为 。
(3)根据氢氧化钠溶液和稀盐酸反应的微观示意图,回答问题:反应中,数目减少的离子是 (填符号);验证反应后溶液中稀盐酸有剩余,下列操作可行的是 (填字母)。
A.取样,加入CuO粉末
B.取样,滴加NaOH溶液
C.取样,加入CaCO3粉末
D.取样,滴加AgNO3溶液

11.在很长的一段时期内,水曾经被看作是一种“元素”。直到18世纪末,人们通过对水的生成和分解实验的研究,才最终认识了水的组成。
(1)如图是电解水实验,a管连接电源的 (填“正”或“负”)极;正负两极产生气体的质量比为 。
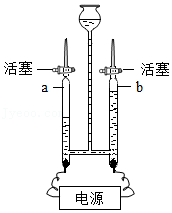
(2)氢气是一种清洁的新能源,燃烧过程中将 能转化为热能;请再列举一种新能源 。
(3)若某工厂需要6.4kg氧气作为原料。若用电解水的方法制取这些氧气,请根据化学方程式计算,消耗水的质量是多少?(写出完整的计算过程)
(1)如图是电解水实验,a管连接电源的 (填“正”或“负”)极;正负两极产生气体的质量比为 。

(2)氢气是一种清洁的新能源,燃烧过程中将 能转化为热能;请再列举一种新能源 。
(3)若某工厂需要6.4kg氧气作为原料。若用电解水的方法制取这些氧气,请根据化学方程式计算,消耗水的质量是多少?(写出完整的计算过程)
12.根据如图所示,回答问题:
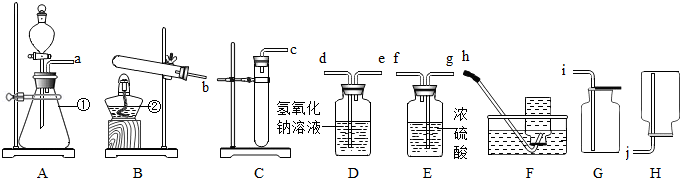
(1)写出图中标号的仪器名称:① 。
(2)实验室欲用B装置制取氧气,反应的化学方程式为 。
(3)已知过氧化钠(Na2O2)是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气,该反应的化学方程式为 。如果在实验室中用A装置作气体发生装置,用过氧化钠和水反应来制取一瓶干燥的氧气,所选装置的正确连接顺序是(填写管口字母)a→ → → 。
(4)若改变A装置中的药品,还可以用来在实验室制取二氧化碳,该反应的化学方程式是 。
(5)通过上述两种制取氧气的方法所选用发生装置的对比,你觉得选择气体发生装置应考虑的因素是 。

(1)写出图中标号的仪器名称:① 。
(2)实验室欲用B装置制取氧气,反应的化学方程式为 。
(3)已知过氧化钠(Na2O2)是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气,该反应的化学方程式为 。如果在实验室中用A装置作气体发生装置,用过氧化钠和水反应来制取一瓶干燥的氧气,所选装置的正确连接顺序是(填写管口字母)a→ → → 。
(4)若改变A装置中的药品,还可以用来在实验室制取二氧化碳,该反应的化学方程式是 。
(5)通过上述两种制取氧气的方法所选用发生装置的对比,你觉得选择气体发生装置应考虑的因素是 。
13.CuCl2是一种广泛用于生产颜料、木材防腐剂等的化工产品。工业上以辉铜矿(主要含有Cu2S、Fe2O3及一些不溶性杂质)为原料制备CuCl2•2H2O晶体的工艺流程如图1:
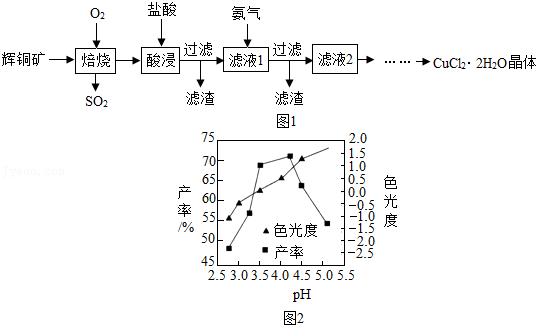
请回答下列问题:
(1)为加快反应速率,以下措施能达到目的的是 。
A.延长酸浸时间
B.将辉铜矿粉碎
C.适当增加盐酸浓度
D.适当提高酸液温度
(2)“酸浸”时发生的化学方程式为 (写出一种即可),加入氨水的作用是①调节pH,中和过量盐酸,② 。
(3)欲获得CuCl2•2H2O晶体具体操作是蒸发浓缩、冷却结晶、 、洗涤、烘干。
(4)色光度是产品质量指标之一,合格CuCl2•2H2O晶体的色光度范围为﹣0.5~0.5,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是 。

请回答下列问题:
(1)为加快反应速率,以下措施能达到目的的是 。
A.延长酸浸时间
B.将辉铜矿粉碎
C.适当增加盐酸浓度
D.适当提高酸液温度
(2)“酸浸”时发生的化学方程式为 (写出一种即可),加入氨水的作用是①调节pH,中和过量盐酸,② 。
(3)欲获得CuCl2•2H2O晶体具体操作是蒸发浓缩、冷却结晶、 、洗涤、烘干。
(4)色光度是产品质量指标之一,合格CuCl2•2H2O晶体的色光度范围为﹣0.5~0.5,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是 。
14.某同学在归纳梳理物质间关系时,应用如图所示的七巧板分别代表初中化学常见的七种纯净物,拼搭出行走的人形图案。拼图中相连物质间可发生化学反应,A是水垢中含有的难溶碱,化合物B不含氧元素,C、G是黑色固体单质,D、F是农药波尔多液的主要成分。请回答下列问题:(部分反应物、生成物和反应条件未标出)

(1)D物质的化学式是 ;E的用途为 (任写一种)。
(2)写出B与C反应的化学方程式 。
(3)当A和B恰好完全反应时,溶液中的溶质是 (写化学式)。
(4)图中7种物质间的反应,共涉及 种基本反应类型。

(1)D物质的化学式是 ;E的用途为 (任写一种)。
(2)写出B与C反应的化学方程式 。
(3)当A和B恰好完全反应时,溶液中的溶质是 (写化学式)。
(4)图中7种物质间的反应,共涉及 种基本反应类型。
15.长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气。
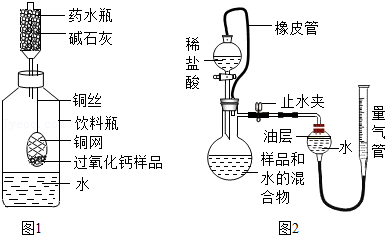
过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
【猜想】另一生成物为氢氧化钙。
(1)【进行试验】取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞试液,液体变成红色,猜想成立。写出该反应的化学方程式 。
(2)【意外发现】较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,你认为褪色的可能原因是 。
【查阅资料】过氧化钙放置在空气中,会变质产生氢氧化钙和碳酸钙两种杂质。
实验探究二:测定久置过氧化钙纯度
【实验过程】
称量144g样品放在铜网中,按图1装置组装后(药水瓶底部留有小孔),称量仪器及药品总质量,将铜网插入足量水中,反应完全后称量仪器及反应后物质总质量。测得实验数据如下表。
【问题讨论】
(3)药水瓶中碱石灰的作用为 。
(4)根据实验数据计算:样品中过氧化钙的含量是 g。
(5)本实验测得过氧化钙含量可能会偏小的原因是 。
实验探究三:测定久置过氧化钙样品中碳酸钙含量
【测定方案】
①如图2所示,连接好装置,检查装置气密性合格;
②称量mg样品置于烧杯中,加入适量水混合,完全反应后全部倒入如图所示的烧瓶中,向分液漏斗中加入足量稀盐酸待用;
③将量气管液面调节到“0”刻度,并使量气管内液面与油层相平,打开止水夹和分液漏斗活塞;
④反应结束后,再次调节量气管内液面与油层液面相平,读出气体体积;
⑤查得CO2的密度,计算样品中碳酸钙的质量分数。
(6)图中分液漏斗上端橡皮管和烧瓶相连的作用为 ;图中油层的作用为 ,油层上方留有空气,会使测量结果 (填“偏大”、“偏小”或“不受影响”)。滴加稀盐酸后,发生装置里发生的中和反应的化学方程式为 ,这个反应的发生可能使测定结果 (填“偏大”、“偏小”或“不受影响”)。
(7)反应结束后,测得量气管读数为amL,根据该条件下CO2的密度得知生成CO2的密度是bg/mL。求样品中碳酸钙的质量分数。

过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
【猜想】另一生成物为氢氧化钙。
(1)【进行试验】取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞试液,液体变成红色,猜想成立。写出该反应的化学方程式 。
(2)【意外发现】较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,你认为褪色的可能原因是 。
【查阅资料】过氧化钙放置在空气中,会变质产生氢氧化钙和碳酸钙两种杂质。
实验探究二:测定久置过氧化钙纯度
【实验过程】
称量144g样品放在铜网中,按图1装置组装后(药水瓶底部留有小孔),称量仪器及药品总质量,将铜网插入足量水中,反应完全后称量仪器及反应后物质总质量。测得实验数据如下表。
| 样品质量 | 装置及药品总质量 | 装置及反应后物质总质量 | |
| 实验数据 | 144g | 394g | 378g |
【问题讨论】
(3)药水瓶中碱石灰的作用为 。
(4)根据实验数据计算:样品中过氧化钙的含量是 g。
(5)本实验测得过氧化钙含量可能会偏小的原因是 。
实验探究三:测定久置过氧化钙样品中碳酸钙含量
【测定方案】
①如图2所示,连接好装置,检查装置气密性合格;
②称量mg样品置于烧杯中,加入适量水混合,完全反应后全部倒入如图所示的烧瓶中,向分液漏斗中加入足量稀盐酸待用;
③将量气管液面调节到“0”刻度,并使量气管内液面与油层相平,打开止水夹和分液漏斗活塞;
④反应结束后,再次调节量气管内液面与油层液面相平,读出气体体积;
⑤查得CO2的密度,计算样品中碳酸钙的质量分数。
(6)图中分液漏斗上端橡皮管和烧瓶相连的作用为 ;图中油层的作用为 ,油层上方留有空气,会使测量结果 (填“偏大”、“偏小”或“不受影响”)。滴加稀盐酸后,发生装置里发生的中和反应的化学方程式为 ,这个反应的发生可能使测定结果 (填“偏大”、“偏小”或“不受影响”)。
(7)反应结束后,测得量气管读数为amL,根据该条件下CO2的密度得知生成CO2的密度是bg/mL。求样品中碳酸钙的质量分数。
查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解