下载高清试卷
【2022年江苏省扬州市江都区中考化学一模试卷】-第1页
试卷格式:2022年江苏省扬州市江都区中考化学一模试卷.PDF
试卷热词:最新试卷、2022年、江苏试卷、扬州市试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷

扫码查看解析
试卷题目
1.下列是防控“新冠肺炎”的“三字经”,其中涉及化学变化的是( )
- A. 戴口罩
- B. 测体温
- C. 勤消毒
- D. 常通风
2.下列物质由离子构成的是( )
- A. 硅
- B. 氮气
- C. 过氧化氢
- D. 氯化钠
3.《梦溪笔谈》记载“熬胆矾铁釜久亦化为铜”,胆矾为CuSO4 晶体,CuSO4 属于( )
- A. 酸
- B. 碱
- C. 盐
- D. 氧化物
4.人体中含有多种元素,下列属于人体常量元素的是( )
- A. Fe
- B. Mn
- C. Ca
- D. Zn
5.铜可以制成电线,主要说明铜具有良好的( )
- A. 导热性
- B. 导电性
- C. 延展性
- D. 抗腐蚀性
6.下列物质对应组成不正确的是( )
- A. 生石灰:Ca(OH)2
- B. 苏打:Na2CO3
- C. 干冰:CO2
- D. 水银:Hg
7.2022 年2 月第24 届冬奥会在北京和张家口联合举行。
绿色冬奥,下列做法不符合低碳节能减排理念的是( )
绿色冬奥,下列做法不符合低碳节能减排理念的是( )
- A. 场馆更多使用太阳能
- B. 提高场地造雪制冰效率
- C. 汽车更多使用氢燃料
- D. 休息室用电热油灯供暖
8.2022 年2 月第24 届冬奥会在北京和张家口联合举行。人文冬奥,反对运动员使用违禁药品乙基雌烯醇(C20H32O)是一种违禁药品,下列有关乙基雌烯醇的说法正确的是( )
- A. 乙基雌烯醇相对分子质量为12×20+1×32+16×1
- B. 乙基雌烯醇中有20 个碳原子、32 个氢原子、1 个氧原子
- C. 乙基雌烯醇是有机高分子化合物
- D. 乙基雌烯醇中碳元素、氢元素、氧元素的质量比为20:32:1
9.2022 年2 月第24 届冬奥会在北京和张家口联合举行。“飞扬”冬奥,火炬采用的燃料是氢燃料,不是传统燃料丙烷,丙烷(X)完全燃烧的化学方程式为:X+5O2
3CO2+4H2O,丙烷(X)的化学式为( )
| 点燃 |
- A. C3H4
- B. C3H8O
- C. C3H8
- D. C3H6O2
10.“84”消毒液是常用的家用消毒剂,使用时需加水稀释,常用1:500(“84”原液与水的体积比)比例进行稀释,现有10mL“84”原液,应加水的体积是( )
- A. 100mL
- B. 200mL
- C. 500mL
- D. 5000mL
11.人体中部分液体pH 范围如下,其中碱性最强的是( )
- A. 胰液 7.8~8.4
- B. 胃液 0.9~1.5
- C. 血液 7.35~7.45
- D. 唾液 6.6~7.1
12.下列化学方程式正确的是( )
- A. H2O2═2H2↑+O2↑
- B. Fe+CuSO4═FeSO4+Cu
- C. Fe+O2Fe3O4
点燃 - D. NaCO3+2HCl═2NaCl+H2O+CO2↑
13.塑料回收意义重大,如图属于物品回收标志的是( )
- A.

- B.

- C.

- D.

14.科学家设计了某反应的模型,其装置和反应的微观示意图如图所示下列说法错误的是( )
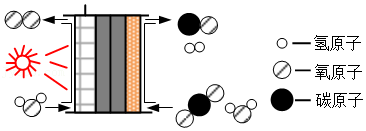

- A. 反应物的分子个数比为1:2
- B. 反应前后原子种类不变
- C. 该过程实现了太阳能向化学能的转化
- D. 反应前后催化剂的化学性质不变
15.某兴趣小组研究氧化铜和铜的固体混合物,现取18g该混合物于烧杯中,将125g稀硫酸平分5次加入到烧杯中,充分反应,记录相关数据如表所示:
下列说法错误的是( )
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入稀硫酸的质量/g | 25 | 25 | 25 | 25 | 25 |
| 剩余固体的质量/g | 16 | a | 12 | 10.8 | 10.8 |
下列说法错误的是( )
- A. a=14
- B. 第四次实验后稀硫酸无剩余
- C. 稀硫酸中硫酸的质量分数是9.8%
- D. 固体混合物中氧化铜的质量分数40%
16.下列有关物质的性质和用途,有对应关系的是( )
- A. 氮气化学性质稳定,可用于医疗手术
- B. 武德合金熔点低,可用作保险丝
- C. 浓硫酸具有脱水性,可用作干燥剂
- D. 二氧化碳能与水反应,可用于灭火
17.某同学用月季花自制酸碱指示剂,并用于检验白醋的酸碱性,部分操作如下,其中错误的是( )
- A.
 研磨花瓣
研磨花瓣 - B.
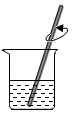 浸取色素
浸取色素 - C.
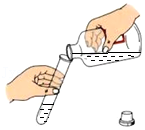 取用白醋
取用白醋 - D.
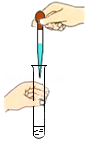 检验白醋
检验白醋
18.利用传统的海水晒盐工艺,可得到氯化钠和氯化镁等物质如图是氯化钠和氯化镁的溶解度曲线下列说法错误的是( )
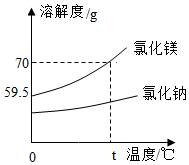

- A. t℃时,氯化镁的溶解度为70g
- B. 升温能使氯化镁溶液从不饱和变为饱和
- C. 将t℃氯化镁的饱和溶液降温至0℃,有晶体析出
- D. 海水晒盐是利用蒸发溶剂的方法获得晶体
19.如表实验操作和现象,得到的结论错误的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向固体中加入稀盐酸,出现气泡 | 该固体可能是碳酸盐 |
| B | 向土豆片上滴加碘酒,出现变蓝现象 | 土豆片中含有淀粉 |
| C | 称取5g 蔗糖,完全溶解在100mL水中 | 配制的蔗糖溶液溶质质量分数为5% |
| D | 将铝片和硬铝相互刻画,铝片上出现划痕 | 硬铝的硬度大于铝 |
- A. A
- B. B
- C. C
- D. D
20.新型环保纳米材料MFe2Ox(M 表示某+2 价的金属元素)能使工业废气中的SO2 转化为S,并由反应Ⅱ再生,原理如图所示,下列说法不正确的是( )
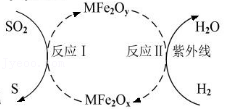

- A. 反应过程中,S、Fe、H的化合价都发生了改变
- B. 该方法处理SO2能有效防止酸雨的形成
- C. Fe元素的含量:MFe2Ox<MFe2Oy
- D. 理论上,每消除64g的SO2,需要提供4g的氢气
21.无人驾驶飞机简称“无人机”,可应用于航拍、农业、植保、灾难救援、监控传染病、测绘等领域世界海关组织协调制度委员会将其归类为“会飞的照相机”。
(1)制造无人机使用的材料有玻璃钢、塑料、铝合金等
①玻璃钢属于 (填字母)。
A.合成材料
B.复合材料
C.无机材料
②自然条件下铝比铁具有更好的抗腐蚀性能,原因是 (用化学方程式表示)。
③制作无人机螺旋桨的材料具有的优良性能是 (填字母)。
A.熔点低、易加工
B.密度大、可塑性好
C.强度高、耐腐蚀
(2)无人机用锂电池作为能量来源锂原子的结构示意图如图,则锂离子的化学符号是 。

(3)无人机数码成像原理是物体光线从透镜打在感光元件上,感光元件将光信号转化成电信号,记录在储存卡里或通过无线信号进行传输传统照相机一般使用溴化银AgBr 见光分解为银和Br2 来记录影像,该反应的化学方程式是 。
(4)无人机喷洒的“84 消毒液”(有效成分的化学式为NaClO)能有效杀灭病毒,NaClO 中氯元素化合价为 。
(5)无人机拍摄到很多热心民众为志愿者免费提供食物:面包、牛奶、鸡肉卷、苹果等牛奶中富含蛋白质,在人体内水解为 。苹果中所含的人体所需营养素除了糖类外,还有较丰富的 (填字母)。
A.蛋白质
B.油脂
C.维生素
(6)无人机向居家隔离的民众快递口罩医用口罩的过滤效率与纤维直径的关系如图﹣3所示,则纤维直径与过滤效果的大致关系是 。

(1)制造无人机使用的材料有玻璃钢、塑料、铝合金等
①玻璃钢属于 (填字母)。
A.合成材料
B.复合材料
C.无机材料
②自然条件下铝比铁具有更好的抗腐蚀性能,原因是 (用化学方程式表示)。
③制作无人机螺旋桨的材料具有的优良性能是 (填字母)。
A.熔点低、易加工
B.密度大、可塑性好
C.强度高、耐腐蚀
(2)无人机用锂电池作为能量来源锂原子的结构示意图如图,则锂离子的化学符号是 。

(3)无人机数码成像原理是物体光线从透镜打在感光元件上,感光元件将光信号转化成电信号,记录在储存卡里或通过无线信号进行传输传统照相机一般使用溴化银AgBr 见光分解为银和Br2 来记录影像,该反应的化学方程式是 。
(4)无人机喷洒的“84 消毒液”(有效成分的化学式为NaClO)能有效杀灭病毒,NaClO 中氯元素化合价为 。
(5)无人机拍摄到很多热心民众为志愿者免费提供食物:面包、牛奶、鸡肉卷、苹果等牛奶中富含蛋白质,在人体内水解为 。苹果中所含的人体所需营养素除了糖类外,还有较丰富的 (填字母)。
A.蛋白质
B.油脂
C.维生素
(6)无人机向居家隔离的民众快递口罩医用口罩的过滤效率与纤维直径的关系如图﹣3所示,则纤维直径与过滤效果的大致关系是 。

22.水是生命之源,是人类宝贵的自然资源。
Ⅰ水的组成:
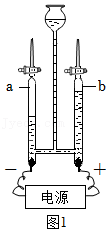
(1)用如图1装置通电一段时间后,b 中所收集的气体为 (填名称),化学方程式为 。
(2)下列还能确认水是由氢、氧元素组成的实验是 (填序号)。
A.氢气在氧气中燃烧
B.水的蒸发
C.氢气和氧化铜反应生成铜和水
D.氢气在氯气中燃烧
Ⅱ水的净化:利用如图2流程来净化
(3)测定天然水的酸碱度常用 。
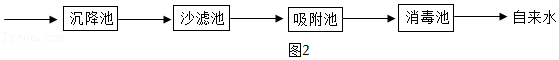
(4)沉降池中加入混凝剂(如明矾),其作用是 。
(5)吸附池中常选用 除去水中色素和异味。
Ⅲ.水的硬度比较:用四种水样完成实验,记录观察到泡沫产生时所需肥皂水的用量(已知:硬水中加肥皂水泡沫少,软水中加肥皂水泡沫多)
(6)硬度最大的水样是 。
(7)由实验可知,能将自来水硬度降低的方法有 。
(8)继续实验,发现山泉水的硬度大于自来水的硬度,其实验方案为 。
Ⅰ水的组成:

(1)用如图1装置通电一段时间后,b 中所收集的气体为 (填名称),化学方程式为 。
(2)下列还能确认水是由氢、氧元素组成的实验是 (填序号)。
A.氢气在氧气中燃烧
B.水的蒸发
C.氢气和氧化铜反应生成铜和水
D.氢气在氯气中燃烧
Ⅱ水的净化:利用如图2流程来净化
(3)测定天然水的酸碱度常用 。

(4)沉降池中加入混凝剂(如明矾),其作用是 。
(5)吸附池中常选用 除去水中色素和异味。
Ⅲ.水的硬度比较:用四种水样完成实验,记录观察到泡沫产生时所需肥皂水的用量(已知:硬水中加肥皂水泡沫少,软水中加肥皂水泡沫多)
| 实验操作 | 水样 | 肥皂水用量/滴 |
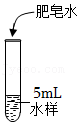 | 市售纯净水 | 2 |
| 煮沸后的自来水 | 6 | |
| 自来水 | 9 | |
| 湖水 | 14 |
(6)硬度最大的水样是 。
(7)由实验可知,能将自来水硬度降低的方法有 。
(8)继续实验,发现山泉水的硬度大于自来水的硬度,其实验方案为 。
23.我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当“碳中和”即通过植树造林、节能减排等形式,抵消自身产生的CO2排放,实现CO2“零排放”。
(1)“碳”排放:化石燃料燃烧是CO2排放的主要因素,化石燃料主要包括煤、 和天然气,它们都是 (填“可再生”或“不可再生”)能源,室温下,充分燃烧1g天然气和1g煤,产生的CO2及热量的对比如图﹣1所示据如图分析,与煤相比,用天然气作燃料的优点有 。
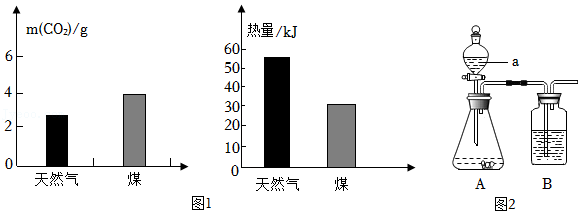
(2)“碳”吸收:自然界有多种途径吸收CO2,绿色植物通过 吸收CO2,风化的岩石如CaCO3粉末可吸收空气中的CO2和H2O转化为Ca(HCO3)2,反应的化学方程式为 。
(3)“碳”捕捉:利用NaOH捕捉CO2化学方程式为 。
(4)“碳”利用:将CO2作为资源是实现碳中和的有效方法,CO2和H2在一定条件反应生成C2H5OH和H2O,参加反应的CO2和H2的质量比为 。
(5)“碳”制取:用图2装置探究石灰石制取较为纯净CO2的实验。
①仪器名称:a 。
②实验室制取CO2的化学方程式为 ,A装置制取气体的优点是 。
③装置B中盛放的是饱和碳酸氢钠溶液,其作用是 。
(1)“碳”排放:化石燃料燃烧是CO2排放的主要因素,化石燃料主要包括煤、 和天然气,它们都是 (填“可再生”或“不可再生”)能源,室温下,充分燃烧1g天然气和1g煤,产生的CO2及热量的对比如图﹣1所示据如图分析,与煤相比,用天然气作燃料的优点有 。

(2)“碳”吸收:自然界有多种途径吸收CO2,绿色植物通过 吸收CO2,风化的岩石如CaCO3粉末可吸收空气中的CO2和H2O转化为Ca(HCO3)2,反应的化学方程式为 。
(3)“碳”捕捉:利用NaOH捕捉CO2化学方程式为 。
(4)“碳”利用:将CO2作为资源是实现碳中和的有效方法,CO2和H2在一定条件反应生成C2H5OH和H2O,参加反应的CO2和H2的质量比为 。
(5)“碳”制取:用图2装置探究石灰石制取较为纯净CO2的实验。
①仪器名称:a 。
②实验室制取CO2的化学方程式为 ,A装置制取气体的优点是 。
③装置B中盛放的是饱和碳酸氢钠溶液,其作用是 。
24.某兴趣小组利用废镍材料(含有金属Ni及少量Fe、Ag、Fe2O3)探究相关物质的性质并回收镍,设计流程如图所示稀H2SO4、H2O2溶液NaOH溶液适量铁粉。
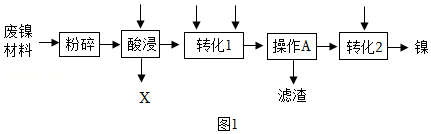
资料:a.H2O2溶液可将Fe2+转化为Fe3+;b.Fe2+、Fe3+、Ni2+转化为对应的氢氧化物沉淀时,溶液pH有如图关系:

(1)废镍材料“粉碎”的目的是 。
(2)“酸浸”中发生的反应化学方程式除Fe+H2SO4=FeSO4+H2↑、Ni+H2SO4=NiSO4+H2↑、还有 ,该反应属于 反应(填基本反应类型);X是 (填名称)。
(3)在“转化1”中,加入试剂先后顺序是 (填字母)。
A.先加H2O2溶液,再加NaOH溶液
B.先加NaOH溶液,再加H2O2溶液
(4)在“转化1”中,加NaOH溶液调节pH为 (填范围)操作A是 ,该操作中所用到的玻璃仪器有玻璃棒、烧杯和 。
(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为 。

资料:a.H2O2溶液可将Fe2+转化为Fe3+;b.Fe2+、Fe3+、Ni2+转化为对应的氢氧化物沉淀时,溶液pH有如图关系:

(1)废镍材料“粉碎”的目的是 。
(2)“酸浸”中发生的反应化学方程式除Fe+H2SO4=FeSO4+H2↑、Ni+H2SO4=NiSO4+H2↑、还有 ,该反应属于 反应(填基本反应类型);X是 (填名称)。
(3)在“转化1”中,加入试剂先后顺序是 (填字母)。
A.先加H2O2溶液,再加NaOH溶液
B.先加NaOH溶液,再加H2O2溶液
(4)在“转化1”中,加NaOH溶液调节pH为 (填范围)操作A是 ,该操作中所用到的玻璃仪器有玻璃棒、烧杯和 。
(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为 。
25.学习小组在进行镁带与酸反应的实验时,发现足量镁带与稀盐酸反应后出现了灰白色沉淀,而与稀硫酸反应后,未有此现象,化学小组对这一异常现象开展探究。
【探究一】:探究灰白色沉淀中是否含有过量的镁或反应生成的氯化镁。
(1)①取灰白色固体样品,加入 ,无气泡产生,灰白色固体不含镁。
②取等质量的灰白色固体和MgCl2晶体分别放入同温、等量水中,灰白色固体不溶解而MgCl2晶体全部 ,灰白色固体不含MgCl2。
【探究二】:探究灰白色固体产生的原因。
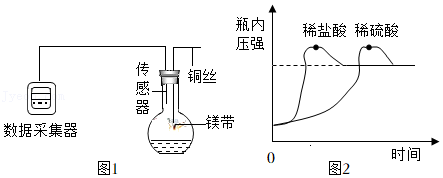
用如图1所示装置(平底烧瓶已固定)分别进行镁带与稀盐酸、稀硫酸反应的实验,其中镁带与稀盐酸反应的实验现象如表所示。
足量镁带和稀盐酸反应的实验现象:
(2)实验时,使镁条与稀盐酸、稀硫酸反应的操作是 。
(3)根据实验现象推测:①产生灰白色沉淀需 (填“酸性”、“碱性”或“中性”)条件;②灰白色沉淀产生和 (填离子符号)有关。
(4)为证实灰白色沉淀中含有Cl﹣,小赵同学设计了如下实验:过滤,取少量灰白色沉淀,加入足量稀硝酸使其完全溶解,继续滴加几滴AgNO3溶液,出现白色沉淀,他得出结论:灰白色沉淀中含有Cl﹣,请你判断小赵同学的实验及结论是否正确,为什么? 。
【结论】:镁与稀盐酸反应产生灰白色沉淀与溶液中的氯离子有关。
(5)实验得到反应过程中烧瓶内压强的变化情况如图2所示。下列说法正确的是 (填字母)。
A.实验中稀盐酸、稀硫酸反应生成的氢气一样多
B.实验条件下,镁与稀盐酸反应的速率比稀硫酸的快
C.镁与稀盐酸、稀硫酸反应时放热
(6)资料显示:灰白色沉淀【Mg2(OH)xCly•nH2O】的组成。
随pH变化而改变,受热后分解生成MgO、H2O和HCl,为进一步探究其组成,小组同学设计如实验。
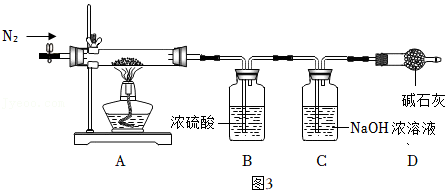
【实验步骤】
①组装仪器, ;
②取21.6g灰白色沉淀于A中,按图示装入其他药品(均足量);
③打开止水夹,缓缓通入一段时间N2后,关闭止水夹;
④称量C质量并记录数据为m1;
⑤点燃酒精灯加热至A中固体完全分解, ;
⑥称量C质量并记录数据为m2,称量A中残留固体质量并记录数据为m3;
⑦数据处理。
【交流讨论】
(7)步骤③通N2的目的是 。
(8)D的作用是 ,若无D,测得n值将 (填“偏大”、“偏小”或“不变”)。
【数据处理】
(9)实验数据为m2﹣m1=7.3g,m3=8.0g,请通过计算给出灰白色沉淀的化学式(写出计算过程)。
【探究一】:探究灰白色沉淀中是否含有过量的镁或反应生成的氯化镁。
(1)①取灰白色固体样品,加入 ,无气泡产生,灰白色固体不含镁。
②取等质量的灰白色固体和MgCl2晶体分别放入同温、等量水中,灰白色固体不溶解而MgCl2晶体全部 ,灰白色固体不含MgCl2。
【探究二】:探究灰白色固体产生的原因。

用如图1所示装置(平底烧瓶已固定)分别进行镁带与稀盐酸、稀硫酸反应的实验,其中镁带与稀盐酸反应的实验现象如表所示。
足量镁带和稀盐酸反应的实验现象:
| 时间/min | 2 | 4 | 6 | 8 | 12 | 16 | 18 | 20 | 放置过夜 |
| 溶液pH | 5.8 | 7.4 | 8.0 | 8.6 | 9.3 | 9.8 | 10.0 | 10.0 | 10.2 |
| 实验现象 | 大量气泡、无沉淀生成 | 镁带慢慢溶解,气泡量减少,烧杯底部灰白色沉淀逐渐增加 | |||||||
(2)实验时,使镁条与稀盐酸、稀硫酸反应的操作是 。
(3)根据实验现象推测:①产生灰白色沉淀需 (填“酸性”、“碱性”或“中性”)条件;②灰白色沉淀产生和 (填离子符号)有关。
(4)为证实灰白色沉淀中含有Cl﹣,小赵同学设计了如下实验:过滤,取少量灰白色沉淀,加入足量稀硝酸使其完全溶解,继续滴加几滴AgNO3溶液,出现白色沉淀,他得出结论:灰白色沉淀中含有Cl﹣,请你判断小赵同学的实验及结论是否正确,为什么? 。
【结论】:镁与稀盐酸反应产生灰白色沉淀与溶液中的氯离子有关。
(5)实验得到反应过程中烧瓶内压强的变化情况如图2所示。下列说法正确的是 (填字母)。
A.实验中稀盐酸、稀硫酸反应生成的氢气一样多
B.实验条件下,镁与稀盐酸反应的速率比稀硫酸的快
C.镁与稀盐酸、稀硫酸反应时放热
(6)资料显示:灰白色沉淀【Mg2(OH)xCly•nH2O】的组成。
随pH变化而改变,受热后分解生成MgO、H2O和HCl,为进一步探究其组成,小组同学设计如实验。

【实验步骤】
①组装仪器, ;
②取21.6g灰白色沉淀于A中,按图示装入其他药品(均足量);
③打开止水夹,缓缓通入一段时间N2后,关闭止水夹;
④称量C质量并记录数据为m1;
⑤点燃酒精灯加热至A中固体完全分解, ;
⑥称量C质量并记录数据为m2,称量A中残留固体质量并记录数据为m3;
⑦数据处理。
【交流讨论】
(7)步骤③通N2的目的是 。
(8)D的作用是 ,若无D,测得n值将 (填“偏大”、“偏小”或“不变”)。
【数据处理】
(9)实验数据为m2﹣m1=7.3g,m3=8.0g,请通过计算给出灰白色沉淀的化学式(写出计算过程)。
查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解