下载高清试卷
【2022年四川省绵阳市中考化学一模试卷】-第1页
试卷格式:2022年四川省绵阳市中考化学一模试卷.PDF
试卷热词:最新试卷、2022年、四川试卷、绵阳市试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷
扫码查看解析
试卷题目
1.2021年6月5日是第50个“世界环境日”。下列做法不利于保护环境的是( )
- A. 生活垃圾分类处理
- B. 工业废水直接排放
- C. 农药化肥合理施用
- D. 清洁能源推广使用
2.下列有关空气的说法正确的是( )
- A. 洁净的空气属于纯净物
- B. 工业分离液态空气时发生化学变化
- C. 食品在空气中因与氧气发生缓慢氧化而变质
- D. 空气中的二氧化碳含量过高不会对环境造成影响
3.下列叙述正确的是( )
- A. 实验室制取O2:2KMnO4═K2MnO4+MnO2+O2↑
- B. 工业上分离液态空气得到O2的变化属于化学变化
- C. 自然界中植物通过光合作用吸收CO2,释放O2
- D. 人体呼出的气体中CO2的含量比O2高
4.利用如图装置进行燃烧条件的探究。试管①中充满氮气,试管②③中充满氧气,升温至40℃,仅观察到②中的白磷燃烧。下列叙述错误的是( )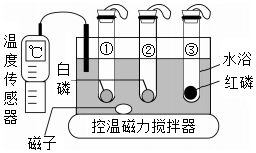

- A. 由实验①②可验证燃烧需要氧气
- B. 由实验②③可推知着火点高低:红磷>白磷
- C. 利用水浴控温可调节可燃物的着火点
- D. ①③两支试管内的白磷和红磷可回收再利用
5.下列指定反应的化学方程式正确的是( )
- A. 磷在氧气中燃烧:P+O2P2O5
点燃 - B. 铜丝插入硝酸银溶液中;Cu+AgNO3═CuNO3+Ag
- C. 高锰酸钾受热分解;2KMnO4K2MnO4+O2↑
△ - D. 绿色植物的光合作用:6CO2+6H2OC6H12O6+6O2光照
叶绿素
6.依据下列实验现象得出的结论,正确的是( )
| 选项 | 实验现象 | 结论 |
| A | 某化肥加熟石灰固体后研磨,有氨味 | 该化肥是氯化铵 |
| B | 某金属与盐酸反应比铝与硫酸反应剧烈 | 该金属的活动性比铝的强 |
| C | 某无色溶液中滴加紫色石蕊试液,呈红色 | 该无色溶液显酸性 |
| D | 某水样中滴加肥皂水后振荡,产生大量泡沫 | 该水样属于硬水 |
- A. A
- B. B
- C. C
- D. D
7.现将含有某一种氯化物杂质的MgCl2粉末95g溶于水后,与足量的AgNO3溶液反应,可生成AgCl沉淀290g。则该MgCl2粉末中含有的杂质可能是( )
- A. NaCl
- B. CaCl2
- C. AlCl3
- D. KCl
8.2018年和2019年我国电力能源结构如图所示,下列说法不正确的是( )
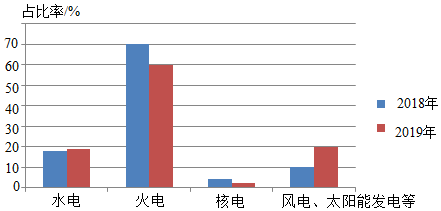

- A. 水能、风能、太阳能都是清洁能源
- B. 减少煤的使用有利于防止温室效应进一步增强
- C. 煤燃烧产生的CO2和SO2都是形成酸雨的污染物
- D. 我国电力能源结构的变化体现了“低碳”理念
9.取20.0g KMnO4固体制氧气,加热一段时间后,固体质量减少1.6g。已分解KMnO4的质量占取用KMnO4总质量的百分率为( )
- A. 8%
- B. 39.5%
- C. 79%
- D. 92%
10.阅读下列短文,回答问题。
红色经典影片《闪闪的红星》中有一段儿童团员潘冬子给红军送盐的故事。冬子开始把食盐装在竹筒中,打算扮作上山砍柴的人将食盐送给红军。途中发现敌人盘查严格,冬子急中生智跑到河边,把竹筒里的食盐全部溶成盐水,再用棉袄吸收,最终顺利地将食盐送给了红军。
(1)从微观角度分析,氯化钠是由 (填“分子”“原子”或“离子”)构成;从元素角度分析,氯化钠溶液中+1价的元素有 (填元素符号)。
(2)从盐水中重新得到食盐固体,需进行操作的名称是 。
(3)氯化钠的溶解度曲线如图。假设冬子的竹筒中有358g氯化钠,10℃时最少需用 g水溶解。
(4)氯化钠在生活中的用途有 (写出1点即可)。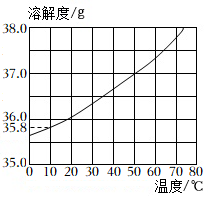
红色经典影片《闪闪的红星》中有一段儿童团员潘冬子给红军送盐的故事。冬子开始把食盐装在竹筒中,打算扮作上山砍柴的人将食盐送给红军。途中发现敌人盘查严格,冬子急中生智跑到河边,把竹筒里的食盐全部溶成盐水,再用棉袄吸收,最终顺利地将食盐送给了红军。
(1)从微观角度分析,氯化钠是由 (填“分子”“原子”或“离子”)构成;从元素角度分析,氯化钠溶液中+1价的元素有 (填元素符号)。
(2)从盐水中重新得到食盐固体,需进行操作的名称是 。
(3)氯化钠的溶解度曲线如图。假设冬子的竹筒中有358g氯化钠,10℃时最少需用 g水溶解。
(4)氯化钠在生活中的用途有 (写出1点即可)。

11.某兴趣小组利用废镍材料(含有金属Ni及少量Fe、Ag)探究相关物质的性质并回收镍,设计流程如图所示(部分产物略去)。
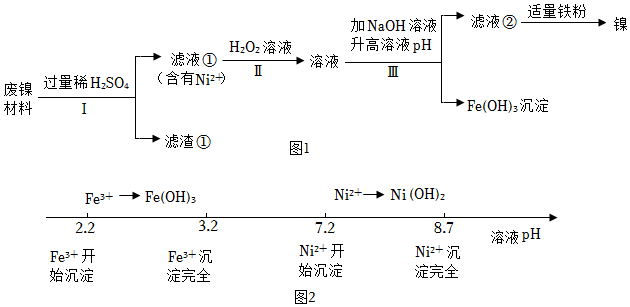
查阅资料:a.H2O2溶液可将Fe2+转化为Fe3+。
b.Fe3+、Ni2+转化为对应的氢氧化物沉淀时,溶液pH有如图2关系:
(1)步骤Ⅰ的操作为 。
(2)滤渣①的成分为 。
(3)单质Fe参与反应的化学方程式为 (任写一个)。
(4)滤液②中有Ni2+、无Fe3+,则滤液②pH可能为 (填序号)。
A.pH=1
B.pH=2
C.pH=6
D.pH=10
(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为 。

查阅资料:a.H2O2溶液可将Fe2+转化为Fe3+。
b.Fe3+、Ni2+转化为对应的氢氧化物沉淀时,溶液pH有如图2关系:
(1)步骤Ⅰ的操作为 。
(2)滤渣①的成分为 。
(3)单质Fe参与反应的化学方程式为 (任写一个)。
(4)滤液②中有Ni2+、无Fe3+,则滤液②pH可能为 (填序号)。
A.pH=1
B.pH=2
C.pH=6
D.pH=10
(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为 。
12.实验室常用溶质质量分数为6%的H2O2溶液(MnO2作催化剂)制取少量氧气。
(1)配制6%的H2O2稀溶液
①计算:市售H2O2溶液溶质质量分数通常为30%。配制100g 6%的H2O2溶液,需要30%的H2O2溶液质量为 g。
②配制:量取所需H2O2溶液和水于烧杯中,用 (填仪器名称)搅拌,充分混合。
(2)制取氧气(可能用到的部分装置如图)
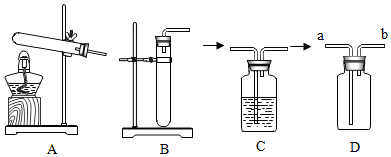
①实验室用H2O2制取氧气的化学方程式为 ,可选择的发生装置为 (填字母)。
②若用C装置干燥氧气,则C中盛放的试剂为 。
③若用D装置收集氧气,则气体应从导管 (填“a”或“b”)端通入。
(3)拓展延伸
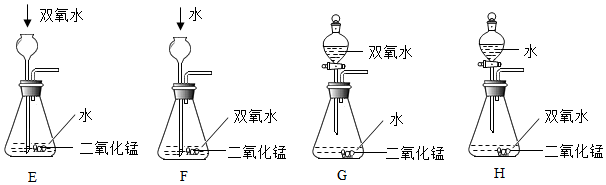
若直接用30%的H2O2溶液制取氧气,反应速率太快。为获得平稳的气流,如图所示发生装置能达到最佳效果的是 (填字母)。
(1)配制6%的H2O2稀溶液
①计算:市售H2O2溶液溶质质量分数通常为30%。配制100g 6%的H2O2溶液,需要30%的H2O2溶液质量为 g。
②配制:量取所需H2O2溶液和水于烧杯中,用 (填仪器名称)搅拌,充分混合。
(2)制取氧气(可能用到的部分装置如图)

①实验室用H2O2制取氧气的化学方程式为 ,可选择的发生装置为 (填字母)。
②若用C装置干燥氧气,则C中盛放的试剂为 。
③若用D装置收集氧气,则气体应从导管 (填“a”或“b”)端通入。
(3)拓展延伸
若直接用30%的H2O2溶液制取氧气,反应速率太快。为获得平稳的气流,如图所示发生装置能达到最佳效果的是 (填字母)。

13.化学兴趣小组对CO2与NaOH溶液反应的发生进行了探究。
(1)从压强变化的角度探究。
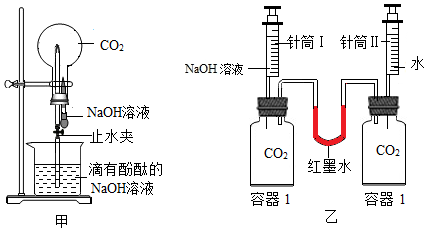
①利用图甲装置进行实验,先挤压胶头滴管,再打开止水夹,观察到烧瓶内形成红色“喷泉”,原因是烧瓶内压强 (填“大于”或“小于”)外界大气压;
②利用图乙装置进行实验,分别将等体积的NaOH溶液和水同时注入盛有等体积CO2的玻璃容器中。证明CO2与NaOH溶液发生反应的实验现象是 ;
③写出CO2与NaOH溶液反应的化学方程式: 。
(2)利用“数字化实验”探究。
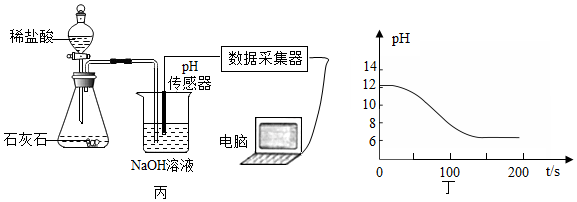
①写出图丙中制取CO2的化学方程式: ,检验CO2的方法是 ;
②实验测得烧杯中溶液的pH随时间的变化关系如图丁所示,可推知反应过程中浓度不断减小的离子是 (填离子符号)。
(3)氯碱工业生产的烧碱样品中常含有Na2CO3和NaCl等杂质。为测定烧碱样品中Na2CO3的质量分数,称取20g烧碱样品,加足量水溶解,再加入足量的BaCl2溶液,充分反应后,过滤,将滤渣洗涤、干燥、称量,得到0.197g碳酸钡(BaCO3)固体。
①检验烧碱样品中是否含有Na2CO3,可选择的试剂是 (填字母);
a.稀盐酸
b.澄清石灰水
c.酚酞
②计算烧碱样品中Na2CO3的质量分数(写出计算过程)。
(1)从压强变化的角度探究。

①利用图甲装置进行实验,先挤压胶头滴管,再打开止水夹,观察到烧瓶内形成红色“喷泉”,原因是烧瓶内压强 (填“大于”或“小于”)外界大气压;
②利用图乙装置进行实验,分别将等体积的NaOH溶液和水同时注入盛有等体积CO2的玻璃容器中。证明CO2与NaOH溶液发生反应的实验现象是 ;
③写出CO2与NaOH溶液反应的化学方程式: 。
(2)利用“数字化实验”探究。

①写出图丙中制取CO2的化学方程式: ,检验CO2的方法是 ;
②实验测得烧杯中溶液的pH随时间的变化关系如图丁所示,可推知反应过程中浓度不断减小的离子是 (填离子符号)。
(3)氯碱工业生产的烧碱样品中常含有Na2CO3和NaCl等杂质。为测定烧碱样品中Na2CO3的质量分数,称取20g烧碱样品,加足量水溶解,再加入足量的BaCl2溶液,充分反应后,过滤,将滤渣洗涤、干燥、称量,得到0.197g碳酸钡(BaCO3)固体。
①检验烧碱样品中是否含有Na2CO3,可选择的试剂是 (填字母);
a.稀盐酸
b.澄清石灰水
c.酚酞
②计算烧碱样品中Na2CO3的质量分数(写出计算过程)。
14.某袋装食品的脱氧剂由活性炭、铁粉和食盐混合而成,三者质量比为2:2:1.现用该脱氧剂进行实验,回答下列问题:
(1)将该脱氧剂加入盐酸中,发生反应的化学方程式为 。
(2)打开失效的脱氧剂小袋,发现里面出现了红褐色物质,该物质的主要成分是 (填化学式)。5.0g未经使用的该脱氧剂最多能够吸收氧气 g。
(3)用电子秤称取7.20g完全失效后的脱氧剂放入烧杯中,加入足量稀硝酸,充分溶解后过滤,滤渣为黑色粉末。向所得滤液中加入足量AgNO3溶液,充分反应产生的沉淀质量为2.87g。列式计算该失效脱氧剂中NaCl的质量分数(计算结果精确到0.1%)。
(1)将该脱氧剂加入盐酸中,发生反应的化学方程式为 。
(2)打开失效的脱氧剂小袋,发现里面出现了红褐色物质,该物质的主要成分是 (填化学式)。5.0g未经使用的该脱氧剂最多能够吸收氧气 g。
(3)用电子秤称取7.20g完全失效后的脱氧剂放入烧杯中,加入足量稀硝酸,充分溶解后过滤,滤渣为黑色粉末。向所得滤液中加入足量AgNO3溶液,充分反应产生的沉淀质量为2.87g。列式计算该失效脱氧剂中NaCl的质量分数(计算结果精确到0.1%)。
查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解