下载高清试卷
【2021年北京市石景山区中考化学一模试卷】-第1页
试卷格式:2021年北京市石景山区中考化学一模试卷.PDF
试卷热词:最新试卷、2021年、北京试卷、石景山区试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷

扫码查看解析
试卷题目
1.下列气体能供给动植物呼吸的是( )
- A. CO2
- B. H2
- C. O2
- D. N2
2.空气成分中体积分数最大的是( )
- A. N2
- B. O2
- C. CO2
- D. 稀有气体
3.下列食品富含蛋白质的是( )
- A. 黄瓜
- B. 苹果
- C. 土豆
- D. 鸡蛋
4.下列金属中,活动性最强的是( )
- A. 铝
- B. 银
- C. 镁
- D. 汞
5.下列属于厨余垃圾的是( )
- A. 易拉罐
- B. 一次性餐具
- C. 菜叶
- D. 废旧电池
6.下列元素中,属于金属元素的是( )
- A. 硅 Si
- B. 氟 F
- C. 溴 Br
- D. 钛 Ti
7.下列人体所必需的元素中,缺乏后会导致贫血的是( )
- A. 铁
- B. 钙
- C. 碘
- D. 锌
8.下列物质的用途中,利用其物理性质的是( )
- A. 铜用作导线
- B. 氢气用作清洁燃料
- C. 氧气用于炼钢
- D. 熟石灰用于改良酸性土壤
9.下列物质中,能用作氮肥的是( )
- A. NH4Cl
- B. K2SO4
- C. K2CO3
- D. Ca3(PO4)2
10.下列饮品属于溶液的是( )
- A. 牛奶
- B. 豆浆
- C. 果粒橙
- D. 蔗糖水
11.下列物质属于纯净物的是( )
- A. 空气
- B. 蒸馏水
- C. 石灰水
- D. 生铁
12.下列实验操作中,不正确的是( )
- A.
 称量氯化钠
称量氯化钠 - B.
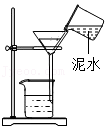 过滤泥水
过滤泥水 - C.
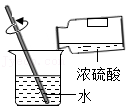 稀释浓硫酸
稀释浓硫酸 - D.
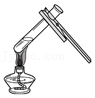 加热液体
加热液体
13.下列是人体中几种体液的正常pH,酸性最强的是( )
- A. 胆汁(6.8~7.4)
- B. 唾液(6.6~7.1)
- C. 胰液(7.5~8.0)
- D. 胃液(0.8~1.5)
14.碱式碳酸铜受热分解生成CuO、CO2和H2O,组成碱式碳酸铜的元素有( )
- A. 5种
- B. 4种
- C. 3种
- D. 2种
15.碳元素与氧元素的本质区别是( )
- A. 质子数不同
- B. 电子数不同
- C. 中子数不同
- D. 电子层数不同
16.下列符号中,表示2个氢原子的是( )
- A. H2
- B. 2H2
- C. 2H
- D. H2O
17.下列化学方程式书写不正确的是( )
- A. CH4 +2O22H2O+CO2
点燃 - B. CaCO3+2HCl═CaCl2+H2O+CO2↑
- C. Fe+O2Fe3O4
点燃 - D. 3CO+Fe2O32Fe+3CO2
高温
18.下列物质的名称与化学式不对应的是( )
- A. 氯化亚铁 FeCl2
- B. 氧化铜 CuO
- C. 硫酸钠 Na2SO3
- D. 氧化铝 Al2O3
19.鉴别一瓶气体是否为氧气,下列操作正确的是( )
- A. 闻气体气味
- B. 观察气体颜色
- C. 倒入澄清石灰水
- D. 插入带火星木条
20.下列物质露置于空气中一段时间,质量减少的是( )
- A. 浓盐酸
- B. 浓硫酸
- C. 氢氧化钠
- D. 生石灰
21.下列不是氢氧化钠俗称的是( )
- A. 烧碱
- B. 纯碱
- C. 火碱
- D. 苛性钠
22.20℃时,向下列3只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。上述溶液为饱和溶液的是( )
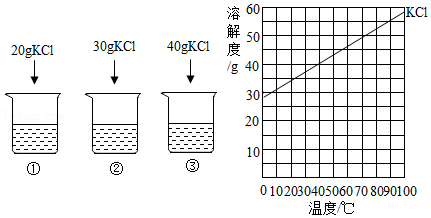

- A. ①
- B. ②
- C. ③
- D. ②③
23.20℃时,向下列3只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。
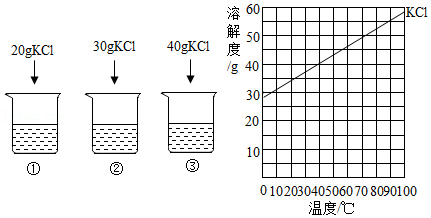
下列说法不正确的是( )

下列说法不正确的是( )
- A. ①中溶液的质量为120g
- B. ②中溶液的溶质质量分数为30%
- C. 将②中的溶液倒出一半,溶液中溶质质量分数不变
- D. 将③中溶液升温至40℃时,溶液中溶质质量分数增大
24.氨催化氧化是制硝酸的主要反应之一。该反应前后分子种类变化的微观示意图如图。下列说法正确的是( )


- A. 甲由4种原子构成
- B. 乙为氧分子
- C. 该反应属于置换反应
- D. 生成的丙与丁的分子个数比为1:2
25.取一定量的碳酸钙和稀盐酸反应后的溶液,逐滴滴入Na2CO3溶液,并用pH数字探测仪监测,结果如图。下列说法不正确的是( )

已知:NaCl和CaCl2溶液呈中性,Na2CO3溶液呈碱性;CaCl2+Na2CO3═2NaCl+CaCO3↓

已知:NaCl和CaCl2溶液呈中性,Na2CO3溶液呈碱性;CaCl2+Na2CO3═2NaCl+CaCO3↓
- A. 所取溶液中溶质为CaCl2和HCl
- B. 实验过程中可观察到有气泡产生和浑浊现象
- C. 加入25mL Na2CO3溶液时,溶液中溶质为Na2CO3
- D. 加入20mL~25mL Na2CO3溶液时,pH升高的原因是Na2CO3溶液滴加过量
26.补齐物质与其用途的连线。
   焙制糕点 腌制食品 制冷剂 焙制糕点 腌制食品 制冷剂 |
27.次氯酸钠(NaClO)和过氧化氢常用作消毒剂。如图和表是84消毒液的标签(部分)和过氧化氢消毒剂对循环冷却水中菌类杀菌效力的实验研究数据。
(1)84消毒液中,“有效氯含量”中的氯是指 (填“氯气”或“氯元素”)。
(2)NaClO中,质量分数最小的元素是 。
(3)根据注意事项,说出一条84消毒液中物质的性质 。
(4)NaClO和H2O2均属于 (填序号)。
A. 单质
B. 化合物
C. 氧化物
(5)分析过氧化氢消毒剂杀菌实验数据,得出的结论是 。

| 过氧化氢溶液浓度/mol▪L﹣1 | 3 | 5 | 10 | 10 | 10 |
| 时间/h | 0.5 | 1 | 0.5 | 1 | 2 |
| 真菌存活率/% | 85 | 63 | 38 | 13 | 3 |
| 亚硝菌存活率/% | 67 | 53 | 15 | 7 | 4 |
(1)84消毒液中,“有效氯含量”中的氯是指 (填“氯气”或“氯元素”)。
(2)NaClO中,质量分数最小的元素是 。
(3)根据注意事项,说出一条84消毒液中物质的性质 。
(4)NaClO和H2O2均属于 (填序号)。
A. 单质
B. 化合物
C. 氧化物
(5)分析过氧化氢消毒剂杀菌实验数据,得出的结论是 。

28.可再生能源在我国能源结构中的占比逐渐增大。
(1)对比2017年和2020年中国能源结构。化石燃料中,占比日益减少的是 。
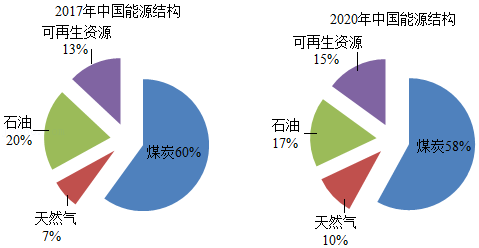
(2)如图,通过光催化可将H2O、CO2转化为太阳能燃料我国在太阳能燃料方面取得新进展:①开发了一种催化剂,将CO2和H2O转化为CH4;②开发了另一种催化剂,将CO2和H2O转化为H2和CO。两个转化反应中,均还生成另外一种物质,该物质中一定含有 元素。
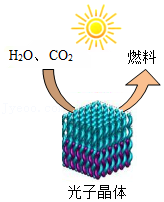
(1)对比2017年和2020年中国能源结构。化石燃料中,占比日益减少的是 。

(2)如图,通过光催化可将H2O、CO2转化为太阳能燃料我国在太阳能燃料方面取得新进展:①开发了一种催化剂,将CO2和H2O转化为CH4;②开发了另一种催化剂,将CO2和H2O转化为H2和CO。两个转化反应中,均还生成另外一种物质,该物质中一定含有 元素。

29.阅读下面科普短文。
“绿水青山就是金山银山”正在逐渐改变和强化着人们的环境意识和环境价值。塑料曾被列为20世纪最伟大的发明之一,但也有缺点,一是塑料以石油为原料制成,用去了大量宝贵的石油资源,二是塑料需要千百年才能降解,降解后会污染土壤,影响地下水质和农作物生长。科学家经过不懈的研究,从饱含淀粉质的玉米中制取乳酸(C3H6O3),再经过聚合反应生产出颗粒状高分子材料聚乳酸,来替代塑料,被称为玉米塑料。如图1玉米塑料制品废弃后可被环境中的微生物完全分解,成为自然界碳循环的组成部分。
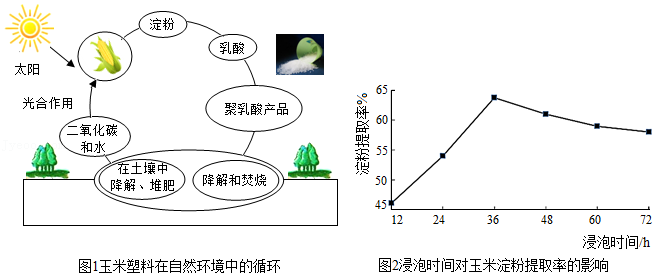
玉米粒中营养成分含量最多的是淀粉(70%﹣75%)。玉米淀粉普遍采用的是湿法提取,浸泡是玉米淀粉提取工艺中的核心环节。在50℃时,相同浸泡液中(水、0.5%亚硫酸钠溶液、0.5%乳酸溶液按8:1:1配比),测定浸泡时间与玉米淀粉提取率的关系如图2。
玉米是传统粮食,现在和将来,玉米塑料将广泛应用于食品包装、一次性产品、工程、日用、农业、医疗等领域,它将变成盒子、瓶子和手机等产品,科技是多神奇啊!
(原文作者陆学中、雨鱼等,有删改)
依据文章内容回答下列问题。
(1)写出塑料的一个缺点 。
(2)玉米塑料制品最终被微生物完全分解成的物质是 。
(3)图2实验,浸泡液中的两种溶质是 。
(4)玉米塑料在自然环境中循环,主要发生化学变化的是 (填序号)。
A.玉米进行光合作用
B.玉米淀粉制取乳酸
C.玉米塑料降解或焚烧
D.从玉米中提取出玉米淀粉
(5)由图2得出的结论是 。
“绿水青山就是金山银山”正在逐渐改变和强化着人们的环境意识和环境价值。塑料曾被列为20世纪最伟大的发明之一,但也有缺点,一是塑料以石油为原料制成,用去了大量宝贵的石油资源,二是塑料需要千百年才能降解,降解后会污染土壤,影响地下水质和农作物生长。科学家经过不懈的研究,从饱含淀粉质的玉米中制取乳酸(C3H6O3),再经过聚合反应生产出颗粒状高分子材料聚乳酸,来替代塑料,被称为玉米塑料。如图1玉米塑料制品废弃后可被环境中的微生物完全分解,成为自然界碳循环的组成部分。

玉米粒中营养成分含量最多的是淀粉(70%﹣75%)。玉米淀粉普遍采用的是湿法提取,浸泡是玉米淀粉提取工艺中的核心环节。在50℃时,相同浸泡液中(水、0.5%亚硫酸钠溶液、0.5%乳酸溶液按8:1:1配比),测定浸泡时间与玉米淀粉提取率的关系如图2。
玉米是传统粮食,现在和将来,玉米塑料将广泛应用于食品包装、一次性产品、工程、日用、农业、医疗等领域,它将变成盒子、瓶子和手机等产品,科技是多神奇啊!
(原文作者陆学中、雨鱼等,有删改)
依据文章内容回答下列问题。
(1)写出塑料的一个缺点 。
(2)玉米塑料制品最终被微生物完全分解成的物质是 。
(3)图2实验,浸泡液中的两种溶质是 。
(4)玉米塑料在自然环境中循环,主要发生化学变化的是 (填序号)。
A.玉米进行光合作用
B.玉米淀粉制取乳酸
C.玉米塑料降解或焚烧
D.从玉米中提取出玉米淀粉
(5)由图2得出的结论是 。
30.利用硝酸(HNO3)和Na2CO3制NaNO3的主要工艺流程如图。
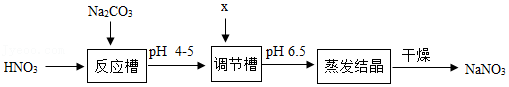
(1)反应槽中反应的化学方程式为2HNO3+Na2CO3═2NaNO3+H2O+CO2↑,该反应属于基本反应类型中的 反应。
(2)将溶液pH调到6.5,加入的x是 。
A.盐酸
B.氢氧化钠
C.氢氧化钙

(1)反应槽中反应的化学方程式为2HNO3+Na2CO3═2NaNO3+H2O+CO2↑,该反应属于基本反应类型中的 反应。
(2)将溶液pH调到6.5,加入的x是 。
A.盐酸
B.氢氧化钠
C.氢氧化钙
31.利用Na2CO3溶液吸收硝酸生产中排出的NO和NO2尾气制取NaNO3,可实现综合利用资源,减少环境污染,其主要工艺流程如图。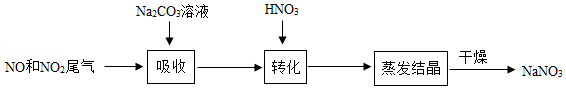
(1)吸收时,发生的反应有:①Na2CO3+2NO2═NaNO3+NaNO2+CO2;②NO+NO2+Na2CO3═2NaNO2+CO2。反应①的物质中,属于氧化物是 ;反应②中,氮元素有 种不同的化合价。
(2)转化时,加入HNO3的作用是 。

(1)吸收时,发生的反应有:①Na2CO3+2NO2═NaNO3+NaNO2+CO2;②NO+NO2+Na2CO3═2NaNO2+CO2。反应①的物质中,属于氧化物是 ;反应②中,氮元素有 种不同的化合价。
(2)转化时,加入HNO3的作用是 。
32.请从A、B两题中任选一个作答,若均作答,按A计分。
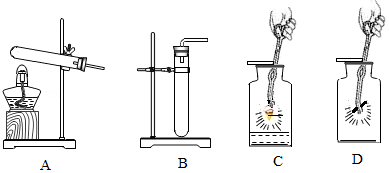

| A | B |
| (1)实验室用高锰酸钾制取氧气时,选用的发生装置是 (填序号);反应的化学方程式为 。 (2)C中,铁丝在氧气中燃烧的现象是 。 | (3)实验室用H2O2溶液和MnO2制取氧气时,选用的发生装置是 (填序号);反应的化学方程式为 。 (4)D中,木炭在氧气中燃烧的现象是 。 |
33.根据如图回答问题。
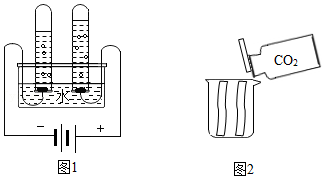
(1)图1实验,发生反应的化学方程式为 ;实验得出的结论是 。
(2)图2实验,烧杯一侧放一干、一湿两张紫色石蕊纸条,从另一侧倒入CO2。湿纸条由下至上逐渐变红,干纸条无明显变化。实验得出的结论是 。

(1)图1实验,发生反应的化学方程式为 ;实验得出的结论是 。
(2)图2实验,烧杯一侧放一干、一湿两张紫色石蕊纸条,从另一侧倒入CO2。湿纸条由下至上逐渐变红,干纸条无明显变化。实验得出的结论是 。
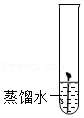
34.配制如图所示的氯化钾溶液。

(1)称量10g KCl,量取 mL蒸馏水(水的密度近似看做1g/mL)。
(2)溶解时,用到的仪器有 。

(1)称量10g KCl,量取 mL蒸馏水(水的密度近似看做1g/mL)。
(2)溶解时,用到的仪器有 。
35.如图,向点滴板1﹣3的孔穴中滴加CuSO4溶液,4﹣6的孔穴中滴加稀盐酸。
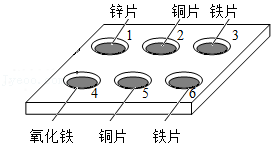
(1)加入稀盐酸后,没有发生反应的孔穴是 。
(2)能证明铁的活动性比铜强的实验是 (填孔穴序号)。
(3)孔穴4中发生反应的化学方程式为 。

(1)加入稀盐酸后,没有发生反应的孔穴是 。
(2)能证明铁的活动性比铜强的实验是 (填孔穴序号)。
(3)孔穴4中发生反应的化学方程式为 。
36.用如图实验研究氢氧化钠溶液与氢氧化钙溶液的性质。

(1)实验1中,发生反应的化学方程式为 。
(2)实验2中,证明盐酸能与两种碱溶液发生反应的现象是 。
(3)能将两种溶液区分开的实验现象是 。

(1)实验1中,发生反应的化学方程式为 。
(2)实验2中,证明盐酸能与两种碱溶液发生反应的现象是 。
(3)能将两种溶液区分开的实验现象是 。
37.利用如图装置进行实验。已知:白磷和红磷的着火点分别为40℃和240℃。
(1)红磷燃烧的化学方程式为 。
(2)实验1中,证明空气中氧气体积分数约为
的现象是 。
(3)实验2中,欲得出可燃物燃烧需要温度达到着火点,需要对比的是 。
| 实验装置 | 【实验1】测定空气中氧气含量 | 【实验2】研究燃烧条件 |
 | 左管中燃烧匙盛有足量红磷,左、右管盛有处于同一水平线的水,将左管剩余空间五等分Ⅰ.激光引燃红磷Ⅱ.待红磷熄灭,至液面不再变化,调节右管中液体的高度与左管液面在同一水平线 | 左管中带孔的燃烧匙盛有红磷,左、右管盛有处于同一水平线的80℃热水Ⅰ.向右管热水中放一小块白磷Ⅱ.调节右管高度,使右管白磷露出水面 |
(1)红磷燃烧的化学方程式为 。
(2)实验1中,证明空气中氧气体积分数约为
| 1 |
| 5 |
(3)实验2中,欲得出可燃物燃烧需要温度达到着火点,需要对比的是 。
38.某课外小组对铁的锈蚀条件进行了如下探究。
【探究1】铁锈蚀的条件
【提出问题】为什么①中“油封”一段时间后铁丝表面出现了红色物质?
【探究2】“油封”对水中溶解氧的影响
实验1:将蒸馏水煮沸后迅速冷却至室温(12℃),取等体积水样于2个烧杯中,其中一个烧杯加5mL花生油进行“油封”,用溶解氧传感器测定两个水样中溶解氧含量。
实验2:操作与实验1相同,室温变为19℃,花生油改用煤油。
已知:未煮沸的蒸馏水中溶解氧含量,12℃时为10.68mg/L,19℃时为9.10mg/L。
【解释与结论】
(1)探究1中,对比 (填序号),可得出铁锈蚀需要与水接触。
(2)对比花生油、煤油,进行“油封”时,效果较好的是 。
(3)0小时时,实验2的溶解氧含量低于实验1,其原因可能是 。
(4)由实验得出的结论是 (填序号)。
A.“油封”的方式能隔绝氧气在水中的溶解
B.通过加热煮沸并冷却,可以明显降低水中含氧量
C.“油封”和“未油封”水样中的溶解氧均随时间增加而呈增大趋势
【反思与评价】
(5)生活中常用在金属表面涂油的方式“防生锈”,其主要原因是 。
(6)探究1实验①中,放置两周后铁丝依然出现锈蚀的原因是 。
【探究1】铁锈蚀的条件
| 实验 | ① | ② | ③ | |
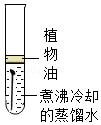 |  |  | ||
| 现象 | 放置一周 | 无明显变化 | 无明显变化 | 铁丝表面出现红色物质 |
| 放置两周 | 铁丝表面出现红色物质 | 无明显变化 | 铁丝表面红色物质增多 | |
【提出问题】为什么①中“油封”一段时间后铁丝表面出现了红色物质?
【探究2】“油封”对水中溶解氧的影响
实验1:将蒸馏水煮沸后迅速冷却至室温(12℃),取等体积水样于2个烧杯中,其中一个烧杯加5mL花生油进行“油封”,用溶解氧传感器测定两个水样中溶解氧含量。
实验2:操作与实验1相同,室温变为19℃,花生油改用煤油。
| 溶解氧含量/(mg/L) | 时间/h | 0 | 2 | 6 | 12 | 24 | 36 | 48 | |
| 实验1 | ①未油封 | 2.42 | 4.75 | 6.44 | 8.45 | 10.10 | 10.43 | 10.51 | |
| ②油封 | 2.43 | 3.02 | 4.28 | 4.81 | 6.47 | 7.20 | 7.98 | ||
| 实验2 | ③未油封 | 1.95 | 3.79 | 6.23 | 7.98 | 8.98 | 9.09 | 9.08 | |
| ④油封 | 1.93 | 3.42 | 5.37 | 7.11 | 8.26 | 8.24 | 8.22 | ||
已知:未煮沸的蒸馏水中溶解氧含量,12℃时为10.68mg/L,19℃时为9.10mg/L。
【解释与结论】
(1)探究1中,对比 (填序号),可得出铁锈蚀需要与水接触。
(2)对比花生油、煤油,进行“油封”时,效果较好的是 。
(3)0小时时,实验2的溶解氧含量低于实验1,其原因可能是 。
(4)由实验得出的结论是 (填序号)。
A.“油封”的方式能隔绝氧气在水中的溶解
B.通过加热煮沸并冷却,可以明显降低水中含氧量
C.“油封”和“未油封”水样中的溶解氧均随时间增加而呈增大趋势
【反思与评价】
(5)生活中常用在金属表面涂油的方式“防生锈”,其主要原因是 。
(6)探究1实验①中,放置两周后铁丝依然出现锈蚀的原因是 。
39.乙炔(C2H2)可用于金属焊接或切割,常用电石(主要成分CaC2)和水反应制取,反应的化学方程式为:CaC2+2H2O═Ca(OH)2+C2H2↑。80kg电石与水完全反应可制得26kg乙炔。请计算:
(1)C2H2中碳元素和氢元素的质量比为 。
(2)80kg电石中CaC2的质量。
(3)电石中CaC2的质量分数为 。
(1)C2H2中碳元素和氢元素的质量比为 。
(2)80kg电石中CaC2的质量。
(3)电石中CaC2的质量分数为 。
查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解