下载高清试卷
【2020-2021学年山东省烟台市蓬莱区八年级(下)期中化学试卷】-第1页
试卷格式:2020-2021学年山东省烟台市蓬莱区八年级(下)期中化学试卷.PDF
试卷热词:最新试卷、2021年、山东试卷、烟台市试卷、化学试卷、八年级下学期试卷、期中试卷、初中试卷

扫码查看解析
试卷题目
1.化学反应前后肯定没有变化的是( )
①原子数目
②分子数目
③元素种类
④原子种类
⑤物质种类
⑥物质的总质量.
①原子数目
②分子数目
③元素种类
④原子种类
⑤物质种类
⑥物质的总质量.
- A. ①④⑤⑥
- B. ①③④⑥
- C. ①②⑥
- D. ②③④
2.下列现象可用质量守恒定律解释的是( )
- A. 煤燃烧后质量减轻
- B. 冰融化成水后质量不变
- C. 酒精与水混合后体积变小
- D. 放在衣箱中的樟脑丸越来越小
3.氧气跟世间万物如影随形。下列关于氧气说法正确的是( )
- A. 在一定条件下,氧气从淡蓝色液体变成无色气体,发生了化学变化
- B. 凡是在空气中不能燃烧的物质,在纯氧中也不能燃烧
- C. 水生动物能在水中生存是因为氧气易溶于水
- D. 用燃着的的木条可区分氧气和二氧化碳,是利用了氧气的助燃性
4.下列实验现象的描述正确的是( )
- A. 硫在氧气中燃烧产生蓝紫色火焰,生成无色无味的气体
- B. 磷在氧气中燃烧,生成大量的白雾
- C. 铜在空气中受热生成红色固体
- D. 碳在氧气中燃烧,发出白光,生成无色气体
5.从变化观念和平衡思想认识反应:2H2+O2
2H2O,下列说法正确的是( )
| 点燃 |
- A. 氢气和氧气混合生成水
- B. 氢气和氧气反应吸收热量
- C. 2g氢气和1g氧气反应生成3g水
- D. 反应前后元素种类不变,只是由单质状态变成化合物状态
6.集气瓶中装满某气体,可能是下列气体中的一种:①二氧化碳 ②氧气 ③空气 ④氮气。将燃着的木条伸入瓶中,火焰立即熄灭,则该瓶气体可能是( )
- A. ①或②
- B. ②或③
- C. ①或④
- D. ③或④
7.在2A+3B=C+2D反应中,36g A与56g B恰好完全反应生成28g C和一定量的D,若C的化学式量为14,则C和D的化学式量之比为( )
- A. 7:1
- B. 7:8
- C. 7:16
- D. 7:32
8.蜡烛(足量)在如图1密闭装置内燃烧至熄灭,用仪器测出这一过程中瓶内氧气含量的变化如图2所示。下列判断正确的是( )
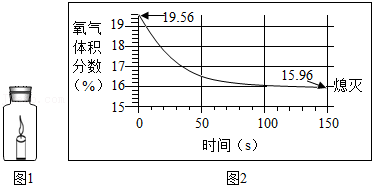

- A. 氧气浓度小于一定值时,蜡烛无法燃烧
- B. 蜡烛燃烧前装置内只有氧气
- C. 过程中装置内物质总质量不断减少
- D. 蜡烛熄灭后瓶内只剩二氧化碳气体
9.某家庭式空气净化器在工作时会释放出臭氧(O3),利用其强氧化性杀菌消毒并转化为无污染的氧气。下列分析合理的是( )
- A. O3转化为O2是分解反应
- B. 等质量的O3与O2所含的原子个数不同
- C. O3的强氧化性是由O3的分子结构决定
- D. O3与O2的化学性质完全相同
10.叠氮化钠广泛应用于汽车安全气囊,汽车经撞击后30毫秒内,引发叠氮化钠迅速分解为两种单质,该反应的化学方程式为2NaN3
2Na+3N2↑。下列关于该反应的说法错误的是( )
| 撞击 |
- A. 该反应属于分解反应
- B. 反应前后固体中钠元素的质量分数不变
- C. 各物质的粒子个数比为2:2:3
- D. 参加反应的各物质的质量比为65:23:42
11.下列实验设计能达到实验目的的是( )
| 选项 | A | B | C | D |
| 实验设计 | 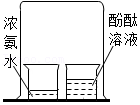 | 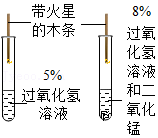 |  |  |
| 实验目的 | 探究分子间有间隙 | 研究二氧化锰的催化作用 | 确定石蜡成分中含有碳元素 | 测定空气中氧气的含量 |
- A. A
- B. B
- C. C
- D. D
12.如图是关于氧气化学性质的部分知识网络,关于该图说法正确的是( )


- A. S,P在氧气中燃烧均会产生大量白烟
- B. Ⅰ,Ⅱ两类反应均体现了氧气的可燃性
- C. Fe在Ⅰ、Ⅱ两类反应中的产物不相同
- D. Ⅰ类反应放出热量,Ⅱ类反应吸收热量
13.正确使用化学用语是重要的化学学科素养。下列说法正确的是( )
- A. H2O、H2O2、H2SO4中均含有氢分子
- B. KCl、KClO、KClO3中氯元素的化合价相同
- C.
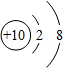 、
、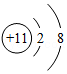 、
、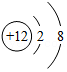 表示的粒子都是阳离子
表示的粒子都是阳离子 - D. CO、CO2、H2CO3都是含碳元素的化合物
14.在催化剂作用下,二氧化碳能高效转化为甲醇(CH3OH),相关反应如图所示,其中“ ”、“
”、“ ”和“〇”表示碳元素、氧元素、氢元素的原子。下列说法错误的是( )
”和“〇”表示碳元素、氧元素、氢元素的原子。下列说法错误的是( )
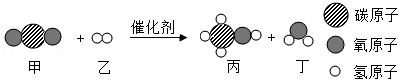
 ”、“
”、“ ”和“〇”表示碳元素、氧元素、氢元素的原子。下列说法错误的是( )
”和“〇”表示碳元素、氧元素、氢元素的原子。下列说法错误的是( )
- A. 该反应的四种物质中有两种氧化物
- B. 该反应前后碳、氢、氧元素的化合价都没有发生改变
- C. 该反应的催化剂在反应前后化学性质不改变
- D. 参加反应的乙和生成的丙的质量比为1:16
15.在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如表所示。下列说法不正确的是( )
| 物质 | a | b | c | d |
| 反应前的质量/g | 40 | 5 | 16 | 15 |
| 反应后的质量/g | x | 5 | 30 | 26 |
- A. b可能是催化剂
- B. x的值等于25
- C. 该反应是分解反应
- D. 参加反应的c与d的质量比为15:13
16.请按下列要求各写出一个化学方程式。
(1)有水生成的化合反应 。
(2)能在氧气中燃烧,发出耀眼的白光,生成白色固体 。
(3)铁丝在氧气中点燃 。
(4)碱式碳酸铜[Cu2(OH)2CO3]受热分解生成氧化铜、水和为二氧化碳 。
(1)有水生成的化合反应 。
(2)能在氧气中燃烧,发出耀眼的白光,生成白色固体 。
(3)铁丝在氧气中点燃 。
(4)碱式碳酸铜[Cu2(OH)2CO3]受热分解生成氧化铜、水和为二氧化碳 。
17.某兴趣小组的同学探究氧气性质的实验探究如图,请回答问题:
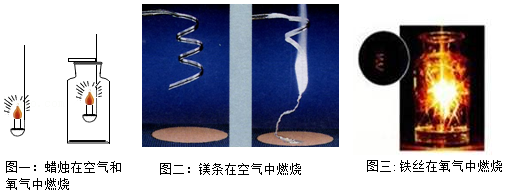
(1)图一的蜡烛燃烧过程中,通过现象 ,可以说明生成了水。检验另一种产物的方法是 。蜡烛在氧气中燃烧比在空气中燃烧更为剧烈,其原因从微观上看是由于 。
(2)镁不仅能在氧气中燃烧还能在氮气中燃烧生成氮化镁,已知氮化镁中氮元素显﹣3价,请你写出镁在氮气中燃烧的化学方程式 。你认为镁是否可以用于测定空气中氧气的含量,为什么? 。
(3)小军发现铁丝燃烧后,生成的黑色固体的质量大于铁丝的质量,认为这个反应不遵循质量守恒定律。你是否同意小军的观点 ,你的理由是 。在铁丝燃烧的实验中,哪步操作是为了减少热量散失,提高铁丝温度 。集气瓶底部留有少量水的原因是 。铁丝燃烧的化学方程式是 。
(4)图一和图三的反应,从反应类型来看,共同点是 。

(1)图一的蜡烛燃烧过程中,通过现象 ,可以说明生成了水。检验另一种产物的方法是 。蜡烛在氧气中燃烧比在空气中燃烧更为剧烈,其原因从微观上看是由于 。
(2)镁不仅能在氧气中燃烧还能在氮气中燃烧生成氮化镁,已知氮化镁中氮元素显﹣3价,请你写出镁在氮气中燃烧的化学方程式 。你认为镁是否可以用于测定空气中氧气的含量,为什么? 。
(3)小军发现铁丝燃烧后,生成的黑色固体的质量大于铁丝的质量,认为这个反应不遵循质量守恒定律。你是否同意小军的观点 ,你的理由是 。在铁丝燃烧的实验中,哪步操作是为了减少热量散失,提高铁丝温度 。集气瓶底部留有少量水的原因是 。铁丝燃烧的化学方程式是 。
(4)图一和图三的反应,从反应类型来看,共同点是 。
18.将宏观、微观及化学符号联系在一起是化学学科的特点。
(1)A、B、C、D表示四种物质,其微观示意图如图所示:
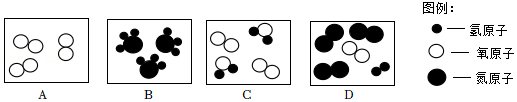
①从微观角度看,B中每个分子由 个原子构成, (“是”或者“不是”)氧化物。
②从宏观角度看,图中表示混合物的是 (填字母序号,下同),表示单质的是 。
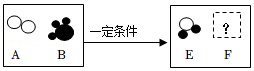
(2)在一定条件下,A和B能发生化学反应生成E和F,其微观示意图如图所示;若F为空气中体积分数最大的气体,则F的化学式为 ,该反应中生成的E和F的质量比为 。
(1)A、B、C、D表示四种物质,其微观示意图如图所示:

①从微观角度看,B中每个分子由 个原子构成, (“是”或者“不是”)氧化物。
②从宏观角度看,图中表示混合物的是 (填字母序号,下同),表示单质的是 。
(2)在一定条件下,A和B能发生化学反应生成E和F,其微观示意图如图所示;若F为空气中体积分数最大的气体,则F的化学式为 ,该反应中生成的E和F的质量比为 。

19.2020年,罕见的新冠病毒疫情爆发,各种消毒剂如酒精、二氧化氯、过氧乙酸等被广泛使用,根据所学知识回答下列问题。
(1)使用酒精消毒时,要注意安全,避免失火,酒精(C2H5OH)在空气中完全燃烧的化学方程式为 。
(2)二氧化氯(CO2)具有强氧化性,可发生反应:6ClO2+16NH3═5R+6NH4C1+12H2O,则R的化学式为 。
(3)过氧乙酸(CH3COOOH)中碳元素与氢元素的质量比为 。过氧乙酸溶液中通常还含有过氧化氢、醋酸等物质,向过氧乙酸溶液中加入二氧化锰,产生的现象是 。
(1)使用酒精消毒时,要注意安全,避免失火,酒精(C2H5OH)在空气中完全燃烧的化学方程式为 。
(2)二氧化氯(CO2)具有强氧化性,可发生反应:6ClO2+16NH3═5R+6NH4C1+12H2O,则R的化学式为 。
(3)过氧乙酸(CH3COOOH)中碳元素与氢元素的质量比为 。过氧乙酸溶液中通常还含有过氧化氢、醋酸等物质,向过氧乙酸溶液中加入二氧化锰,产生的现象是 。
20.A、B、C、D、E、F、G、H八种物质,有如图所示关系:其中A是一种暗紫色固体,B、G都是黑色固体,D能使带火星的木条复燃,E、F都是无色液体,H是一种能使澄清石灰水变浑浊的气体,在②的反应前后B的质量和化学性质都不改变。
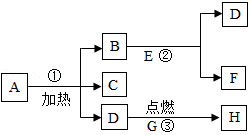
请你根据上述信息,推断出下列物质
A 、B 、C 、E 、H 。

请你根据上述信息,推断出下列物质
A 、B 、C 、E 、H 。
21.如图所示为实验室中常见的气体制备和收集装置。

请回答下列问题:
(1)如图A,在装入药品前要检查装置的气密性,其操作为 ,观察到导管口有气泡冒出。
(2)实验室用加热氯酸钾和二氧化锰固体制取氧气,应选用发生装置 (填字母序号),反应的化学方程式为 。若用装置D收集氧气,验满的方法是 。
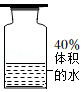
(3)实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C的优点是 ;收集氧气可采用排水集气法,因为氧气具有 的性质。甲同学欲收集体积分数为40%的氧气,他先往集气瓶中注入40%体积的水(如图所示),乙同学认为该方法得到的氧气体积分数不是40%,原因是 。
(4)欲使用装置E用排空气法收集氢气(密度比空气小),则气体应从 (填“a”或“b”)端通入;使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从 (填“a”或“b”)端通入。
(5)已知一氧化氮气体难溶于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中 装置(填字母序号)。

请回答下列问题:
(1)如图A,在装入药品前要检查装置的气密性,其操作为 ,观察到导管口有气泡冒出。
(2)实验室用加热氯酸钾和二氧化锰固体制取氧气,应选用发生装置 (填字母序号),反应的化学方程式为 。若用装置D收集氧气,验满的方法是 。
(3)实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C的优点是 ;收集氧气可采用排水集气法,因为氧气具有 的性质。甲同学欲收集体积分数为40%的氧气,他先往集气瓶中注入40%体积的水(如图所示),乙同学认为该方法得到的氧气体积分数不是40%,原因是 。

(4)欲使用装置E用排空气法收集氢气(密度比空气小),则气体应从 (填“a”或“b”)端通入;使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从 (填“a”或“b”)端通入。
(5)已知一氧化氮气体难溶于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中 装置(填字母序号)。
22.质量守恒定律对于定量进行化学研究有重要意义。为了让同学们理解质量守恒定律,老师决定用实验的方法让学生验证质量守恒定律的存在。
第一小组:该小组同学设计了三个实验,如图所示:
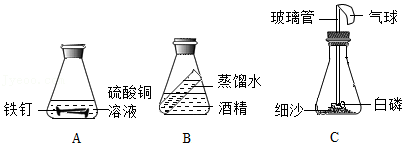
(1)这三个实验中,能用来验证质量守恒定律的是 ,写出反应的化学方程式 (写一个即可)。不能用于验证质量守恒定律的,请说明理由 。
第二小组:该小组同学选择了用碳酸钠与稀盐酸反应验证质量守恒定律。
已知:碳酸钠和盐酸反应生成氯化钠、水和二氧化碳。氢氧化钠溶液可与二氧化碳发生反应,常用来吸收二氧化碳等气体。
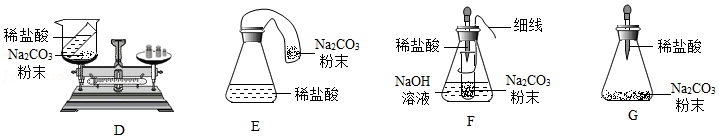
(2)同学们指出D装置在反应后托盘天平一定不会再保持平衡,不能验证质量守恒定律,原因是 。
(3)E、F、G均是D的改进装置。其中能用来验证质量守恒定律的装置是 ,实验时应注意 。不能采用的实验装置存在的问题是 。
第一小组:该小组同学设计了三个实验,如图所示:

(1)这三个实验中,能用来验证质量守恒定律的是 ,写出反应的化学方程式 (写一个即可)。不能用于验证质量守恒定律的,请说明理由 。
第二小组:该小组同学选择了用碳酸钠与稀盐酸反应验证质量守恒定律。
已知:碳酸钠和盐酸反应生成氯化钠、水和二氧化碳。氢氧化钠溶液可与二氧化碳发生反应,常用来吸收二氧化碳等气体。

(2)同学们指出D装置在反应后托盘天平一定不会再保持平衡,不能验证质量守恒定律,原因是 。
(3)E、F、G均是D的改进装置。其中能用来验证质量守恒定律的装置是 ,实验时应注意 。不能采用的实验装置存在的问题是 。
23.某兴趣小组对氯酸钾分解反应的催化剂进行研究,在相同的加热条件下,用如图装置完成表中实验:
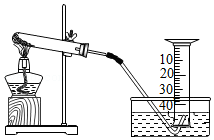
(1)设置实验一的目的是 ;
(2)表中所列3种催化剂的催化效果最佳的是 ;
(3)由实验一和实验四可知,氯化钾 (填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集50mL氧气,所需时间明显少于171s,解释原因: ;
(4)要比较氯酸钾分解反应中不同催化剂的催化效果,除了测量收集50mL氧气所需时间外,还可以测量 。
【拓展探究】同种催化剂,还有哪些因素会影响氯酸钾分解反应的催化效果?
(5)【猜想与假设】 。
(6)【实验方案】 。

| 编号 | 实验一 | 实验二 | 实验三 | 实验四 |
| 氯酸钾质量/g | 5 | 5 | 5 | 5 |
| 催化剂 | ﹣ | 二氧化锰 | 三氧化二铁 | 氯化钾 |
| 催化剂质量/g | ﹣ | 0.5 | 0.5 | 0.5 |
| 收集50mL氧气所需时间/s | 171 | 49 | 58 | 154 |
(1)设置实验一的目的是 ;
(2)表中所列3种催化剂的催化效果最佳的是 ;
(3)由实验一和实验四可知,氯化钾 (填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集50mL氧气,所需时间明显少于171s,解释原因: ;
(4)要比较氯酸钾分解反应中不同催化剂的催化效果,除了测量收集50mL氧气所需时间外,还可以测量 。
【拓展探究】同种催化剂,还有哪些因素会影响氯酸钾分解反应的催化效果?
(5)【猜想与假设】 。
(6)【实验方案】 。
24.钠有两种氧化物:过氧化钠(Na2O2)和氧化钠(Na2O)。
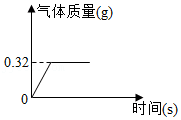
(1)过氧化钠常用作潜水艇里的供氧剂,原因是过氧化钠在常温下就能和二氧化碳反应生成碳酸钠和氧气,化学方程式为 。
(2)为测定某过氧化钠样品的纯度,将2g该样品与足量X发生如下反应(杂质不参与反应)2Na2O2+2X═4NaOH+O2↑,生成气体质量与时间的关系如图所示。
①物质X的化学式为________。
②计算该样品中过氧化钠的质量分数。

(1)过氧化钠常用作潜水艇里的供氧剂,原因是过氧化钠在常温下就能和二氧化碳反应生成碳酸钠和氧气,化学方程式为 。
(2)为测定某过氧化钠样品的纯度,将2g该样品与足量X发生如下反应(杂质不参与反应)2Na2O2+2X═4NaOH+O2↑,生成气体质量与时间的关系如图所示。
①物质X的化学式为________。
②计算该样品中过氧化钠的质量分数。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解