下载高清试卷
【2021年四川省攀枝花市中考化学试卷】-第1页
试卷格式:2021年四川省攀枝花市中考化学试卷.PDF
试卷热词:最新试卷、2021年、四川试卷、攀枝花市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.下列物质中属于合成材料的是( )
- A. 棉花
- B. 羊毛
- C. 塑料
- D. 木材
2.下列食物中富含蛋白质的是( )
- A. 牛肉
- B. 土豆
- C. 黄瓜
- D. 菠菜
3.下列图标中,加油站、面粉加工厂必须张贴的是( )
- A.

- B.

- C.

- D.

4.下列各物质应用过程中的变化,不是化学变化的是( )
- A. 炭黑制墨
- B. 粮食酿酒
- C. 醋除水垢
- D. 焦炭炼铁
5.氮肥能促进农作物的茎、叶生长茂盛。下列化肥中,属于氮肥的是( )
- A. K2SO4
- B. NH4HCO3
- C. Ca(H2PO4)2
- D. KCl
6.下列各组物质中,造成酸雨的主要物质是( )
- A. 一氧化碳和二氧化碳
- B. 二氧化硫和二氧化氮
- C. 二氧化硫和一氧化碳
- D. 甲烷和一氧化碳
7.下列物质中,由分子构成的是( )
- A. 氯化钠
- B. 金刚石
- C. 干冰
- D. 银
8.下列有关用火与安全的做法中,正确的是( )
- A. 火灾逃生时弯腰前行
- B. 油锅着火时用水浇灭
- C. 燃气泄漏时点火检查
- D. 煤火取暖时紧闭门窗
9.某同学在实验室制取二氧化碳的过程中,进行制取、收集、检验、验满的四步操作如下图所示,其中正确的是( )
- A.
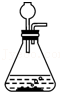 制取
制取 - B.
 收集
收集 - C.
 检验
检验 - D.
 验满
验满
10.攀枝花市是我国的“钒钛之都”。钒、钛元素信息如下图。下列有关说法中,不正确的是( )
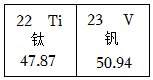

- A. 钒、钛都是金属元素
- B. 钛元素的相对原子质量为22
- C. 钒的原子核内质子数为23
- D. 一个钒原子比一个钛原子多1个电子
11.下列化学方程式与对应的事实不相符的是( )
- A. 白磷在空气中燃烧:4P+5O22P2O5
点燃 - B. 用木炭还原氧化铜:2CuO+C2Cu+CO2↑
高温 - C. 向硫酸铜溶液中滴入氢氧化钠溶液产生沉淀:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
- D. 用含NaHCO3的药物治疗胃酸过多:2NaHCO3+H2SO4═Na2SO4+2CO2↑+2H2O
12.市场上有一种“快速冷冻剂”,主要成分是Na2SO4•10H2O和另一种固体X。原理是:固体混合后,X溶解在硫酸钠的结晶水中,迅速降温。X可能是下列物质中的( )
- A. 硝酸铵
- B. 烧碱
- C. 生石灰
- D. 食盐
13.将含有MgCl2的粗盐配制成溶液后进行提纯,最终得到食盐晶体,步骤如图:
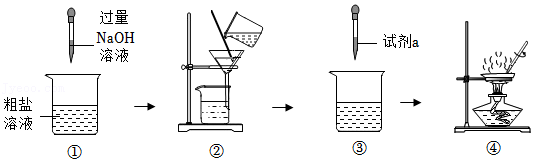
下列说法中,不正确的是( )

下列说法中,不正确的是( )
- A. 步骤①中发生复分解反应
- B. 步骤②中得到的滤渣是Mg(OH)2
- C. 步骤③中滴加的“试剂a”可以是稀硫酸
- D. 步骤④不断搅拌的目的是防止因局部温度过高,造成液滴飞溅
14.我国科学家利用新型催化剂将CO2转化为液体燃料,转化的微观示意图如下:
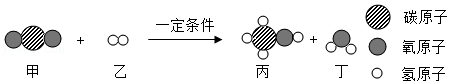
关于该反应,下列说法正确的是( )

关于该反应,下列说法正确的是( )
- A. 甲、丙、丁都属于氧化物
- B. 反应前后分子总数不变
- C. 反应生成的丙和丁的分子个数比为2:1
- D. 参加反应的甲和乙的质量比为22:3
15.某碳酸氢钠样品中含有少量碳酸钠杂质。取17.5g样品,加热时发生反应:2NaHCO3
Na2CO3+CO2↑+H2O,使生成的水完全被浓硫酸吸收,当固体质量不再减少时,所得溶液中溶质的质量分数为( )
| △ |
- A. 10.7%
- B. 11.3%
- C. 15.8%
- D. 16.5%
16.已知:Fe2O3可作KClO3分解制O2的催化剂。称取0.49gFe2O3与 agKClO3充分混合后,加热至KClO3完全分解,冷却至室温,称得剩余固体的质量为1.98g。下列关于该实验的说法中( )
- A. a=2.45
- B. 该反应生成0.96gO2
- C. 剩余固体中含有1.49gKCl
- D. 称取的KClO3与Fe2O3的质量比是5:2
17.用化学用语填空:
(1)4个钾离子 。
(2)4个二氧化硫分子 。
(3)四氧化三铁的化学式 。
(4)由32个碳原子构成的单质分子 。
(1)4个钾离子 。
(2)4个二氧化硫分子 。
(3)四氧化三铁的化学式 。
(4)由32个碳原子构成的单质分子 。
18.化学与生活密切相关。
(1)猪肉在存放过程中的pH变化如下表:
新鲜猪肉在变质过程中酸性逐渐变 (填“强”或“弱”)。
(2)汽车使用尿素[CO(NH2)2]可有效降低尾气中的NO2含量,主要原理是:①尿素水溶液在高温下发生反应:CO(NH2)2+X
CO2+2NH3;②NH3与NO2发生反应:8NH3+6NO2
7Y+12H2O。则:X、Y的化学式分别是 、 。
(1)猪肉在存放过程中的pH变化如下表:
| 名称 | 新鲜猪肉 | 次鲜猪肉 | 变质猪肉 |
| pH | 5.8~6.2 | 6.3~6.6 | >6.7 |
新鲜猪肉在变质过程中酸性逐渐变 (填“强”或“弱”)。
(2)汽车使用尿素[CO(NH2)2]可有效降低尾气中的NO2含量,主要原理是:①尿素水溶液在高温下发生反应:CO(NH2)2+X
| 高温 |
| 催化剂 |
19.观察图1、图2中各微粒的结构示意图,按要求回答问题:

(1)图1是溴的原子结构示意图,x= ;溴的化学性质与图2中 (填字母序号)的化学性质相似。
(2)图2所示微粒中,共有 种元素,其中 (填字母序号)属于稀有气体原子。
(3)由图2中的阴、阳离子构成的化合物的化学式是 。

(1)图1是溴的原子结构示意图,x= ;溴的化学性质与图2中 (填字母序号)的化学性质相似。
(2)图2所示微粒中,共有 种元素,其中 (填字母序号)属于稀有气体原子。
(3)由图2中的阴、阳离子构成的化合物的化学式是 。
20.硝酸钾、氯化钾的溶解度曲线如图所示。

(1)t1℃时,溶解度大小关系是:KNO3 KCl(填“>”“=”或“<”)。
(2)t2℃时,甲是KNO3饱和溶液,乙是KCl饱和溶液。溶液中溶质的质量分数:甲 乙(填“>”“=”或“<”)。
(3)t3℃时,将120gKNO3放入100g水中,充分溶解后,所得溶液的质量为 g。
(4)t3℃时,要分别从KNO3和KCl两种饱和溶液中获得等质量的无水盐晶体,蒸发水较多的是 溶液。

(1)t1℃时,溶解度大小关系是:KNO3 KCl(填“>”“=”或“<”)。
(2)t2℃时,甲是KNO3饱和溶液,乙是KCl饱和溶液。溶液中溶质的质量分数:甲 乙(填“>”“=”或“<”)。
(3)t3℃时,将120gKNO3放入100g水中,充分溶解后,所得溶液的质量为 g。
(4)t3℃时,要分别从KNO3和KCl两种饱和溶液中获得等质量的无水盐晶体,蒸发水较多的是 溶液。
21.氢气是最理想的高热值清洁能源,制取与贮存是氢能源利用领域的研究热点。
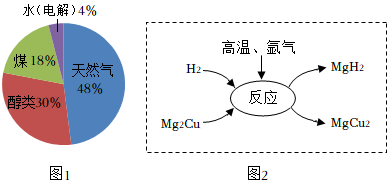
(1)全球制氢工业中,不同原料制得的氢气比例如图1。目前氢气的最主要来源是 。
(2)2021年3月我国政府承诺:2060年前实现“碳中和”。“减少碳排放”是实现“碳中和”的重要措施。从碳排放的角度看,由化石能源制得的氢气被称为“灰氢”,而电解水制得的氢气被称为“绿氢”的原因是 。
(3)将制备的氢气直接加压贮存在贮氢罐中,从构成物质的微粒视角分析,氢气能被压缩的原因 。
(4)利用贮氢合金Mg2Cu通过化学反应贮存氢气如图2。在高温下通入氩气做保护气的目的是 。该贮氢反应的化学方程式为 。

(1)全球制氢工业中,不同原料制得的氢气比例如图1。目前氢气的最主要来源是 。
(2)2021年3月我国政府承诺:2060年前实现“碳中和”。“减少碳排放”是实现“碳中和”的重要措施。从碳排放的角度看,由化石能源制得的氢气被称为“灰氢”,而电解水制得的氢气被称为“绿氢”的原因是 。
(3)将制备的氢气直接加压贮存在贮氢罐中,从构成物质的微粒视角分析,氢气能被压缩的原因 。
(4)利用贮氢合金Mg2Cu通过化学反应贮存氢气如图2。在高温下通入氩气做保护气的目的是 。该贮氢反应的化学方程式为 。
22.高纯氧化铁(Fe2O3)是电子工业的重要材料。用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁的生产流程如图。
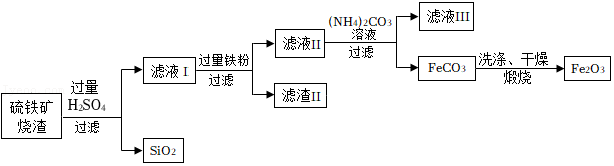
已知:Fe+Fe2(SO4)3═3FeSO4。回答下列问题:
(1)加入过量铁粉的作用是:① ,② 。
(2)滤液Ⅱ中加入(NH4)2CO3溶液,发生反应的化学方程式是 。
(3)煅烧时FeCO3与空气中的O2反应生成Fe2O3和CO2,反应的化学方程式是 。

已知:Fe+Fe2(SO4)3═3FeSO4。回答下列问题:
(1)加入过量铁粉的作用是:① ,② 。
(2)滤液Ⅱ中加入(NH4)2CO3溶液,发生反应的化学方程式是 。
(3)煅烧时FeCO3与空气中的O2反应生成Fe2O3和CO2,反应的化学方程式是 。
23.硝酸钙[Ca(NO3)2]在农业上常用作植物快速补钙剂。利用纯度较高的石灰石制备硝酸钙晶体的一种流程如下:
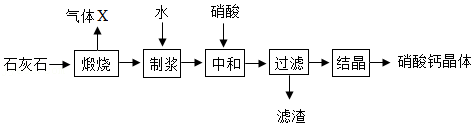
已知:①硝酸易挥发,受热会分解;②硝酸钙溶液呈中性,以滤渣形式除去。
回答下列问题:
(1)气体X为 (填化学式)。
(2)“制浆”所得的混合物属于 (填选项字母)。
A.溶液 B.悬浊液 C.乳浊液
(3)“中和”步骤发生反应的化学方程式是 。
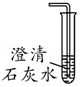
(4)工业生产中根据以下两项指标判断“中和”反应恰好完全发生:容器内混合物变澄清和 。
(5)若用该石灰石与硝酸反应也可制得硝酸钙,但产生大量NO2气体,硝酸利用率较低。产生NO2的原因是 。

已知:①硝酸易挥发,受热会分解;②硝酸钙溶液呈中性,以滤渣形式除去。
回答下列问题:
(1)气体X为 (填化学式)。
(2)“制浆”所得的混合物属于 (填选项字母)。
A.溶液 B.悬浊液 C.乳浊液
(3)“中和”步骤发生反应的化学方程式是 。
(4)工业生产中根据以下两项指标判断“中和”反应恰好完全发生:容器内混合物变澄清和 。
(5)若用该石灰石与硝酸反应也可制得硝酸钙,但产生大量NO2气体,硝酸利用率较低。产生NO2的原因是 。
24.某学习小组探究氯气(Cl2)的性质时发现:氯气能使用水润湿的品红试纸(染有品红颜料的滤纸)褪色。小组同学对“氯水中什么成分使品红试纸褪色”开展探究。
【查阅资料】①Cl2是黄绿色气体,能溶于水,Cl2溶于水所得溶液称为氯水,氯水呈黄绿色;
②溶于水的部分氯气发生反应:Cl2+H2O═HCl+HClO(次氯酸)。
【讨论】
①小组同学认为氯水中含有的成分是:H2O、Cl2、HCl、HClO;
②用水润湿品红试纸时,品红试纸不褪色,说明是氯水中的其它成分使品红试纸褪色。
(1)【提出猜想】猜想1:氯水中的 使品红试纸褪色;
猜想2:氯水中的盐酸使品红试纸褪色;
猜想3:氯水中的次氯酸(HClO)使品红试纸褪色。
【实验探究】
(2) ;
(3) 。
(4)【实验结论】氯水中使品红试纸褪色的物质是 。
【拓展】
(5)向氯水中滴加紫色石蕊溶液,观察到的现象是溶液先变 色后褪色。
(6)将氯气通入NaOH溶液中,生成的盐除NaCl外,还有 。
【查阅资料】①Cl2是黄绿色气体,能溶于水,Cl2溶于水所得溶液称为氯水,氯水呈黄绿色;
②溶于水的部分氯气发生反应:Cl2+H2O═HCl+HClO(次氯酸)。
【讨论】
①小组同学认为氯水中含有的成分是:H2O、Cl2、HCl、HClO;
②用水润湿品红试纸时,品红试纸不褪色,说明是氯水中的其它成分使品红试纸褪色。
(1)【提出猜想】猜想1:氯水中的 使品红试纸褪色;
猜想2:氯水中的盐酸使品红试纸褪色;
猜想3:氯水中的次氯酸(HClO)使品红试纸褪色。
【实验探究】
| 实验操作 | 实验现象 | 结论 |
| (2)________ | 试纸不褪色 | 猜想1不成立 |
| 把品红试纸放入盐酸中 | (3)________ | 猜想2不成立 |
(2) ;
(3) 。
(4)【实验结论】氯水中使品红试纸褪色的物质是 。
【拓展】
(5)向氯水中滴加紫色石蕊溶液,观察到的现象是溶液先变 色后褪色。
(6)将氯气通入NaOH溶液中,生成的盐除NaCl外,还有 。
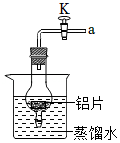
25.某兴趣小组在实验中发现:用砂纸打磨去除氧化物后的铝片不与冷水反应,加热也无明显现象。于是对“Al是否能与水反应”进行实验探究。
【讨论】铝的金属活动性较强,铝不与冷水反应的原因可能是砂纸打磨后能迅速重新生成致密的氧化膜,因此只有防止其重新生成氧化膜才能证明Al是否能与水反应。
【查阅资料】①将铝片浸入氯化汞(HgCl2)溶液中,形成“铝汞齐”(铝汞合金)可破坏铝表面的氧化膜且能防止其重新生成
【实验探究】
①将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右,取出,立即用蒸馏水冲洗干净。
②将处理后的铝片加入到蒸馏水中(如图),铝片表面生成大量气泡、周围出现白色沉淀[Al(OH)3]。
③在导管口a处涂肥皂水,发现导管口有气泡形成,气泡离开导管后迅速上升,用燃着的木条点燃气泡,发出爆鸣声。
【实验结论】铝能与水反应。
【实验反思】
(1)铝与氯化汞溶液发生反应的化学方程式是 。
(2)该实验中,铝与水反应的化学方程式是 。
(3)在铝与水反应的过程中,若关闭导管上的活塞K,反应停止。其原理是 。
(4)汞及其化合物有毒。用硫粉将汞处理成难溶于水的HgS,用Na2S溶液处理使用过的氯化汞废液。Na2S溶液与氯化汞发生复分解反应的化学方程式是 。
【讨论】铝的金属活动性较强,铝不与冷水反应的原因可能是砂纸打磨后能迅速重新生成致密的氧化膜,因此只有防止其重新生成氧化膜才能证明Al是否能与水反应。
【查阅资料】①将铝片浸入氯化汞(HgCl2)溶液中,形成“铝汞齐”(铝汞合金)可破坏铝表面的氧化膜且能防止其重新生成
【实验探究】
①将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右,取出,立即用蒸馏水冲洗干净。
②将处理后的铝片加入到蒸馏水中(如图),铝片表面生成大量气泡、周围出现白色沉淀[Al(OH)3]。
③在导管口a处涂肥皂水,发现导管口有气泡形成,气泡离开导管后迅速上升,用燃着的木条点燃气泡,发出爆鸣声。
【实验结论】铝能与水反应。
【实验反思】
(1)铝与氯化汞溶液发生反应的化学方程式是 。
(2)该实验中,铝与水反应的化学方程式是 。
(3)在铝与水反应的过程中,若关闭导管上的活塞K,反应停止。其原理是 。
(4)汞及其化合物有毒。用硫粉将汞处理成难溶于水的HgS,用Na2S溶液处理使用过的氯化汞废液。Na2S溶液与氯化汞发生复分解反应的化学方程式是 。

26.Na2S2O4(连二亚硫酸钠)是常用的食品漂白剂。我国GB2760标准规定:使用Na2S2O4作食品漂白剂,最大使用量0.40g/kg。
回答以下问题:
(1)Na2S2O4中硫元素的化合价为 。
(2)Na2S2O4的相对分子质量为 。
(3)要制作200kg糖果,允许添加的Na2S2O4最大质量为 g。
回答以下问题:
(1)Na2S2O4中硫元素的化合价为 。
(2)Na2S2O4的相对分子质量为 。
(3)要制作200kg糖果,允许添加的Na2S2O4最大质量为 g。
27.已知:BaO2(过氧化钡),白色粉末,微溶于水
实验室制取少量过氧化氢溶液的方法是:向56.4g某浓度的稀硫酸中逐渐加入一定量的BaO2,搅拌,发生反应:BaO2+H2SO4═BaSO4+H2O2,当恰好完全反应时生成23.3gBaSO4,静置,过滤,得过氧化氢溶液。(提示:①不考虑H2O2分解;②不考虑实验过程中溶液的损失。)计算(写出解题过程):
(1)反应后所得溶液中溶质的质量分数。
(2)如果将所得溶液稀释成质量分数为3%的医用双氧水,需加入水的质量是多少?(结果精确到0.1g)。
实验室制取少量过氧化氢溶液的方法是:向56.4g某浓度的稀硫酸中逐渐加入一定量的BaO2,搅拌,发生反应:BaO2+H2SO4═BaSO4+H2O2,当恰好完全反应时生成23.3gBaSO4,静置,过滤,得过氧化氢溶液。(提示:①不考虑H2O2分解;②不考虑实验过程中溶液的损失。)计算(写出解题过程):
(1)反应后所得溶液中溶质的质量分数。
(2)如果将所得溶液稀释成质量分数为3%的医用双氧水,需加入水的质量是多少?(结果精确到0.1g)。
查看全部题目