下载高清试卷
【2021-2022学年湖北省武汉市汉阳区九年级(上)期中化学试卷】-第1页
试卷格式:2021-2022学年湖北省武汉市汉阳区九年级(上)期中化学试卷.PDF
试卷热词:最新试卷、2021年、湖北试卷、武汉市试卷、化学试卷、九年级上学期试卷、期中试卷、初中试卷

扫码查看解析
试卷题目
1.下列爆炸或炸裂是由化学变化引起的是( )
- A. 夏天汽车爆胎
- B. 玻璃骤冷炸裂
- C. 管道煤气爆炸
- D. 气球充气爆炸
2.下列物质中不属于我国《环境空气质量标准》基本监控项目的是( )
- A. 臭氧
- B. PM2.5
- C. 二氧化硫
- D. 二氧化碳
3.下列物质在氧气里燃烧,能生成黑色固体的是( )
- A. 铁丝
- B. 硫
- C. 木炭
- D. 红磷
4.下列图示的实验操作中,正确的是( )
- A.
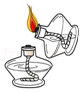 点燃酒精灯
点燃酒精灯 - B.
 过滤
过滤 - C.
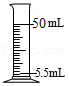 量5.5mL液体
量5.5mL液体 - D.
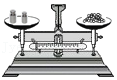 称量10.05g固体
称量10.05g固体
5.下列有关空气说法错误的是( )
- A. 氧气有助燃性,常用作燃料
- B. 食品包装中充入氮气用来防腐
- C. 利用稀有气体可制作霓虹灯
- D. 铁丝在氧气中燃烧生成Fe3O4
6.下列实验均与水有关,其相应描述正确的是( )
- A.
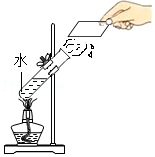 属于化学变化
属于化学变化 - B.
 净化后可得纯水
净化后可得纯水 - C.
 证明水的组成
证明水的组成 - D.
 氢气验纯
氢气验纯
7.十一长假,小明和爸爸妈妈一起到西藏去旅游。导游建议爷爷奶奶带上压缩罐包装的富氧气体。下列关于压缩罐富氧气体说法正确的是( )
- A. 富氧气体被压缩分子之间间隔减小
- B. 富氧气体被压缩分子本身发生变化
- C. 富氧气体被压缩分子停止运动
- D. 富氧气体被压缩分子变小
8.下列对化学用语的描述错误的是( )
- A. 二氧化碳的分子模型:

- B. 氟离子:F
- C. 氧化汞是由分子构成的氧化物
- D. NaCl是由离子构成的纯净物
9.图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
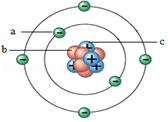

- A. 决定该原子种类的粒子是b
- B. 原子中b与c的数目一定相同且均为6
- C. 原子中a与c的数目一定相同
- D. 原子的质量集中在a和c上
10.湖北恩施有“硒都”之称,硒是人体必需的微量元素,严重缺硒可能诱发皮肤病和癌症,甲图是其原子结构示意图,乙图摘自元素周期表,部分信息略去。据此判断下列叙述不正确的是( )
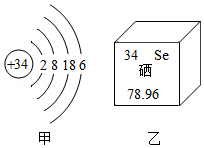

- A. 硒的质子数为34
- B. Se是非金属元素
- C. 硒原子的相对原子质量为78.96g
- D. 硒酸钠(Na2SeO4)中硒元素的化合价为+6
11.如图所示,甲、乙两图都是电解水的简易装置,下列说法不正确的是( )


- A. 试管B中产生的气体是O2
- B. 装置乙相对甲的优点是便于检验气体
- C. 电解水时往往加入少量硫酸或氢氧化钠,作用是增强导电性
- D. 电解水的反应是分解反应,氢气在纯氧中安静燃烧的反应是化合反应
12.逻辑推理是化学学习中常用的思维方法,下列推理中正确的是( )
- A. 氧化物中一定含氧元素,含氧元素的化合物一定是氧化物
- B. 单质中只含有一种元素,则只含有一种元素的物质一定是单质
- C. 化合物是由不同元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
- D. 电解水产生氢气和氧气,所以水一定由氢气和氧气组成
13.下列实验能够用于直接验证质量守恒定律的是( )
- A.
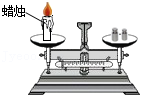
- B.
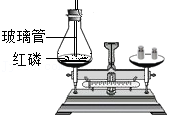
- C.

- D.
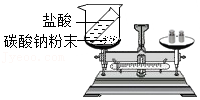
14.水蒸气和天然气可制备氢气,反应前后分子种类的微观示意图如图所示,下列说法正确的是( )


- A. 反应后分子数目增多
- B. 参加反应的反应物分子数之比为1:2
- C. 该反应为分解反应
- D. 生成的CO和H2质量比为14:1
15.教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。教师分析该实验中选择使用汞的优点有:①汞在汞槽中为液态,能起到液封的作用。②汞在加热的条件下,只与氧气反应。③能将密闭装置内空气中的氧气几乎耗尽。④氧化汞常温下为固体,对气体的体积影响很小可以忽略不计。某同学通过查阅汞和氧化汞的相关知识,如图2所示发现了选择汞还有其它优点,下面不属于汞的优点的是( )


- A. 生成的氧化汞加热分解又能得到汞和氧气
- B. 氧化汞的密度小于汞且不溶于汞,易与汞分离
- C. 汞受热后易挥发,在玻璃钟罩中产生固体氧化汞
- D. 汞与氧化汞的颜色、状态有差别,易于判断反应是否完全
16.在密闭容器内,有甲、乙、丙、丁四种物质,在一定条件下充分混合反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是( )
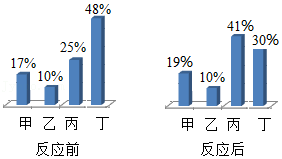

- A. 丁一定是化合物
- B. 甲和丙可能存在相同的元素
- C. 乙可能是该反应的催化剂
- D. 生成的甲、丙两物质的相对分子质量比为8:1
17.在过氧化氢溶液制氧气的实验过程中,小明没有加入二氧化锰,直接用酒精灯加热一会儿,测得反应后的物质中氧元素的质量分数你认为最不可能的是( )
- A. 88%
- B. 89%
- C. 90%
- D. 91%
18.用化学用语填空:
(1)2个汞原子 ;
(2)3个硫离子 ;
(3)地壳中含量最高的非金属元素为 ;
(4)核电荷数分别为8、13的两种元素所形成的化合物 ;
(5)含有2核10电子的阴离子 ;
(6)已知NO2﹣,请标出 N (NO2)3中加点N的化合价 。
(1)2个汞原子 ;
(2)3个硫离子 ;
(3)地壳中含量最高的非金属元素为 ;
(4)核电荷数分别为8、13的两种元素所形成的化合物 ;
(5)含有2核10电子的阴离子 ;
(6)已知NO2﹣,请标出 N (NO2)3中加点N的化合价 。
19.按要求正确书写化学方程式。
(1)实验室利用高锰酸钾制氧气 ;
(2)镁在高温下与TiCl4反应生成Ti和氯化镁 ;
(3)在验证质量守恒定律的实验中,小红用碳酸钠溶液与稀盐酸(主要成分为HCl)反应生成氯化钠、二氧化碳、水 。
(1)实验室利用高锰酸钾制氧气 ;
(2)镁在高温下与TiCl4反应生成Ti和氯化镁 ;
(3)在验证质量守恒定律的实验中,小红用碳酸钠溶液与稀盐酸(主要成分为HCl)反应生成氯化钠、二氧化碳、水 。
20.“生命吸管”可直接将污水净化为饮用水,主要处理步骤与自来水的净化过程相似,如图所示:(③中离子交换树脂的主要作用是去除重金属离子、软化水质)
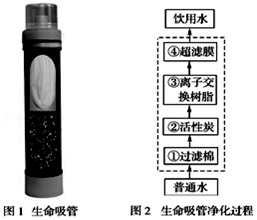
(1)②中活性炭的作用是 (填字母。下同),④中超滤膜的作用是 。
A.去除有害菌和部分病毒 B.吸附杂质 C.除去较大的不溶性杂质
(2)若无生命吸管,取用河水时,要降低水的硬度和杀灭病原微生物,生活中常采取 方法。此方法属于 变化(填“物理”或“化学”)
(3)下列图标表示“国家节水标志”的是 。


(1)②中活性炭的作用是 (填字母。下同),④中超滤膜的作用是 。
A.去除有害菌和部分病毒 B.吸附杂质 C.除去较大的不溶性杂质
(2)若无生命吸管,取用河水时,要降低水的硬度和杀灭病原微生物,生活中常采取 方法。此方法属于 变化(填“物理”或“化学”)
(3)下列图标表示“国家节水标志”的是 。

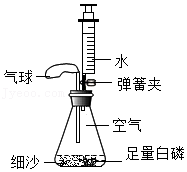
21.某实验小组利用如图所示装置测量空气中氧气体积分数,实验探究过程如下:
【提出问题】氧气体积约占空气总体积的多少?
【实验准备】锥形瓶内空气体积为240mL,注射器中水的体积为50mL,该装置气密性良好。
【实验探究】装入药品,按如图所示连接好仪器,夹紧弹簧夹。先将锥形瓶底部放入热水中,白磷很快被引燃,然后将锥形瓶从热水中取出。
【现象分析】
(1)实验中使用了足量白磷,目的是 ,足量的白磷在锥形瓶中未能全部燃烧,说明瓶内剩余气体 燃烧(填“支持”或“不支持”),写出白磷燃烧的化学方程式 。
(2)在整个实验过程中,可观察到气球的变化是 。
待白磷熄灭、锥形瓶冷却到室温后,打开弹簧夹,还可观察到的现象是:①注射器中的水自动喷射出来,②当注射器中的水还剩约6mL时停止下流。
(3)【得出绩论】氧气占空气总体积分数为 (保留一位小数)。
(4)【误差分析】根据上述实验测定空气中的氧气体积分数,分析该实验中可能存在的问题是 。
【提出问题】氧气体积约占空气总体积的多少?
【实验准备】锥形瓶内空气体积为240mL,注射器中水的体积为50mL,该装置气密性良好。
【实验探究】装入药品,按如图所示连接好仪器,夹紧弹簧夹。先将锥形瓶底部放入热水中,白磷很快被引燃,然后将锥形瓶从热水中取出。
【现象分析】
(1)实验中使用了足量白磷,目的是 ,足量的白磷在锥形瓶中未能全部燃烧,说明瓶内剩余气体 燃烧(填“支持”或“不支持”),写出白磷燃烧的化学方程式 。
(2)在整个实验过程中,可观察到气球的变化是 。
待白磷熄灭、锥形瓶冷却到室温后,打开弹簧夹,还可观察到的现象是:①注射器中的水自动喷射出来,②当注射器中的水还剩约6mL时停止下流。
(3)【得出绩论】氧气占空气总体积分数为 (保留一位小数)。
(4)【误差分析】根据上述实验测定空气中的氧气体积分数,分析该实验中可能存在的问题是 。

22.为探究分子的运动及影响分子运动速率的因素,某同学设计了如图两种实验方案,请回答有关问题。

【实验方案一】见图1
(1)观察到该实验的现象是 。
(2)该方案的不足之处是 。(说出一点即可)
【实验方案二】见图2
小张利用药片板自制四穴点滴板,先向自制四穴点滴板2、3、4空穴滴加5滴酚酞溶液,然后向编号1的空穴中滴加5滴浓氨水,快速把四穴点滴板放入试管中并用橡胶塞塞紧试管口。
(3)观察到该实验与方案一现象不同点是 。
(4)由上述两实验可得出分子尽管很小,但分子是在运动的,不同的分子运动速率是不同的,请你写出氨分子的化学式 。

【实验方案一】见图1
(1)观察到该实验的现象是 。
(2)该方案的不足之处是 。(说出一点即可)
【实验方案二】见图2
小张利用药片板自制四穴点滴板,先向自制四穴点滴板2、3、4空穴滴加5滴酚酞溶液,然后向编号1的空穴中滴加5滴浓氨水,快速把四穴点滴板放入试管中并用橡胶塞塞紧试管口。
(3)观察到该实验与方案一现象不同点是 。
(4)由上述两实验可得出分子尽管很小,但分子是在运动的,不同的分子运动速率是不同的,请你写出氨分子的化学式 。
23.小明进行H2O2溶液制O2的实验探究,请你按照要求回答问题:

(1)乙所指仪器名称: 。
(2)用过氧化氢制氧气并收集一瓶干燥的O2,应选择 (填字母)。
(3)若用如图装置收集一瓶氧气,气体应从 (填a或b)端进入集气瓶。
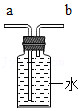
(4)下列不能做过氧化氢溶液制氧气的催化剂的是 。
A. FeCl3
B. 硫酸铜
C. 红砖粉末
D. KCl
(5)与高锰酸钾制O2的装置相比,该实验具有的优点 (写出两条)。

(1)乙所指仪器名称: 。
(2)用过氧化氢制氧气并收集一瓶干燥的O2,应选择 (填字母)。
(3)若用如图装置收集一瓶氧气,气体应从 (填a或b)端进入集气瓶。

(4)下列不能做过氧化氢溶液制氧气的催化剂的是 。
A. FeCl3
B. 硫酸铜
C. 红砖粉末
D. KCl
(5)与高锰酸钾制O2的装置相比,该实验具有的优点 (写出两条)。
24.某化学兴趣小组选择燃烧镁带进行定量实验探究。
【资料】镁除了与空气中的氧气反应外,还可与空气中的氮气在点燃条件下生成固体氮化镁Mg3N2,化学方程式为:3Mg+N2
Mg3N2;
第一小组同学称量了0.24g镁带,在空气中点燃,完全燃烧后,称量所得固体质量为0.32g。第二小组同学觉得第一小组的实验数据不合理,分析原因并设计了如图所示的实验,实验步骤如下:
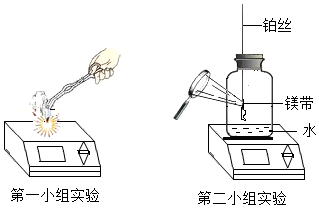
步骤一、将0.24g打磨光亮的镁带固定在穿过瓶塞的铂丝上(铂丝不反应),广口瓶盛满氧气并塞紧瓶塞(如图),瓶底留有适量水;
步骤二、用聚光镜引燃镁带,待其完全燃烧后,充分振荡瓶内的水再静置,瓶内白烟完全消失,有白色固体沉淀在瓶底;(此条件下氧化镁难溶于水且不反应)
步骤三、将瓶内的全部固液混合物过滤,干燥滤纸及其上面的滤渣后一起称量,总质量为1.25g。
请回答下列问题:
(1)写出镁带在氧气中燃烧的化学方程式 。
(2)关于两个小组的实验说法正确的是 。
A.第一组实验数据不合理是因为0.32g>0.24g,不遵循质量守恒定律
B.第二组实验中的水既可加速装置冷却,又可通过水帮助收集瓶内的生成物
C.镁带燃烧时白烟飘散的现象说明分子是永不停息作无规则运动的
D.通过第一组实验数据可推测,镁在空气中燃烧一定还生成了氮化镁,另外可能有部分固体生成物未落到电子天平上
E.第二小组同学只需称量镁带燃烧前后封闭的广口瓶体系总质量,即可验证质量守恒定律
(3)第二小组的同学在进行实验时,若未通过打磨去除镁带表面的氧化膜,最后他们称量的滤纸和滤渣总质量会 1.25g(填>、<或=)。
(4)根据第二小组同学实验数据,若要得到与镁反应的氧气的质量,还必须测量,若实验结果与质量守恒相吻合,请推测以上测量值为 g。
【资料】镁除了与空气中的氧气反应外,还可与空气中的氮气在点燃条件下生成固体氮化镁Mg3N2,化学方程式为:3Mg+N2
| 点燃 |
第一小组同学称量了0.24g镁带,在空气中点燃,完全燃烧后,称量所得固体质量为0.32g。第二小组同学觉得第一小组的实验数据不合理,分析原因并设计了如图所示的实验,实验步骤如下:

步骤一、将0.24g打磨光亮的镁带固定在穿过瓶塞的铂丝上(铂丝不反应),广口瓶盛满氧气并塞紧瓶塞(如图),瓶底留有适量水;
步骤二、用聚光镜引燃镁带,待其完全燃烧后,充分振荡瓶内的水再静置,瓶内白烟完全消失,有白色固体沉淀在瓶底;(此条件下氧化镁难溶于水且不反应)
步骤三、将瓶内的全部固液混合物过滤,干燥滤纸及其上面的滤渣后一起称量,总质量为1.25g。
请回答下列问题:
(1)写出镁带在氧气中燃烧的化学方程式 。
(2)关于两个小组的实验说法正确的是 。
A.第一组实验数据不合理是因为0.32g>0.24g,不遵循质量守恒定律
B.第二组实验中的水既可加速装置冷却,又可通过水帮助收集瓶内的生成物
C.镁带燃烧时白烟飘散的现象说明分子是永不停息作无规则运动的
D.通过第一组实验数据可推测,镁在空气中燃烧一定还生成了氮化镁,另外可能有部分固体生成物未落到电子天平上
E.第二小组同学只需称量镁带燃烧前后封闭的广口瓶体系总质量,即可验证质量守恒定律
(3)第二小组的同学在进行实验时,若未通过打磨去除镁带表面的氧化膜,最后他们称量的滤纸和滤渣总质量会 1.25g(填>、<或=)。
(4)根据第二小组同学实验数据,若要得到与镁反应的氧气的质量,还必须测量,若实验结果与质量守恒相吻合,请推测以上测量值为 g。
25.长征二号F遥十二运载火箭,它有着“神箭”美誉,该火箭的燃料是偏二甲肼(C2H8N2),氧化剂是四氧化二氮,四氧化二氮常温下是一种气体,30.0g偏二甲肼与92.0g四氧化二氮恰好反应生成44.0g二氧化碳、36.0g水和一定质量的X,回答下列相关问题:
(1)偏二甲肼属于 (填“混合物”、“化合物”、“氧化物”)。
(2)四氧化二氮是由 构成的(填“分子”、“原子”、“离子”)。
(3)X的化学式为 ,其中氮元素的化合价为 。
(1)偏二甲肼属于 (填“混合物”、“化合物”、“氧化物”)。
(2)四氧化二氮是由 构成的(填“分子”、“原子”、“离子”)。
(3)X的化学式为 ,其中氮元素的化合价为 。
26.碱式碳酸铜【Cu2(OH)2CO3】用作农药防治小麦黑穗病。已知碱式碳酸铜受热分解生成氧化铜、水和二氧化碳。回答下列相关问题:
(1)Cu2(OH)2CO3中含有 种元素。
(2)Cu2(OH)2CO3中质量分数最大的元素是 。
(3)碱式碳酸铜受热分解的化学方程式为 。
(4)充分加热30.0g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3:4,则该反应生成水和二氧化碳的质量之和为 g。
(1)Cu2(OH)2CO3中含有 种元素。
(2)Cu2(OH)2CO3中质量分数最大的元素是 。
(3)碱式碳酸铜受热分解的化学方程式为 。
(4)充分加热30.0g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3:4,则该反应生成水和二氧化碳的质量之和为 g。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解