下载高清试卷
【2020-2021学年山东省枣庄市市中区九年级(上)期中化学试卷】-第1页
试卷格式:2020-2021学年山东省枣庄市市中区九年级(上)期中化学试卷.PDF
试卷热词:最新试卷、2021年、山东试卷、枣庄市试卷、化学试卷、九年级上学期试卷、期中试卷、初中试卷
扫码查看解析
试卷题目
1.请答题的同学深呼吸,平静一下情绪,刚才吸入的空气中含量最多的气体是( )
- A. 氧气
- B. 稀有气体
- C. 氮气
- D. 二氧化碳
2.“绿水青山就是金山银山”,水是人类不可缺少的宝贵资源,人人都要树立节约用水的意识。下列标志与节约用水有关的是( )
- A.

- B.

- C.

- D.

3.成语是中华民族智慧的结晶。下列成语所描述的变化涉及化学变化的是( )
- A. 刻舟求剑
- B. 滴水成冰
- C. 抱薪救火
- D. 聚沙成塔
4.1869年发现元素周期律并编制出元素周期表的科学家是( )
- A.
 拉瓦锡
拉瓦锡 - B.
 门捷列夫
门捷列夫 - C.
 道尔顿
道尔顿 - D.
 卢瑟福
卢瑟福
5.下列实验操作中,正确的是( )
- A.
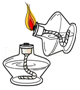 点燃酒精灯
点燃酒精灯 - B.
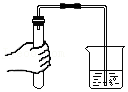 检查装置气密性
检查装置气密性 - C.
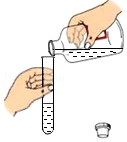 倾倒液体
倾倒液体 - D.
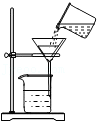 过滤
过滤
6.蒸馏水不能养鱼,是因为蒸馏水中不含有( )
- A. 氧元素
- B. 氧原子
- C. 水分子
- D. 氧分子
7.如图为地壳中元素含量分布图,其中能代表氧元素的是( )
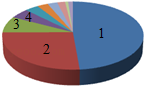

- A. 1
- B. 2
- C. 3
- D. 4
8.已知一种氧原子,原子核内有8个质子和10个中子,则该氧原子中,核外电子数为( )
- A. 2
- B. 8
- C. 10
- D. 18
9.下列物质的用途中,利用了其化学性质的是( )
- A. 氧气用于医疗急救
- B. 液氮冷藏血液
- C. 铜用作制导线
- D. 黄金用作制首饰
10.人体缺乏维生素A易得夜盲症。维生素A的化学式为C20H30O,下列说法不正确的是( )
- A. 维生素A于化合物
- B. 维生素A中含有51个原子
- C. 维生素A中氧元素的质量分数最小
- D. 维生素A由C、H、O三种元素组成
11.如图是元素X的一种粒子结构示意图,下列说法正确的是( )
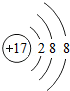

- A. X是金属元素
- B. 该粒子最外电子层已达到稳定结构
- C. 该粒子的核电荷数为18
- D. 该粒子可表示为X+
12.下列说法中正确的是( )
- A. 元素是质子数相同的一类粒子的总称
- B. 同种元素的原子核内质子数与中子数一定相等
- C. 某物质中只含有一种元素,该物质一定是一种单质
- D. 同种元素在同一物质中化合价可能不同
13.用微观示意图表示空气的主要成分(已知在同温同压下,气体的体积之比等于分子个数之比),如图中最合理的是( )
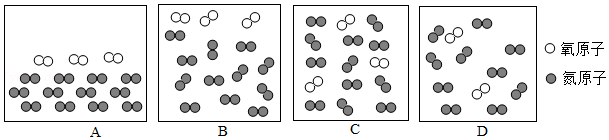

- A. A
- B. B
- C. C
- D. D
14.将燃着的蜡烛放在如右图1所示的密闭容器中,同时用氧气传感器测出密闭容器中氧气含量的变化如图2所示,下列说法正确的是( )
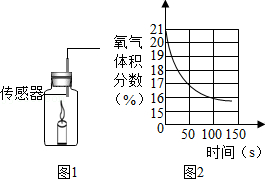

- A. 蜡烛燃烧前瓶内只有氧气
- B. 蜡烛熄灭是因为瓶内没有氧气
- C. 蜡烛熄灭后瓶内只剩二氧化碳气体
- D. 氧气浓度小于一定值时,蜡烛无法燃烧
15.下列关于溶液的说法错误的是( )
- A. 与乳化作用相比,溶解能使物质混合得更均匀
- B. 食盐的饱和溶液变成不饱和溶液后,溶质的质量分数不一定变小
- C. 一定温度下,搅拌可以增加食盐的溶解的质量
- D. 饱和溶液恒温蒸发部分水后,剩余溶液的溶质质量分数不变
16.某同学量取液体,视线与液体凹液面最低处保持水平,读数为18mL,倒出部分液体后,俯视凹液面最低处,读数为10mL,则该同学实际倒出来液体体积是( )
- A. 一定小于8mL
- B. 一定等于8mL
- C. 一定大于8mL
- D. 可能大于也可能小于8mL
17.下列物质按照带点元素的化合价由低到高的顺序排列的是( )
- A. K I O3、 I 2、K I
- B. HCl O3、HCl 、Cl 2
- C. Mn O2、K2Mn O4、KMn O4
- D. Na N O3、 N H4Cl、 N O2
18.19世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出了分子概念,他认为:①一切物质都是由分子组成的 ②分子是由原子构成的 ③原子不能独立存在④分子是保持物质化学性质的最小粒子 ⑤分子的质量等于构成它的原子的质量总和⑥分子在不停地运动 从你所学的知识上看,上述观点存在明显不足的是( )
- A. ①③
- B. ①②⑤
- C. ④⑤⑥
- D. ③⑤
19.由A、B两种元素组成的化合物中,A与B的质量之比为4:1,A与B的相对原子质量之比为12:1,则能表示此化合物化学式的是( )
- A. AB
- B. AB3
- C. AB4
- D. A2B
20.由Na2SO4、Na2SO3和Na2S三种物质组成的混合物中,测得氧元素的质量分数22%,则其中钠元素的质量分数为( )
- A. 23%
- B. 32.6%
- C. 46%
- D. 无法确定
21.用化学用语填空:
(1)水的化学式 ;
(2)两个氢原子 ;
(3)两个氧气分子 ;
(4)3个碳酸根离子 ;
(5)两个氯离子 ;
(6)+2价的镁元素 ;
(7)氧化铁 ;
(8)硝酸亚铁 ;
(9)氢氧化钙 ;
(10)地壳中含量最多的元素与最多的金属元素形成的化合物的化学式 。
(1)水的化学式 ;
(2)两个氢原子 ;
(3)两个氧气分子 ;
(4)3个碳酸根离子 ;
(5)两个氯离子 ;
(6)+2价的镁元素 ;
(7)氧化铁 ;
(8)硝酸亚铁 ;
(9)氢氧化钙 ;
(10)地壳中含量最多的元素与最多的金属元素形成的化合物的化学式 。
22.下列化学反应的符号表达式:
(1)电解水 ;
(2)镁条在氧气中燃烧 ;
(3)红磷在氧气中燃烧 ;
(4)氢气在氧气中燃烧 ;
(5)铜丝受热后变黑 ;
(6)其中属于分解反应的是 (填序号)。
(1)电解水 ;
(2)镁条在氧气中燃烧 ;
(3)红磷在氧气中燃烧 ;
(4)氢气在氧气中燃烧 ;
(5)铜丝受热后变黑 ;
(6)其中属于分解反应的是 (填序号)。
23.对下列8种物质进行分类:(填序号)
①清澈的海水②水银③冰水混合物④液态氮⑤新鲜的空气⑥五氧化二磷⑦人体呼出的气体⑧氯化钠
属于混合物的是 ;
属于纯净物的是 ;
属于单质的是 ;
属于化合物的是 。
①清澈的海水②水银③冰水混合物④液态氮⑤新鲜的空气⑥五氧化二磷⑦人体呼出的气体⑧氯化钠
属于混合物的是 ;
属于纯净物的是 ;
属于单质的是 ;
属于化合物的是 。
24.如表是元素周期表中第2、3周期的元素,请回答有关问题。
(1)下列各组元素具有相似化学性质的是 (填字母序号),所以它们属于同一 (填“周期”或“族”)。
A.Na、Cl
B.O、S
C.F、Cl
D.Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律 。
(3)第17号元素与第11号元素的原子形成化合物的化学式为 ;在该化合物中11号元素的化合价为 。
(4)某粒子的结构示意图为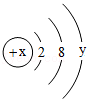 ,在化学变化中易失3个电子,该粒子的质子数为 ,其离子的符号为 。
,在化学变化中易失3个电子,该粒子的质子数为 ,其离子的符号为 。
(5)如图为元素汞的信息,从图中获得的信息正确的一项是 。
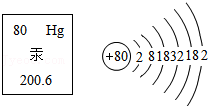
A.汞属于非金属元素
B.汞的核电荷数为80
C.汞的相对原子质量为200.6g
D.在化学反应中,汞原子容易得到电子
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VII A | 0 |
| 2 | 3 Li锂6.941 | 4 Be铍9.012 | 5 B硼10.81 | 6 C碳12.01 | 7 N氮14.01 | 8 O氧16.00 | 9 F氟19.00 | 10 Ne氖20.18 |
| 3 | 11 Na钠22.99 | 12 Mg镁24.31 | 13 Al铝26.98 | 14 Si硅28.09 | 15 P磷30.97 | 16 S硫32.06 | 17 Cl氯35.45 | 18 Ar氩39.95 |
(1)下列各组元素具有相似化学性质的是 (填字母序号),所以它们属于同一 (填“周期”或“族”)。
A.Na、Cl
B.O、S
C.F、Cl
D.Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律 。
(3)第17号元素与第11号元素的原子形成化合物的化学式为 ;在该化合物中11号元素的化合价为 。
(4)某粒子的结构示意图为
 ,在化学变化中易失3个电子,该粒子的质子数为 ,其离子的符号为 。
,在化学变化中易失3个电子,该粒子的质子数为 ,其离子的符号为 。(5)如图为元素汞的信息,从图中获得的信息正确的一项是 。

A.汞属于非金属元素
B.汞的核电荷数为80
C.汞的相对原子质量为200.6g
D.在化学反应中,汞原子容易得到电子
25.如图是某同学配制50g质量分数为5%的食盐水的全过程:
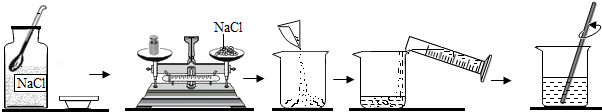
(1)配制过程中使用的四种玻璃仪器分别是广口瓶、 、 、玻璃棒。本实验应该称取氯化钠的质量为 g,量取水最好选择 的量筒(10mL、50mL、100mL)(水的密度为1g/cm3)。
(2)指出图中的两处错误。
① ;
② 。
(3)经检测,所配制溶液的溶质质量分数偏小,其原因还可能是 。
①氯化钠固体不纯
②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
A.①②③④
B.①③
C.①②③
D.①③④

(1)配制过程中使用的四种玻璃仪器分别是广口瓶、 、 、玻璃棒。本实验应该称取氯化钠的质量为 g,量取水最好选择 的量筒(10mL、50mL、100mL)(水的密度为1g/cm3)。
(2)指出图中的两处错误。
① ;
② 。
(3)经检测,所配制溶液的溶质质量分数偏小,其原因还可能是 。
①氯化钠固体不纯
②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
A.①②③④
B.①③
C.①②③
D.①③④
26.如图是测定空气中氧气含量的实验装置图。实验如下:用注射器抽取30mL空气(活塞拉至30mL刻度处),硬质玻璃管中空气的体积为50mL;在硬质玻璃管中放入过量铜粉,在右侧导管口套上瘪的气球;点燃酒精灯,反复推拉注射器和挤压气球,待充分反应后,冷却至室温;将气球中气体全部挤入硬质玻璃管,注射器中气体的体积为14mL。
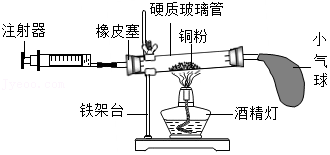
(1)实验时,铜粉过量的目的是 ; (填“能”或“不能”)用木炭代替铜粉进行相同实验。
(2)实验测得空气中氧气的含量为 。
(3)若测量值比理论值偏小,则可能存在的原因是 (写一条即可)。

(1)实验时,铜粉过量的目的是 ; (填“能”或“不能”)用木炭代替铜粉进行相同实验。
(2)实验测得空气中氧气的含量为 。
(3)若测量值比理论值偏小,则可能存在的原因是 (写一条即可)。
27.水是生命之源,没有水就没生命。
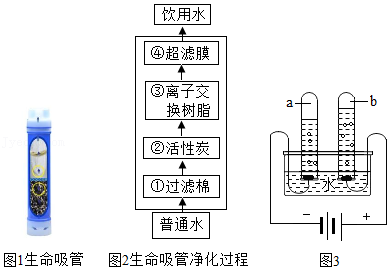
Ⅰ.“生命吸管”可直接将污水净化为饮用水,主要处理步骤与自来水的净化过程相似,如图1、图2所示:(③中离子交换树脂的主要作用是去除重金属离子、软化水质)
(1)①中过滤棉的作用是 (填字母。下同),②中活性炭的作用是 ,推测④中超滤膜的作用可能是 。
A.去除有害菌和部分病毒
B.吸附杂质
C.除去较大的不溶性杂质
(2)若无生命吸管,取用河水时,要降低水的硬度和杀灭病原微生物,生活中常采取 方法。
Ⅱ.从化学的角度认识水,如图3为电解水的实验简易装置图,接通电源观察两电极都有气泡产生。
(3)a管得到的气体是 ,可以用 检验。
(4)水的分解过程中,发生变化的微粒是 ,保持不变的微粒是氢原子和 (填具体的微粒名称)。

Ⅰ.“生命吸管”可直接将污水净化为饮用水,主要处理步骤与自来水的净化过程相似,如图1、图2所示:(③中离子交换树脂的主要作用是去除重金属离子、软化水质)
(1)①中过滤棉的作用是 (填字母。下同),②中活性炭的作用是 ,推测④中超滤膜的作用可能是 。
A.去除有害菌和部分病毒
B.吸附杂质
C.除去较大的不溶性杂质
(2)若无生命吸管,取用河水时,要降低水的硬度和杀灭病原微生物,生活中常采取 方法。
Ⅱ.从化学的角度认识水,如图3为电解水的实验简易装置图,接通电源观察两电极都有气泡产生。
(3)a管得到的气体是 ,可以用 检验。
(4)水的分解过程中,发生变化的微粒是 ,保持不变的微粒是氢原子和 (填具体的微粒名称)。
28.如图是对20℃一定质量的甲的溶液进行恒温蒸发的实验过程,请回答:
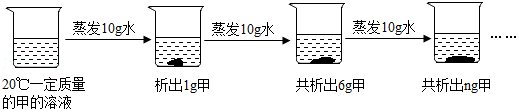
蒸发前原溶液是 (填“饱和”或“不饱和”)溶液,图中n的数值是 ,若将第四个烧杯内的溶液再蒸发10g水,又可以析出 g甲。

蒸发前原溶液是 (填“饱和”或“不饱和”)溶液,图中n的数值是 ,若将第四个烧杯内的溶液再蒸发10g水,又可以析出 g甲。
29.2020年8月4日18时,黎巴嫩首都贝鲁特港口发生大爆炸,造成100多人死亡,4000多人受伤,据报道,发生爆炸的是存放在仓库内的2750吨硝酸铵而引起的。(硝酸铵,化学式是NH4NO3,是一种无色无臭的透明晶体或白色晶体,极易溶于水,易吸湿结块。受猛烈撞击或受热爆炸分解。)1659年,德国人格劳贝尔首次制得硝酸铵,在20世纪中期得到迅速发展。
二战期间,一些国家专门建立了硝酸铵厂用来制造炸药。到了20世纪60年代,硝酸铵是氮肥的领先品种。
请回答:
(1)硝酸铵由 种(写数字)元素组成,该物质溶于水后溶液的温度 (填升高、降低或不变)。
(2)硝酸铵中氮、氢元素的质量比为 。
列式进行下列计算:
(3)若用20%的硝酸铵溶液加水稀释配成200g溶质量分数为5%的硝酸铵溶液,则需要20%的硝酸铵溶液的质量为多少克?
(4)40g硝酸铵与多少克尿素【化学式为CO(NH2)2】所含氮元素质量相等?
二战期间,一些国家专门建立了硝酸铵厂用来制造炸药。到了20世纪60年代,硝酸铵是氮肥的领先品种。
请回答:
(1)硝酸铵由 种(写数字)元素组成,该物质溶于水后溶液的温度 (填升高、降低或不变)。
(2)硝酸铵中氮、氢元素的质量比为 。
列式进行下列计算:
(3)若用20%的硝酸铵溶液加水稀释配成200g溶质量分数为5%的硝酸铵溶液,则需要20%的硝酸铵溶液的质量为多少克?
(4)40g硝酸铵与多少克尿素【化学式为CO(NH2)2】所含氮元素质量相等?
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解