下载高清试卷
【2021-2022学年江苏省苏州市江宁区九年级(上)期末化学试卷】-第1页
试卷格式:2021-2022学年江苏省苏州市江宁区九年级(上)期末化学试卷.PDF
试卷热词:最新试卷、2021年、江苏试卷、苏州市试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷
扫码查看解析
试卷题目
1.2021年世界环境日中国宣传主题是“人与自然和谐共生”。下列做法与该主题不相符的是( )
- A. 坚持绿色出行
- B. 分类投放垃圾
- C. 禁放烟花爆竹
- D. 露天焚烧秸秆
2.下列反应中,吸收热量的是( )
- A. 生石灰与水反应
- B. 硫燃烧
- C. 镁与稀盐酸反应
- D. 碳与二氧化碳反应
3.下列变化中,属于物理变化的是( )
- A. 动植物的呼吸
- B. 粮食酿酒
- C. 海水晒盐
- D. 面粉爆炸
4.下列物质由离子构成的是( )
- A. 硫酸铜
- B. 氧气
- C. C60
- D. 金刚石
5.下列实验操作正确的是( )
- A.
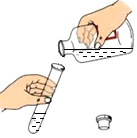
倾倒液体 - B.
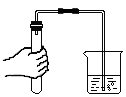
检查装置的气密性 - C.
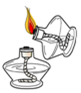
点燃酒精灯 - D.
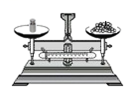
称量固体
6.把少量下列物质分别放入水中,充分搅拌,可以得到有色溶液的是( )
- A. 面粉
- B. 蔗糖
- C. 汽油
- D. 高锰酸钾
7.在元素周期表中铁元素的某些信息如图所示,下列有关铁的说法不正确的是( )
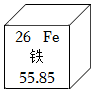

- A. 元素符号为Fe
- B. 相对原子质量为55.85g
- C. 原子序数为26
- D. 属于金属元素
8.下列实验现象中,描述正确的是( )
- A. 木炭在氧气中燃烧,发出白光,放热,有无色刺激性气味气体生成
- B. 红磷在氧气中剧烈燃烧,放热,有大量白雾生成
- C. 镁在空气中燃烧,产生耀眼的白光,放热,生成白色固体
- D. 高锰酸钾加热生成氧气
9.物质的用途与性质密切相关,下列说法正确的是( )
- A. 淬火后的钢针不能弯曲
- B. 用汽油可以乳化油污将其除去
- C. 铁制品表面涂“银粉”(铝粉),是由于铝的化学性质比铁稳定
- D. 钢的延展性优于生铁,是因为其含碳量高于生铁的含碳量
10.如图为四种粒子的结构示意图,下列叙述不正确的是( )
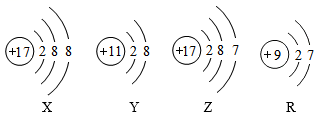
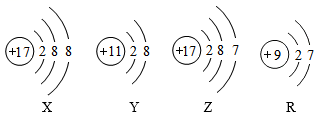
- A. Y是阴离子
- B. Z和R元素具有相似的化学性质
- C. X和Z属于同种元素
- D. X和Y形成物质的化学式为NaCl
11.绿茶中含有的单宁酸(C76H52O46)具有抑制血压上升、清热解毒等功效。下列有关单宁酸的说法正确的是( )
- A. 相对分子质量为174
- B. 由碳原子、氢分子和氧分子构成
- C. 氢元素的质量分数最小
- D. 碳、氧两种元素的质量比为76:46
12.除去下列物质中的少量杂质(括号内为杂质),方法不正确的是( )
| 选项 | 物质(杂质) | 除去杂质的方法 |
| A | CuO粉末(碳粉) | 在氧气流中加热混合物 |
| B | KCl固体(KClO3固体) | 加入少量二氧化锰后,加热 |
| C | O2(水蒸气) | 通过足量的氯化钙固体 |
| D | CaO固体(CaCO3固体) | 高温煅烧 |
- A. A
- B. B
- C. C
- D. D
13.下列实验设计能达到实验目的的是( )
| 选项 | A | B | C | D |
| 实验设计 | 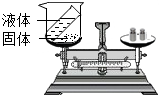 | 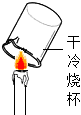 | 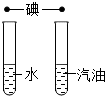 | 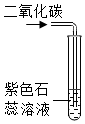 |
| 实验目的 | 用硝酸钾和水验证质量守恒定律 | 探究蜡烛中是否含有碳元素 | 探究碘的溶解性是否与溶剂种类有关 | 探究二氧化碳能否与水反应 |
- A. A
- B. B
- C. C
- D. D
14.在下图1的三口瓶中加入一定量的“暖宝宝”原料(主要成分为铁粉和碳粉),并滴加几滴水,分别用压强、氧气浓度和温度三种数字传感器绘制出数据变化图像如图2所示,下列说法中不正确的是( )
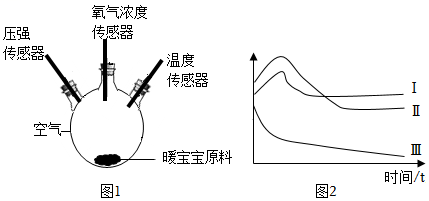

- A. Ⅰ为温度变化曲线
- B. 上述反应过程属于缓慢氧化
- C. 水在上述过程中不起催化作用
- D. 如果“暖宝宝”原料足量,压强可降至0
15.向200.0gAgNO3溶液中加入mgAl和Cu的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得到32.4g固体。向滤液中再次插入洁净光亮的细铜丝,铜丝表面产生银白色物质。下列说法正确的是( )
- A. m的值可能为8.0
- B. 向过滤所得固体中加入稀盐酸可能会有气体生成
- C. 滤液的质量为167.6g
- D. 原AgNO3溶液的溶质质量分数是25.5%
16.实验室中Y形管用途很多。
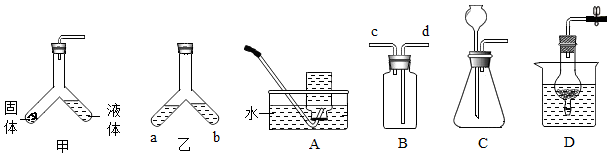
(1)利用装置甲在实验室制备少量二氧化碳:Y形管中盛放的固体物质是 (填名称),反应的化学方程式为 ;若用装置B收集CO2应从导管 (填“c”或“d”)通入。
(2)利用装置乙探究微粒性质:a处盛放浓氨水,向b处水中滴加 (填名称);最终 (填“a”或“b”)处溶液变红。
(3)实验室用稀硫酸和锌粒制取氢气的发生装置可用装置C,装置D也可用来完成该实验,使用装置D的优点是 。
(4)68g质量分数为5%的过氧化氢溶液与0.5g二氧化锰粉末混合,最多生成氧气的质量是多少? (写出计算过程)

(1)利用装置甲在实验室制备少量二氧化碳:Y形管中盛放的固体物质是 (填名称),反应的化学方程式为 ;若用装置B收集CO2应从导管 (填“c”或“d”)通入。
(2)利用装置乙探究微粒性质:a处盛放浓氨水,向b处水中滴加 (填名称);最终 (填“a”或“b”)处溶液变红。
(3)实验室用稀硫酸和锌粒制取氢气的发生装置可用装置C,装置D也可用来完成该实验,使用装置D的优点是 。
(4)68g质量分数为5%的过氧化氢溶液与0.5g二氧化锰粉末混合,最多生成氧气的质量是多少? (写出计算过程)
17.化学与生活密切相关,请按要求回答下列问题:
(1)化石燃料包括煤、石油和 ,是不可再生能源。汽油中加入乙醇作汽车燃料可节省石油资源,写出乙醇燃烧的化学方程式 。
(2)一氧化氮和二氧化硫的排放,会污染大气。请写出这两种气体的化学式并标出氮、硫元素的化合价 、 。
(3)一些城镇的家庭用一种罐装液化石油气作燃料。若厨房失火时,移走“煤气罐”,这是利用了 原理灭火(填序号)。
A.清除可燃物
B.使可燃物与氧气隔绝
C.降低可燃物的着火点
D.降低温度
(4)催化转换器可将有害气体转化为空气中的两种常见气体,反应过程的微观示意图如下:
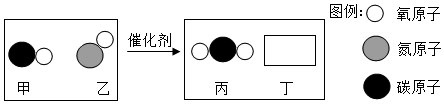
根据示意图得出的结论中,正确的有 (填序号)。
A.该反应中含氧元素的物质有3种
B.该反应是置换反应
C.参加反应的甲和乙的质量比为14:15
D.生成丙和丁的分子个数比为1:1
(5)请用火柴、蜡烛、玻璃杯三种实验材料,设计对比实验证明可燃物燃烧需要氧气(或空气)(写出实验操作、实验现象)。
(1)化石燃料包括煤、石油和 ,是不可再生能源。汽油中加入乙醇作汽车燃料可节省石油资源,写出乙醇燃烧的化学方程式 。
(2)一氧化氮和二氧化硫的排放,会污染大气。请写出这两种气体的化学式并标出氮、硫元素的化合价 、 。
(3)一些城镇的家庭用一种罐装液化石油气作燃料。若厨房失火时,移走“煤气罐”,这是利用了 原理灭火(填序号)。
A.清除可燃物
B.使可燃物与氧气隔绝
C.降低可燃物的着火点
D.降低温度
(4)催化转换器可将有害气体转化为空气中的两种常见气体,反应过程的微观示意图如下:

根据示意图得出的结论中,正确的有 (填序号)。
A.该反应中含氧元素的物质有3种
B.该反应是置换反应
C.参加反应的甲和乙的质量比为14:15
D.生成丙和丁的分子个数比为1:1
(5)请用火柴、蜡烛、玻璃杯三种实验材料,设计对比实验证明可燃物燃烧需要氧气(或空气)(写出实验操作、实验现象)。
| 实验操作 | 实验现象 | 实验结论 |
| 可燃物燃烧需要氧气 |
18.水和溶液在生产生活中有着重要的作用。
(1)生活中可以用 检验某水样是硬水还是软水。净水器中经常使用活性炭,主要利用了活性炭的 性。
(2)一瓶合格的生理盐水密封放置一段时间后,不会出现浑浊现象,原因是 。
(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种。现将300g25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为 g。
(4)水可参与许多化学反应。一种家用环保型消毒液发生器的反应原理是:在通电条件下,氯化钠和水反应生成氢氧化钠、氢气和氯气(C12),该反应的化学方程式是 。
(5)图1是a、b两物质在水中的溶解度曲线,请根据图回答:
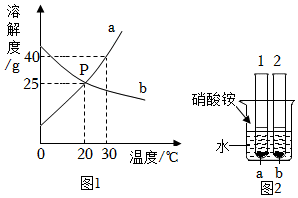
①曲线上P点的含义是 。
②温度 20℃时(填“>”或“<”),a 物质的溶解度大于 b 物质的溶解度。
③将b物质的饱和溶液转化为不饱和溶液的方法有 、 。
④如图2所示,试管1、2中分别盛有20℃时等质量的a、b饱和溶液,底部有等质量的a、b固体剩余,向烧杯的水中加入硝酸铵固体,下列判断不正确的是 (不考虑溶剂的蒸发,析出的固体不含水)。
A.试管2底部的固体减少
B.a溶液由饱和溶液变成不饱和溶液
C.a溶液中溶剂质量等于b溶液中溶剂质量
D.变化后b溶液中溶质质量分数仍然等于a溶液中溶质质量分数
(1)生活中可以用 检验某水样是硬水还是软水。净水器中经常使用活性炭,主要利用了活性炭的 性。
(2)一瓶合格的生理盐水密封放置一段时间后,不会出现浑浊现象,原因是 。
(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种。现将300g25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为 g。
(4)水可参与许多化学反应。一种家用环保型消毒液发生器的反应原理是:在通电条件下,氯化钠和水反应生成氢氧化钠、氢气和氯气(C12),该反应的化学方程式是 。
(5)图1是a、b两物质在水中的溶解度曲线,请根据图回答:

①曲线上P点的含义是 。
②温度 20℃时(填“>”或“<”),a 物质的溶解度大于 b 物质的溶解度。
③将b物质的饱和溶液转化为不饱和溶液的方法有 、 。
④如图2所示,试管1、2中分别盛有20℃时等质量的a、b饱和溶液,底部有等质量的a、b固体剩余,向烧杯的水中加入硝酸铵固体,下列判断不正确的是 (不考虑溶剂的蒸发,析出的固体不含水)。
A.试管2底部的固体减少
B.a溶液由饱和溶液变成不饱和溶液
C.a溶液中溶剂质量等于b溶液中溶剂质量
D.变化后b溶液中溶质质量分数仍然等于a溶液中溶质质量分数
19.钨(W)是一种重要的战略资源,我国的钨储量居全球第一。如图是一种生产钨的工业流程:
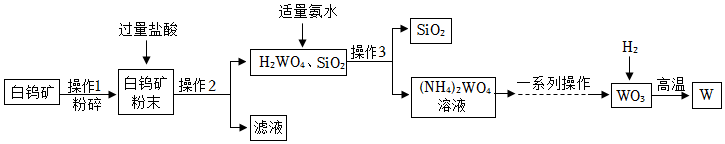
已知:白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2等;碳在高温条件下会与金属钨反应生成碳化钨;钨酸(H2WO4)是难溶于水的黄色固体。
(1)灯泡里的灯丝用钨的原因是 。
(2)操作1中粉碎白钨矿的目的是 。操作3的名称是 。
(3)流程中氨水(NH3•H2O)和H2WO4反应生成(NH4)2WO4,化学方程式为:2NH3•H2O+H2WO4═(NH4)2WO4+ 。
(4)写出上图中WO3转化为W的化学方程式: 。

已知:白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2等;碳在高温条件下会与金属钨反应生成碳化钨;钨酸(H2WO4)是难溶于水的黄色固体。
(1)灯泡里的灯丝用钨的原因是 。
(2)操作1中粉碎白钨矿的目的是 。操作3的名称是 。
(3)流程中氨水(NH3•H2O)和H2WO4反应生成(NH4)2WO4,化学方程式为:2NH3•H2O+H2WO4═(NH4)2WO4+ 。
(4)写出上图中WO3转化为W的化学方程式: 。
20.A~G是初中化学常见的物质。其中A、B都是由两种元素组成的物质,A中两种元素质量比为3:1,B在生活中可用来灭火;E、F、G都为金属,E是目前世界年产量最高的金属,它们之间的关系如图所示,图中“→”表示由一种物质转化为另一种物质,“一”表示相连的两种物质能发生化学反应,反应物和生成物及反应条件已略去。请回答下列问题:
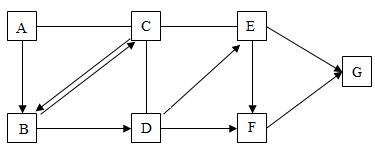
(1)A的化学式是 。
(2)B→D反应的化学方程式为 ;C和E反应的化学方程式为 。
(3)E、F、G三种金属的活动性由弱到强的顺序为 。

(1)A的化学式是 。
(2)B→D反应的化学方程式为 ;C和E反应的化学方程式为 。
(3)E、F、G三种金属的活动性由弱到强的顺序为 。
21.某校兴趣小组在实验室里探究木炭与氧化铜的实验,请回答下列问题:

实验1:用如图1所示装置进行实验,很快发现澄清石灰水变浑浊;
(1)请写出木炭与氧化铜反应的化学方程式 ;该反应中,氧化铜发生的是 (选填“氧化”或“还原”)反应。
(2)加热一段时间后,装有木炭和氧化铜的试管口处,凝聚了少量的水。但是反应物中并没有氢元素,为什么会有水产生呢?我的分析: 。
实验Ⅱ:(如图2)针对上述实验,小华同学认为当木炭较多、温度较高时,该反应产生的气体中可能含有CO和CO2,小组同学在老师指导下设计实验进行了验证:
(已知;碱石灰是NaOH和CaO的混合物,可以吸收二氧化碳和水。)
实验前,先检查装置的气密性;点燃酒精灯前,先打开K,通入N2一段时间。
(3)要达到上述实验目的,写出B中反应的化学方程式 。
(4)D中玻璃管盛装的试剂为CuO,E中盛装的试剂为澄清石灰水。若A装置产物中确有CO,则应观察到的现象有: 。
(5)上述实验的不足之处是 。
实验Ⅲ:小吴同学通过查阅资料发现:木炭还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O。
(6)小吴将实验1中得到的红色固体粉末全部放入烧杯中,加入足量稀硫酸,充分反应后,观察到 ,证明实验1得到的红色固体中含有氧化亚铜;再经过滤、洗涤、干燥,得到纯净的单质铜1.44g。
(7)若小吴实验使用的氧化铜粉末的质量为2.00g,不考虑实验过程中的损耗,则实验1得到的红色固体粉末中,单质铜的质量分数为 (计算结果保留一位小数)。

实验1:用如图1所示装置进行实验,很快发现澄清石灰水变浑浊;
(1)请写出木炭与氧化铜反应的化学方程式 ;该反应中,氧化铜发生的是 (选填“氧化”或“还原”)反应。
(2)加热一段时间后,装有木炭和氧化铜的试管口处,凝聚了少量的水。但是反应物中并没有氢元素,为什么会有水产生呢?我的分析: 。
实验Ⅱ:(如图2)针对上述实验,小华同学认为当木炭较多、温度较高时,该反应产生的气体中可能含有CO和CO2,小组同学在老师指导下设计实验进行了验证:
(已知;碱石灰是NaOH和CaO的混合物,可以吸收二氧化碳和水。)
实验前,先检查装置的气密性;点燃酒精灯前,先打开K,通入N2一段时间。
(3)要达到上述实验目的,写出B中反应的化学方程式 。
(4)D中玻璃管盛装的试剂为CuO,E中盛装的试剂为澄清石灰水。若A装置产物中确有CO,则应观察到的现象有: 。
(5)上述实验的不足之处是 。
实验Ⅲ:小吴同学通过查阅资料发现:木炭还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O。
(6)小吴将实验1中得到的红色固体粉末全部放入烧杯中,加入足量稀硫酸,充分反应后,观察到 ,证明实验1得到的红色固体中含有氧化亚铜;再经过滤、洗涤、干燥,得到纯净的单质铜1.44g。
(7)若小吴实验使用的氧化铜粉末的质量为2.00g,不考虑实验过程中的损耗,则实验1得到的红色固体粉末中,单质铜的质量分数为 (计算结果保留一位小数)。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解