下载高清试卷
【2021-2022学年湖南省株洲市渌口区九年级(上)期末化学试卷】-第1页
试卷格式:2021-2022学年湖南省株洲市渌口区九年级(上)期末化学试卷.PDF
试卷热词:最新试卷、2021年、湖南试卷、株洲市试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷
扫码查看解析
试卷题目
1.下列变化中,与其他变化有根本区别的一种是( )
- A. 烧制陶罐
- B. 粮食酿酒
- C. 食物腐败
- D. 石油分馏
2.在讨论化学与生活的关系时,同学们提出的下列问题:①为什么铁制的菜刀容易生锈;②水是由什么元素组成的;③顺风骑自行车省力;④飞机为什么能飞上天;⑤空气中含有什么物质;⑥菜刀生锈为什么要及时除去。其中与化学关系密切的是( )
- A. ①④⑤⑥
- B. ①②③⑥
- C. ①②⑤⑥
- D. ②③⑤⑥
3.12月17日凌晨,“嫦娥“揽月,胜利归来。采回的月壤,将由科学家真空解压后保存于氮气中。氮气能用于保存月壤,主要是因为( )
- A. 化学性质不活泼
- B. 无色无味
- C. 空气中含量最多
- D. 沸点较低
4.分类是学习化学的重要方法。以下分类正确的是( )
- A. 可燃性气体:氧气、氢气
- B. 混合物:空气、二氧化碳
- C. 化合物:氯化钾、二氧化锰
- D. 化石燃料:煤、氢气
5.下列实验操作中,正确的是( )
- A.
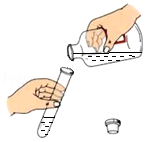 倾倒液体
倾倒液体 - B.
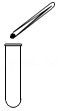 放入锌粒
放入锌粒 - C.
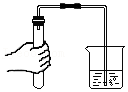 检查气密性
检查气密性 - D.
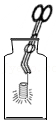 铁丝在氧气中燃烧
铁丝在氧气中燃烧
6.2021年4月16日,我国自主研发出超流氦大型低温制冷装备,打破了发达国家的技术垄断,液氦是制造超低温的“神器”。根据图中信息判断,下列关于氦的说法正确的是( )
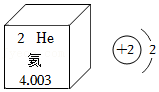

- A. 氦的元素符号是He
- B. 氦位于周期表中第二周期
- C. 氦的相对原子质量是4.003g
- D. 氦原子容易得到电子
7.化学从定性研究发展到定量研究使其向前迈进了一大步。用精确的定量实验研究化学反应前后物质质量之间的关系,得出了质量守恒定律的科学家是( )
- A. 门捷列夫
- B. 拉瓦锡
- C. 张青莲
- D. 道尔顿
8.下列反应属于分解反应的是( )
- A. 加热高锰酸钾制取氧气
- B. 蜡烛的燃烧
- C. 一氧化碳还原氧化铁
- D. 镁条燃烧
9.下列有关实验现象的描述与事实不相符的是( )
- A. 红磷在空气中燃烧产生大量的白烟
- B. 硫在空气中燃烧发出淡蓝色火焰
- C. 细铁丝在氧气中燃烧生成白色固体
- D. 二氧化碳通入紫色石蕊溶液中,溶液变红
10.下列化学用语与所表述的意义相符的是( )
- A. Mg:镁离子
- B. CaO:氧化钙
- C. 2Cl:2个氯分子
- D. C60:60个碳原子
11.“绿色发展”、“低碳生活”等理念逐渐深入人心。下列做法符合这一理念的是( )
- A. 用废旧报纸制作笔杆
- B. 将尾气直接排放到空气中
- C. 使用一次性纸杯喝水
- D. 将收缴的假冒伪劣商品露天焚烧
12.为及时发现家用天然气泄漏,常在天然气中加入少量具有特殊气味的乙硫醇(C2H5SH)。有关乙硫醇的说法正确的是( )
- A. 乙硫醇由四种元素组成
- B. 一个乙硫醇分子中含有9个原子
- C. 乙硫醇中碳元素的质量分数最大
- D. 乙硫醇中碳、氢元素的质量比为1:3
13.普通玻璃是混合物,其成分有二氧化硅(SiO2)、硅酸钠(Na2SiO3)、硅酸钙(CaSiO3),其中硅元素的化合价均为( )
- A. ﹣2
- B. +2
- C. +3
- D. +4
14.逻辑推理是一种重要的化学思维方法,以下推理合理的是( )
- A. 因为H2O和H2O2的组成元素相同,所以它们的化学性质相同
- B. 因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有碳元素和氢元素
- C. 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件
- D. 因为同种元素的微粒质子数相同,所以质子数相同的微粒一定属于同种元素
15.通过学习化学,我们学会了从化学的视角认识水,下列对水的认识错误的是( )
- A. 水由氢气和氧气组成
- B. 冰中的水分子也在不断运动
- C. 硬水中含有较多可溶性钙、镁化合物
- D. 水可与生石灰发生化学反应
16.中美科学家携手发现了全硼富勒烯B40团簇(结构如图所示),它在超导、绿色催化等领域具有重要的应用价值。B40属于( )


- A. 单质
- B. 化合物
- C. 有机物
- D. 混合物
17.把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间,测得反应后各物质的
质量如下,则下列说法中错误的是( )
质量如下,则下列说法中错误的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量(g) | 7.6 | 2.0 | 0.2 | 0 |
| 反应后的质量(g) | 3.2 | X | 5.8 | 0.4 |
- A. X=0.4
- B. 丁一定是单质
- C. 甲和乙是反应物
- D. 反应中的甲、丙发生改变的质量比是11:14
18.根据你的生活经验,判断下列做法中正确的是( )
- A. 过量的镁条在密闭容器中燃烧不遵循质量守恒定律
- B. 夜晚发现煤气泄漏立即开灯检查
- C. 用活性炭把硬水软化
- D. 在家里可用食醋除去烧水壶中的水垢(含碳酸钙)
19.区别一氧化碳和二氧化碳两种气体可以选择的方法是( )
- A. 常温下分别通入氧化铜
- B. 分别通入紫色的石蕊溶液
- C. 分别通入石灰水
- D. 闻气味
20.某可燃性气体可能是乙炔(C2H2)、甲烷(CH4)、一氧化碳中的一种或两种。已知一定质量该气体在足量的氧气中充分燃烧生成44g二氧化碳和9g水,则该气体可能组成为( )
- A. 乙炔
- B. 乙炔和一氧化碳的混合物
- C. 甲烷和一氧化碳的混合物
- D. 甲烷和乙炔的混合物
21.请用化学符号填空:
(1)任意一种无色无味的气体
(2)任意一种含+3价元素的氧化物
(3)任意一种由3个原子构成的分子
(1)任意一种无色无味的气体
(2)任意一种含+3价元素的氧化物
(3)任意一种由3个原子构成的分子
22.社会发展离不开通讯技术的发展以及新能源的开发和利用。我国商用5G已经开始启用,5G通信芯片用氮化镓材料制成,如图是氮元素在元素周期表中的信息以及镓(Ga)原子的结构示意图。
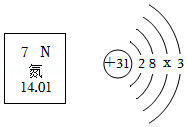
(1)氮元素是 (填“金属元素”或“非金属元素”)。
(2)x= ,氮化镓的化学式是 。

(1)氮元素是 (填“金属元素”或“非金属元素”)。
(2)x= ,氮化镓的化学式是 。
23.化学与生活、生产息息相关,请运用化学知识回答下列问题。
(1)华雪同学开学带回一瓶山泉水,取样加入适量肥皂水,振荡产生较多泡沫,则该山泉水属于 (选填:“硬水”或“软水”);
(2)一个水分子是由 构成的;
(3)茶杯内的纱网,可将茶叶与茶水分离,便于饮用,该设计利用的化学原理是 ;
(4)水能灭火,但有时水也可以“生火”,比如将过氧化钠(Na2O2)用脱脂棉包裹,再向上面滴加少量水,脱脂棉一会儿就会燃烧起来。过氧化钠与水反应生成氢氧化钠(NaOH)和空气中含有的一种气体:
①写出该反应的化学方程式 ;
②包裹过氧化钠的脱脂棉滴加水后,引起脱脂棉能燃烧起来的主要原因是: 。
(1)华雪同学开学带回一瓶山泉水,取样加入适量肥皂水,振荡产生较多泡沫,则该山泉水属于 (选填:“硬水”或“软水”);
(2)一个水分子是由 构成的;
(3)茶杯内的纱网,可将茶叶与茶水分离,便于饮用,该设计利用的化学原理是 ;
(4)水能灭火,但有时水也可以“生火”,比如将过氧化钠(Na2O2)用脱脂棉包裹,再向上面滴加少量水,脱脂棉一会儿就会燃烧起来。过氧化钠与水反应生成氢氧化钠(NaOH)和空气中含有的一种气体:
①写出该反应的化学方程式 ;
②包裹过氧化钠的脱脂棉滴加水后,引起脱脂棉能燃烧起来的主要原因是: 。
24.尿素[CO(NH2)2]在工农业生产中应用广泛。
(1)尿素分子中碳、氮原子个数比为 ;
(2)尿素是目前使用量较大的一种氮肥,适用于各种植物,某水田施加12千克尿素,其最多可为农作物补充氮元素 千克;
(3)尿素一般密封保存在阴凉通风处。实验室的石灰水也要密封保存,长期存放石灰水的试剂瓶内容易形成一层白膜,用化学方程式解释原因 。
(1)尿素分子中碳、氮原子个数比为 ;
(2)尿素是目前使用量较大的一种氮肥,适用于各种植物,某水田施加12千克尿素,其最多可为农作物补充氮元素 千克;
(3)尿素一般密封保存在阴凉通风处。实验室的石灰水也要密封保存,长期存放石灰水的试剂瓶内容易形成一层白膜,用化学方程式解释原因 。
25.A—E是初中化学常见的五种物质,它们的变化关系如图所示。其中A为黑色固体,其相对分子质量大于200,B、D均是由相同的两种元素组成的气体,C为固体单质,块状时呈银白色,粉末状时为黑色。
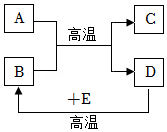
(1)A的化学式为 ;
(2)写出D与E反应生成B的化学方程式 ;其基本反应类型为 反应;
(3)B和E都具有较强的 (填“氧化性”或“还原性”)。

(1)A的化学式为 ;
(2)写出D与E反应生成B的化学方程式 ;其基本反应类型为 反应;
(3)B和E都具有较强的 (填“氧化性”或“还原性”)。
26.请用你熟悉的化学知识回答下列问题:
(1)结合金刚石、石墨、活性炭的性质和用途,说说物质的性质和用途有什么关系?请举例说明。
(2)铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?为什么不宜用钢刷来擦洗?
(1)结合金刚石、石墨、活性炭的性质和用途,说说物质的性质和用途有什么关系?请举例说明。
(2)铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?为什么不宜用钢刷来擦洗?
27.为了从含有FeSO4、CuSO4的工业废水中回收Cu和FeSO4晶体,某学习小组设计并完成了以下实验。
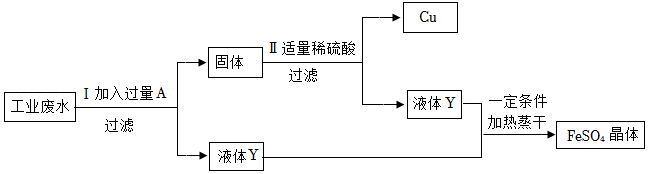
(1)过滤中玻璃棒的作用是 。
(2)步骤Ⅰ发生的化学方程式 。
(3)步骤Ⅱ反应的实验现象 。
(4)Ⅱ中稀硫酸 (填“能”或“不能”)换成Cu(NO3)2溶液。
(5)写出Cu在生活中的一种用途 。

(1)过滤中玻璃棒的作用是 。
(2)步骤Ⅰ发生的化学方程式 。
(3)步骤Ⅱ反应的实验现象 。
(4)Ⅱ中稀硫酸 (填“能”或“不能”)换成Cu(NO3)2溶液。
(5)写出Cu在生活中的一种用途 。
28.如图是初中化学常用的实验装置,请回答下列问题。
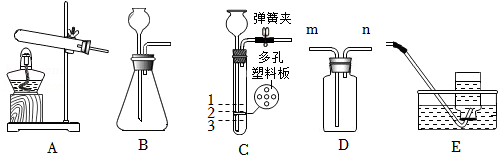
(1)写出装置B中的任意一种玻璃仪器的名称 。
(2)实验室用氯酸钾和二氧化锰混合加热制取氧气,应选择的发生装置是 (填字母序号),反应的化学方程式是 。
(3)装置B和C都能用作实验室制取二氧化碳的发生装置,与装置B相比,装置C的优点是 。若用装置C作发生装置,关闭弹簧夹,反应停止后,液面应位于 (填“1”、“2”或“3”)处。
(4)若用装置D收集二氧化碳,气体应从 (填“m”或“n”)端进入。
(5)小红同学用装置E收集了一瓶氧气,测得氧气浓度偏低,原因可能是 (填序号)。
a.收集气体前,集气瓶中没有注满水
b.导管口开始有气泡冒出,立刻收集
c.收集气体后,集气瓶中仍有少量水
d.收集气体后,集气瓶正放在桌面上

(1)写出装置B中的任意一种玻璃仪器的名称 。
(2)实验室用氯酸钾和二氧化锰混合加热制取氧气,应选择的发生装置是 (填字母序号),反应的化学方程式是 。
(3)装置B和C都能用作实验室制取二氧化碳的发生装置,与装置B相比,装置C的优点是 。若用装置C作发生装置,关闭弹簧夹,反应停止后,液面应位于 (填“1”、“2”或“3”)处。
(4)若用装置D收集二氧化碳,气体应从 (填“m”或“n”)端进入。
(5)小红同学用装置E收集了一瓶氧气,测得氧气浓度偏低,原因可能是 (填序号)。
a.收集气体前,集气瓶中没有注满水
b.导管口开始有气泡冒出,立刻收集
c.收集气体后,集气瓶中仍有少量水
d.收集气体后,集气瓶正放在桌面上
29.化学兴趣小组的同学用锌和稀硫酸进行实验制取氢气,发现不同组同学实验时反应速率有些差异。于是兴趣小组的同学们一起对“锌与硫酸反应速率的影响因素”进行探究,并利用下图装置收集产生的氢气。

【查阅资料】圆粒状锌的直径通常为3﹣4毫米,粉末状锌的直径通常为0.3~0.5毫米。
(1)【作出猜想】同学们推测影响“锌与硫酸反应速率的影响因素”:
甲同学:温度;
乙同学:硫酸的溶质质量分数(即浓度);
丙同学: 。
【进行实验】同学们一起设计了如下实验方案进行实验。
【解释与结论】
(2)锌与硫酸反应的化学方程式为 。
(3)能用排水法收集氢气的原因是氢气 (填“易”或“难”)溶于水。
(4)实验1、2、3的目的是探究 同学的猜想。
(5)欲得出“其他条件相同时,硫酸的溶质质量分数越大,锌与硫酸反应的速率越快”的结论,需要对比实验 (填编号)。
(6)通过对比实验5和实验6,得出的结论是 。
【反思与评价】
(7)实验室制取氢气时,通常使用锌粒而不用锌粉的原因为 。
(8)将6.5g锌与100g19.6%的硫酸充分反应,可得到氢气 L(氢气密度为0.09g/L,精确到0.1L)

【查阅资料】圆粒状锌的直径通常为3﹣4毫米,粉末状锌的直径通常为0.3~0.5毫米。
(1)【作出猜想】同学们推测影响“锌与硫酸反应速率的影响因素”:
甲同学:温度;
乙同学:硫酸的溶质质量分数(即浓度);
丙同学: 。
【进行实验】同学们一起设计了如下实验方案进行实验。
| 编号 | 温度/℃ | 硫酸体积 | 硫酸溶质质量分数 | 锌的形状 | 锌的质量/g | 收集30mL氢气 |
| 1 | 20 | 20 | 10% | 圆粒状 | 1 | 170 |
| 2 | 30 | 20 | 10% | 圆粒状 | 1 | 134 |
| 3 | 40 | 20 | 10% | 圆粒状 | 1 | 107 |
| 4 | 20 | 20 | 10% | 粉末状 | 1 | 47 |
| 5 | 20 | 20 | 20% | 圆粒状 | 1 | 88 |
| 6 | 20 | 20 | 20% | 粉末状 | 1 | 26 |
【解释与结论】
(2)锌与硫酸反应的化学方程式为 。
(3)能用排水法收集氢气的原因是氢气 (填“易”或“难”)溶于水。
(4)实验1、2、3的目的是探究 同学的猜想。
(5)欲得出“其他条件相同时,硫酸的溶质质量分数越大,锌与硫酸反应的速率越快”的结论,需要对比实验 (填编号)。
(6)通过对比实验5和实验6,得出的结论是 。
【反思与评价】
(7)实验室制取氢气时,通常使用锌粒而不用锌粉的原因为 。
(8)将6.5g锌与100g19.6%的硫酸充分反应,可得到氢气 L(氢气密度为0.09g/L,精确到0.1L)
30.某学习小组在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量变化如图所示,请计算。

(1)写出该反应的化学方程式 。
(2)制取氧气的质量是 g。
(3)原混合物中氯酸钾的质量分数?(写出计算过程,计算结果精确到0.1%)

(1)写出该反应的化学方程式 。
(2)制取氧气的质量是 g。
(3)原混合物中氯酸钾的质量分数?(写出计算过程,计算结果精确到0.1%)
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解