下载高清试卷
【2022年黑龙江省大庆市中考化学三模试卷】-第1页
试卷格式:2022年黑龙江省大庆市中考化学三模试卷.PDF
试卷热词:最新试卷、2022年、黑龙江试卷、大庆市试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷

扫码查看解析
试卷题目
1.1月25日,习近平在世界经济论坛“达沃斯议程”对话会上发表特别致辞对世界庄严承诺中国力争于2030年前碳达峰、2060年前实现碳中和。下列说法错误的是( )


- A. 全球气候变暖是全人类面临的全球性问题,任何人都不该置身事外
- B. 所谓“低碳”就是较低的碳单质的排放
- C. 争取“碳中和”可以从多利用清洁能源,植树造林等多方面下手
- D. 中国承诺从“碳达峰”到“碳中和”所用的时间远远短于其他发达国家,体现了大国担当
2.下列图示实验操作正确的是( )
- A.
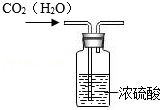 干燥气体
干燥气体 - B.
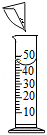 蔗糖的溶解
蔗糖的溶解 - C.
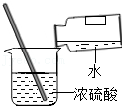 稀释浓硫酸
稀释浓硫酸 - D.
 利用排空气法收集CO2
利用排空气法收集CO2
3.下列叙述属于化学变化的是( )
- A. 打开浓盐酸瓶塞,瓶口形成白雾
- B. 酒败成醋
- C. 二氧化碳凝华为干冰
- D. 烧碱固体潮解
4.下列表述完全正确的是( )
- A. 两种化合物发生的反应一定属于复分解反应
- B. 人们经常利用的能源有化石能源、可燃冰等
- C. 质子数相同的粒子不一定属于同种元素
- D. 能使无色酚酞试液变红的溶液一定是碱的溶液
5.下列物质分类的正确组合是( )
| 选项 | 酸 | 碱 | 盐 | 氧化物 |
| A | 硝酸 | 氨水 | 烧碱 | 二氧化硫 |
| B | 硫酸 | 纯碱 | 食盐 | 一氧化碳 |
| C | 醋酸 | 苛性钠 | 石灰石 | 水 |
| D | 碳酸 | 苛性钾 | 硫酸钡 | 三氧化硫 |
- A. A
- B. B
- C. C
- D. D
6.下列化学方程式与事实相符且正确的是( )
- A. 用赤铁矿高炉炼铁:3C+Fe2O33CO2+2Fe
高温 - B. 用铁片和硝酸银溶液比较金属的活泼性:Fe+3AgNO3═Fe(NO3)3+3Ag
- C. 三氧化硫与氢氧化钠溶液的反应:SO3+NaOH═Na2SO4+H2O
- D. 正常雨水的pH约为5.6的原因:CO2+H2O═H2CO3
7.下列除杂所用试剂和主要实验操作均正确的是( )
| 选项 | 物质(括号内为杂质) | (所用试剂 | 主要实验操作 |
| A | CaCl2溶液(HCl) | 过量的Ca(OH)2 | / |
| B | Fe(Fe2O3) | 过量的稀盐酸 | 过滤 |
| C | N2(O2) | 灼热铜网 | 气体通过 |
| D | 氯化钾固体(氯酸钾固体) | 二氧化锰 | 加热 |
- A. A
- B. B
- C. C
- D. D
8.如图所示的图像能正确反映对应变化关系的是( )
- A.
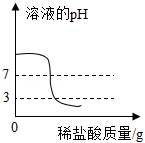 向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸 - B.
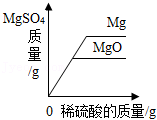 向等质量的Mg和MgO中分别加入足量等浓度的稀硫酸
向等质量的Mg和MgO中分别加入足量等浓度的稀硫酸 - C.
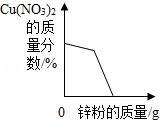 向一定量的AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
向一定量的AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量 - D.
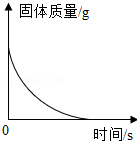 加热一定质量的氯酸钾与二氧化锰的混合物
加热一定质量的氯酸钾与二氧化锰的混合物
9.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
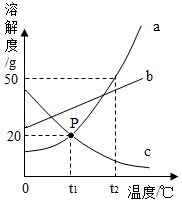

- A. 三种物质的溶解度由大到小的顺序是a>b>c
- B. 将c的饱和溶液变为不饱和溶液,可采用升温的方法
- C. t2℃时,等质量的三种物质的饱和溶液中含溶剂质量c>b>a
- D. t1℃时,将15g c物质加入到50g水中充分搅拌,得到65g c的饱和溶液
10.在工业上可以利用磷石膏(主要成分CaSO4•2H2O)生产硫酸,同时联合生产水泥、化学肥料等,其工艺流程如图。下列说法正确的是( )
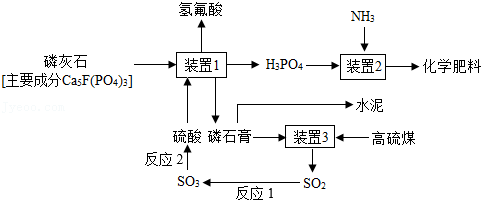

- A. 反应1和反应2中硫元素化合价都发生变化
- B. 装置2中一定发生了中和反应
- C. 流程中得到的化学肥料属于氮肥
- D. Ca5F(PO4)3中钙、磷元素的质量比为5:3
11.填空:
(1)日常生活中通常向水中滴加 来检验硬水和软水。
(2)用“活性炭超滤膜紫外线”组合工艺获得直饮水。其中活性炭的作用是 。
(3)蒸汽眼罩可以缓解眼部疲劳,其发热体中的主要成分是铁粉、氯化钠和碳粉等。其中氯化钠的作用是 。
(4)若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。试画出氯离子结构示意图 。
(5)抗疫中常用的消毒剂有“84”消毒液【有效成分为次氯酸钠和二氧化氯(ClO2)】,次氯酸钠(NaClO)中氯元素的化合价是 。
(6)固体MgH2是氢能源汽车的供能剂,MgH2可以和水反应生成氢氧化镁,同时释放出氢气,该反应的化学方程式为 。
(1)日常生活中通常向水中滴加 来检验硬水和软水。
(2)用“活性炭超滤膜紫外线”组合工艺获得直饮水。其中活性炭的作用是 。
(3)蒸汽眼罩可以缓解眼部疲劳,其发热体中的主要成分是铁粉、氯化钠和碳粉等。其中氯化钠的作用是 。
(4)若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。试画出氯离子结构示意图 。
(5)抗疫中常用的消毒剂有“84”消毒液【有效成分为次氯酸钠和二氧化氯(ClO2)】,次氯酸钠(NaClO)中氯元素的化合价是 。
(6)固体MgH2是氢能源汽车的供能剂,MgH2可以和水反应生成氢氧化镁,同时释放出氢气,该反应的化学方程式为 。
12.通过学习你已经掌握了氧气的实验室制取有关知识,请结合如图回答问题。
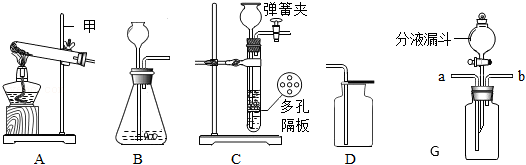
(1)写出仪器甲的名称 。
(2)收集某气体只能采用D装置,由此推测该气体具有的性质是 、 (答两点)。
(3)实验室制取二氧化碳可选用B装置,若将发生装置由B改为C,其优点是 。下列材料中不适宜用作多孔隔板的是 (填字母)。
a.铁
b.塑料
c.铜
d.石墨
(4)用如图装置验证使石蕊变色的物质是碳酸而不是水或二氧化碳,应采取的实验操作顺序是 (填序号,可重复选用)。
①从b端通氮气
②从分液漏斗中滴加适量水
③从a端通二氧化碳
④将用石蕊溶液染成紫色的干燥纸花放入广口瓶中

(1)写出仪器甲的名称 。
(2)收集某气体只能采用D装置,由此推测该气体具有的性质是 、 (答两点)。
(3)实验室制取二氧化碳可选用B装置,若将发生装置由B改为C,其优点是 。下列材料中不适宜用作多孔隔板的是 (填字母)。
a.铁
b.塑料
c.铜
d.石墨
(4)用如图装置验证使石蕊变色的物质是碳酸而不是水或二氧化碳,应采取的实验操作顺序是 (填序号,可重复选用)。
①从b端通氮气
②从分液漏斗中滴加适量水
③从a端通二氧化碳
④将用石蕊溶液染成紫色的干燥纸花放入广口瓶中
13.I、在宏观、微观和符号之间建立联系是化学学科的特点。图1是锶离子(Sr2+)的结构示意图,图2是某些粒子的结构示意图。读图回答问题。
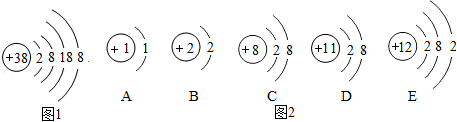
(1)锶属于 (填“金属”或“非金属”)元素。
(2)图2中粒子表示的元素化学性质和锶元素化学性质相似的是 (填字母)。
(3)图中某两种粒子能够结合成一种物质,该物质的化学式为 。
Ⅱ、如图3是某密闭容器中物质变化过程的微观示意图。

(4)A、B、C中表示混合物的是 。
(5)上述变化I、Ⅱ和Ⅲ中,属于化学变化的是 。(填“I”“Ⅱ”或“Ⅲ”)
Ⅲ、人类对科学规律的认识常需经历漫长的探索过程,对金属活动性规律的认识也是如此。
(6)1625年格劳贝尔发现将金属放入稀盐酸中会“消失”,这为发现金属活动性顺序奠定了基础,小嘉选用锡、铜、锌三种金属重温实验,则会“消失”的金属有 。
(7)1865年贝开托夫经过大量的实验得出了金属活动性规律。小嘉运用该规律开展实验,向硝酸铜和硝酸银的混合溶液中逐渐加入铁粉,溶液质量变化如图4所示,则B点时溶液中所含的金属阳离子有 。(填离子符号)

(1)锶属于 (填“金属”或“非金属”)元素。
(2)图2中粒子表示的元素化学性质和锶元素化学性质相似的是 (填字母)。
(3)图中某两种粒子能够结合成一种物质,该物质的化学式为 。
Ⅱ、如图3是某密闭容器中物质变化过程的微观示意图。

(4)A、B、C中表示混合物的是 。
(5)上述变化I、Ⅱ和Ⅲ中,属于化学变化的是 。(填“I”“Ⅱ”或“Ⅲ”)
Ⅲ、人类对科学规律的认识常需经历漫长的探索过程,对金属活动性规律的认识也是如此。
(6)1625年格劳贝尔发现将金属放入稀盐酸中会“消失”,这为发现金属活动性顺序奠定了基础,小嘉选用锡、铜、锌三种金属重温实验,则会“消失”的金属有 。
(7)1865年贝开托夫经过大量的实验得出了金属活动性规律。小嘉运用该规律开展实验,向硝酸铜和硝酸银的混合溶液中逐渐加入铁粉,溶液质量变化如图4所示,则B点时溶液中所含的金属阳离子有 。(填离子符号)
14.我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献。如图是侯氏联合制碱法和西方索尔维制碱法的工艺流程。(已知,NH4Cl
NH3↑+HCl↑)

根据以上信息回答下列问题。
(1)盐水精制的过程是除去溶液中各种杂质的过程。为将盐水中含有的MgCl2以沉淀除去,可以向其中加入过量的 (填试剂名称)来除去。
(2)上述流程的侯氏联合制碱法中,可循环利用的物质是 。(写一种)
(3)氨碱工业最关键的一步是:在加压的条件下,不断向饱和的氨盐水中通入二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要“加压”的原因: 。
(4)在氨碱工业的历史上,如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”,即在氯化铵溶液中加入物质X (填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体。降低了氯化铵的 ,使氯化铵晶体单独析出得到另一种产品一一氮肥。
(5)在氨碱工业处理剩余的氯化铵溶液时,不直接加热蒸发结晶析出氯化铵固体的原因是: 。
| △ |

根据以上信息回答下列问题。
(1)盐水精制的过程是除去溶液中各种杂质的过程。为将盐水中含有的MgCl2以沉淀除去,可以向其中加入过量的 (填试剂名称)来除去。
(2)上述流程的侯氏联合制碱法中,可循环利用的物质是 。(写一种)
(3)氨碱工业最关键的一步是:在加压的条件下,不断向饱和的氨盐水中通入二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要“加压”的原因: 。
(4)在氨碱工业的历史上,如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”,即在氯化铵溶液中加入物质X (填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体。降低了氯化铵的 ,使氯化铵晶体单独析出得到另一种产品一一氮肥。
(5)在氨碱工业处理剩余的氯化铵溶液时,不直接加热蒸发结晶析出氯化铵固体的原因是: 。
15.A~H是初中化学常见的物质,其中A是大理石的主要成分,反应①为中和反应,反应中部分生成物已略去。请回答下列问题:
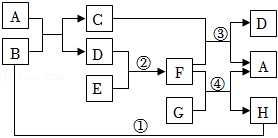
(1)物质C的化学式为 。
(2)反应③ (填“是”或“不是”)基本反应类型。
(3)E物质在生活中常见的用途是: 。
(4)写出反应④的化学方程式: 。

(1)物质C的化学式为 。
(2)反应③ (填“是”或“不是”)基本反应类型。
(3)E物质在生活中常见的用途是: 。
(4)写出反应④的化学方程式: 。
16.某化学外组模拟工业生产制取HNO3,设计如图所示装置,其中a为一个可持续鼓入空气的橡皮球。请回答下列问题。
已知:①NH3与O2在催化剂和加热条件下,生成NO气体和水。
②NO2与液态水反应生成HNO3溶液和NO气体。
③NO气体在空气中易被氧化为NO2。

(1)写出装置A中主要反应的化学方程式 。
(2)装置B鼓入空气的作用是 。
(3)装置C中浓H2SO4的作用是 。
(4)装置E中主要反应的化学方程式 。
(5)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计如图所示装置(仪器固定装置省略未画)进行验证。实验步骤如下:
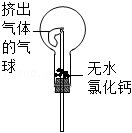
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是 。
由此,该同学得出结论:不能用CaCl2代替碱石灰。
(6)该小组拟利用所得HNO3制取Cu(NO3)2,他们设计了两个方案:
方案一:直接用铜屑与稀硝酸反应来制取硝酸铜;
反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
方案二:先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜。
通过小组讨论,一致认为 (填“方案一”或“方案二”)更好,另一个方案的缺点是 。(写一点)
已知:①NH3与O2在催化剂和加热条件下,生成NO气体和水。
②NO2与液态水反应生成HNO3溶液和NO气体。
③NO气体在空气中易被氧化为NO2。

(1)写出装置A中主要反应的化学方程式 。
(2)装置B鼓入空气的作用是 。
(3)装置C中浓H2SO4的作用是 。
(4)装置E中主要反应的化学方程式 。
(5)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计如图所示装置(仪器固定装置省略未画)进行验证。实验步骤如下:

①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是 。
由此,该同学得出结论:不能用CaCl2代替碱石灰。
(6)该小组拟利用所得HNO3制取Cu(NO3)2,他们设计了两个方案:
方案一:直接用铜屑与稀硝酸反应来制取硝酸铜;
反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
方案二:先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜。
通过小组讨论,一致认为 (填“方案一”或“方案二”)更好,另一个方案的缺点是 。(写一点)
17.碱是中学学习的一类重要物质,同学们在学习了碱的知识后,对碱的性质产生了浓厚的兴趣,小组的同学分别对碱的性质进行了以下探究。
甲组:利用图1示装置和药品验证可溶性碱的性质。(装置气密性良好,实验前弹簧夹处于关闭状态)
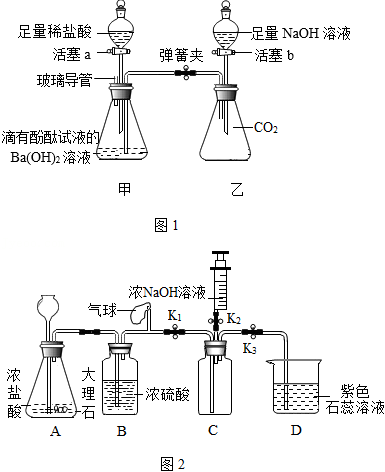
(1)验证可溶性碱能与酸反应,打开活塞a,向锥形瓶中逐滴滴入稀盐酸。Ba(OH)2溶液与稀盐酸恰好完全反应的实验现象是: 。
(2)验证可溶性碱能与CO2反应,完成(1)后,打开活塞b,向锥形瓶中滴入足量的NaOH溶液后,立即关闭活塞。写出验证NaOH溶液与CO2反应的实验操作及现象:操作 ;现象 。
(3)实验后,取乙中锥形瓶内的溶液,倒入烧杯中,若溶液呈红色,请设计实验方案,探究该溶液中是否有氢氧化钠。
乙组:利用如图2装置验证CO2能与NaOH反应。(装置气密性良好)
(4)关闭K2,打开K1、K3,当D中出现 的现象时,可确定C中充满CO2。
(5)C中充满CO2后,关闭K1,打开K2,将注射器中5mL浓NaOH溶液推入C中,观察到D中液体流入C中,说明CO2与NaOH发生反应。C中反应的化学方程式是 ,此过程中,C中压强的变化过程是 。
(6)小组同学发现此实验有不足,请你指出一处 ,写出改进方案 。
甲组:利用图1示装置和药品验证可溶性碱的性质。(装置气密性良好,实验前弹簧夹处于关闭状态)

(1)验证可溶性碱能与酸反应,打开活塞a,向锥形瓶中逐滴滴入稀盐酸。Ba(OH)2溶液与稀盐酸恰好完全反应的实验现象是: 。
(2)验证可溶性碱能与CO2反应,完成(1)后,打开活塞b,向锥形瓶中滴入足量的NaOH溶液后,立即关闭活塞。写出验证NaOH溶液与CO2反应的实验操作及现象:操作 ;现象 。
(3)实验后,取乙中锥形瓶内的溶液,倒入烧杯中,若溶液呈红色,请设计实验方案,探究该溶液中是否有氢氧化钠。
| 实验操作 | 预期现象 | 结论 |
| 取适量液体于试管中,加入 溶液 | 溶液中含有氢氧化钠 |
乙组:利用如图2装置验证CO2能与NaOH反应。(装置气密性良好)
(4)关闭K2,打开K1、K3,当D中出现 的现象时,可确定C中充满CO2。
(5)C中充满CO2后,关闭K1,打开K2,将注射器中5mL浓NaOH溶液推入C中,观察到D中液体流入C中,说明CO2与NaOH发生反应。C中反应的化学方程式是 ,此过程中,C中压强的变化过程是 。
(6)小组同学发现此实验有不足,请你指出一处 ,写出改进方案 。
18.某化学兴趣小组在老师指导下开展有关碳酸氢钙【Ca(HCO3)2】的探究性学习。已知:碳酸氢钙是一种易溶于水的白色固体,受热易分解生成碳酸钙、二氧化碳和水;碳酸钙高温分解生成氧化钙和二氧化碳,该小组取质量为16.2g的碳酸氢钙样品进行加热分解实验,加热过程中剩余固体的质量随加热时间的变化如图一所示。该小组查阅资料发现,碳酸氢钙既能与稀盐酸反应,也能与石灰水反应,反应化学方程式如下:Ca(HCO3)2+2HCl═CaCl2+2H2O+2CO2↑、Ca(HCO3)2+Ca(OH)2═2CaCO3↓+2H2O。于是,他们构建了由碳酸氢钙转化为二氧化碳的不同路径的反应转化关系如图二所示。
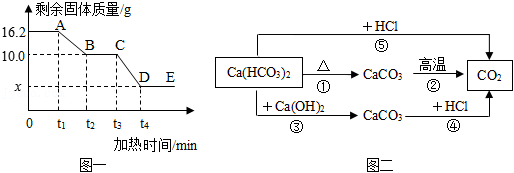
(1)图一中,X数值为 。
(2)16.2g的碳酸氢钙分别利用图二中的三种方法生成的二氧化碳的质量 (“相等”或“不相等”)。
(3)图二中,反应⑤中消耗HCl的质量 (填“大于”“小于”或“等于”)反应④中消耗HCl的质量。(写出计算过程)

(1)图一中,X数值为 。
(2)16.2g的碳酸氢钙分别利用图二中的三种方法生成的二氧化碳的质量 (“相等”或“不相等”)。
(3)图二中,反应⑤中消耗HCl的质量 (填“大于”“小于”或“等于”)反应④中消耗HCl的质量。(写出计算过程)
查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解