下载高清试卷
【2021-2022学年江苏省连云港市东海县九年级(上)期中化学试卷】-第1页
试卷格式:2021-2022学年江苏省连云港市东海县九年级(上)期中化学试卷.PDF
试卷热词:最新试卷、2021年、江苏试卷、连云港市试卷、化学试卷、九年级上学期试卷、期中试卷、初中试卷

扫码查看解析
试卷题目
1.在测定锌、铟等元素的相对原子质量方面做出卓越贡献的中国科学家是( )
- A. 杨振宁
- B. 屠呦呦
- C. 侯德榜
- D. 张青莲
2.一种免洗手消毒凝胶中含有正丙醇(C3H8O)。下列有关正丙醇的说法正确的是( )
- A. 属于氧化物
- B. 1个分子含12个原子
- C. 相对分子质量为60g
- D. 碳元素的质量分数为25%
3.如图所示实验操作正确的是( )
- A.

量取液体 - B.

过滤液体 - C.
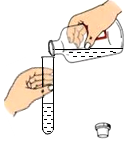
倾倒液体 - D.
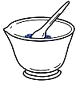
研磨固体
4.空气是一种宝贵资源。下列空气中有关成分的性质与用途具有对应关系的是( )
- A. 氮气的化学性质不活泼,可用作保护气
- B. 氧气不易溶于水,可用于气焊、气割
- C. 氖气无色无味,可用于制作霓虹灯
- D. 氮气的密度很小,可用于制造低温环境
5.请阅读下列材料,回答问题。
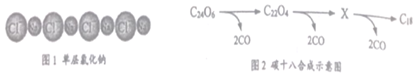
C18是一种完全由碳原子构成的环状分子。科学家借助原子力显微镜(AFM)技术,通过对环状分子C24O6进行原子尺度的操作而制得,方法如下:首先通过“湿化学”法合成C24O6,然后将该环状分子放置在高真空腔体中的单层氯化钠(见图1)上,通过原子力显微镜调控电流来触发反应,最终将所有的多余原子除去,反应过程如图2所示。
下列表示相关微粒的化学用语正确的是( )
C18是一种完全由碳原子构成的环状分子。科学家借助原子力显微镜(AFM)技术,通过对环状分子C24O6进行原子尺度的操作而制得,方法如下:首先通过“湿化学”法合成C24O6,然后将该环状分子放置在高真空腔体中的单层氯化钠(见图1)上,通过原子力显微镜调控电流来触发反应,最终将所有的多余原子除去,反应过程如图2所示。

下列表示相关微粒的化学用语正确的是( )
- A. X的化学式:C20O2
- B. CO中C元素的化合价:O
+4 C - C. 18个碳原子:C18
- D. C1-的结构示意图:
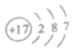
6.请阅读下列材料,回答问题。
C18是一种完全由碳原子构成的环状分子。科学家借助原子力显微镜(AFM)技术,通过对环状分子C24O6进行原子尺度的操作而制得,方法如下:首先通过“湿化学”法合成C24O6,然后将该环状分子放置在高真空腔体中的单层氯化钠(见图1)上,通过原子力显微镜调控电流来触发反应,最终将所有的多余原子除去,反应过程如图2所示。
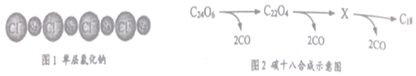
下列说法正确的是( )
C18是一种完全由碳原子构成的环状分子。科学家借助原子力显微镜(AFM)技术,通过对环状分子C24O6进行原子尺度的操作而制得,方法如下:首先通过“湿化学”法合成C24O6,然后将该环状分子放置在高真空腔体中的单层氯化钠(见图1)上,通过原子力显微镜调控电流来触发反应,最终将所有的多余原子除去,反应过程如图2所示。

下列说法正确的是( )
- A. 氯化钠由钠原子和氯原子构成
- B. C24O6→C22O4的反应属于化合反应
- C. CO由1个碳元素和1个氧元素组成
- D. C24O6中C、O元素的质量比为3:1
7.电解水实验如图所示。下列说法正确的是( )


- A. 硫酸钠的化学式为NaSO4
- B. 量筒1中得到H2
- C. 加入硫酸钠的目的是加快反应速率
- D. 实验说明水是由H2和O2组成
8.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将少量二氧化锰加入过氧化氢溶液中,有气体产生,且能使带火星的木条复燃 | 二氧化锰是该反应的催化剂 |
| B | 在蜡烛火焰上方罩个内壁蘸有澄清石灰水的烧杯,一段时间后,石灰水变浑浊 | 蜡烛燃烧后生成了二氧化碳气体 |
| C | 用一个大烧杯罩住分别盛有酚酞溶液、浓氨水的两个小烧杯,一段时间后,酚酞溶液变红 | 构成物质的分子间有间隔 |
| D. | 向一定质量的碳酸钠溶液中加入一定量的盐酸,充分反应后称量,混合液的总质量小于混合前二者的质量和 | 该反应不遵循质量守恒定律 |
- A. A
- B. B
- C. C
- D. D
9.如图为自来水厂净水过程示意图。下列说法错误的是( )
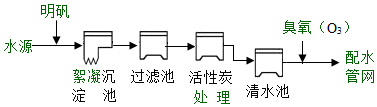

- A. 明矾溶于水后可使水中难溶物沉降
- B. 过滤的目的是除去水中难溶的杂质
- C. 活性炭可吸附水中可溶性杂质而将其除去
- D. 添加臭氧的目的是增大水中氧气的含量
10.X、Y、Z和碳12四种原子的构成和质量如下表所示,下列说法正确的是( )
| 原子种类 | 核电荷数 | 质子数 | 中子数 | 核外电子数 | 质量 |
| X | 1 | 0 | |||
| Y | 1 | 1 | |||
| Z | 8 | a | |||
| 碳12 | 6 | 6 | b |
- A. X、Y属于不同种元素
- B. Z的相对原子质量为
12a b - C. 碳12原子的最外层电子数为6
- D. X与Z构成的化合物必定是X2Z
11.汽车排放的尾气中常含有有毒的NO气体,利用固体表面催化工艺可将NO按如图所示过程(①~④)分解。
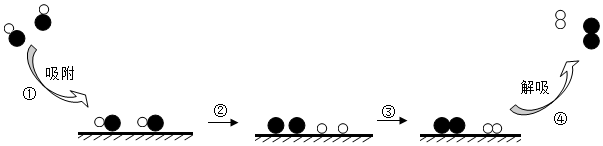
下列说法正确的是( )

下列说法正确的是( )
- A. NO分解的化学方程式为NON+O
催化剂 - B. NO分解的中间产物为N2O2
- C. 过程②的变化属于物理变化
- D. 该工艺可减轻汽车尾气造成的污染
12.兴趣小组对“人体吸入的空气和呼出的气体有什么不同”进行探究,实验步骤及现象如下:
步骤一:收集两瓶呼出的气体,测得其中O2、CO2的体积分数分别为16%、4%。
步骤二:向其中一瓶气体中加入澄清的石灰水,振荡,石灰水变浑浊。
步骤三:向另一瓶气体中插入燃着的木条,燃着的木条熄灭。
步骤四:将燃着的木条插入含O2和CO2混合气(O2占20%,CO2占80%)的集气瓶中,木条正常燃烧。
下列说法错误的是( )
步骤一:收集两瓶呼出的气体,测得其中O2、CO2的体积分数分别为16%、4%。
步骤二:向其中一瓶气体中加入澄清的石灰水,振荡,石灰水变浑浊。
步骤三:向另一瓶气体中插入燃着的木条,燃着的木条熄灭。
步骤四:将燃着的木条插入含O2和CO2混合气(O2占20%,CO2占80%)的集气瓶中,木条正常燃烧。
下列说法错误的是( )
- A. 步骤一所收集的气体中O2的含量比空气中的低
- B. 步骤二中使石灰水变浑浊的气体一定不是O2
- C. 步骤三中燃着的木条熄灭是因为气体中CO2含量高
- D. 步骤四中木条燃烧时反应方程式为C+O2CO2
点燃
13.氧气是一种重要的化工原料,常用于炼钢、气焊、航天以及化工生产。
(1)发现,中国早在唐代就发现用火硝(即硝酸钾)加热后就能产生“阴气”(即氧气),比欧洲发现氧气的时间早了1000多年。组成硝酸钾的元素有3种,请写出其中任意一种元素符号: 。
(2)制备。实验室中常用如图实验装置制备少量氧气。
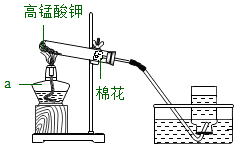
①仪器a的名称是 。
②加热KMnO4制取O2的化学方程式为 。
③实验结束时,为防止水槽里的水倒流,应采取的操作是 。
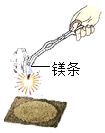
(3)性质。取一根用砂纸打磨干净的镁条,在石棉网上方将其点燃。
①可观察到的实验现象是 。
②燃烧产物中除了氧化镁之外,还有少量的氮化镁。已知氮化镁中氮元素的化合价为-3,则氮化镁的化学式为 。
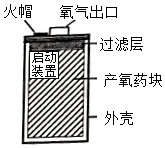
(4)应用。某简易制氧装置的示意图如图,其原理是通过撞击火帽触发启动装置产生热量,使产氧药块分解而持续释放氧气。若产氧药块由氯酸钾(KClO3)和二氧化锰等组成,为得到一个人呼吸1小时所需氧气的量(折算后质量为24g),计算产氧药块中至少含氯酸钾的质量。(写出计算过程,否则不得分)
(1)发现,中国早在唐代就发现用火硝(即硝酸钾)加热后就能产生“阴气”(即氧气),比欧洲发现氧气的时间早了1000多年。组成硝酸钾的元素有3种,请写出其中任意一种元素符号: 。
(2)制备。实验室中常用如图实验装置制备少量氧气。

①仪器a的名称是 。
②加热KMnO4制取O2的化学方程式为 。
③实验结束时,为防止水槽里的水倒流,应采取的操作是 。
(3)性质。取一根用砂纸打磨干净的镁条,在石棉网上方将其点燃。
①可观察到的实验现象是 。
②燃烧产物中除了氧化镁之外,还有少量的氮化镁。已知氮化镁中氮元素的化合价为-3,则氮化镁的化学式为 。

(4)应用。某简易制氧装置的示意图如图,其原理是通过撞击火帽触发启动装置产生热量,使产氧药块分解而持续释放氧气。若产氧药块由氯酸钾(KClO3)和二氧化锰等组成,为得到一个人呼吸1小时所需氧气的量(折算后质量为24g),计算产氧药块中至少含氯酸钾的质量。(写出计算过程,否则不得分)

14.“天问一号”巡视器成功着陆火星,标志着我国航天事业取得突破性进展。火星拥有丰富的金属矿物(如Fe2O3)、CO2等资源。火星低层大气的主要成分如下表:
(1)从A或B两题中任选一个作答,若两题均作答,按A计分。
A.Fe2O3的名称: 。
B.2N2表示: 。
(2)如图1是Ar(氩)在元素周期表中的部分信息,氩-39原子可用于测定地下水和冰层的年龄,它的质子数和中子数之和为39,则其中子数为 。

(3)若要鉴别一瓶火星低层大气和一瓶空气,可采用的化学方法是 。
(4)为了人类未来可在火星上生活,化学家研究通过如图2所示过程将二氧化碳转化为氧气。
①反应Ⅰ的化学方程式为 。
②若将44g二氧化碳通过图2所示过程转化为氧气,理论上可得 g氧气。
| 气体成分 | CO2 | N2 | Ar | O2 | 其它 |
| 体积分数/% | 95.32 | 2.7 | 1.6 | 0.13 | 0.25 |
(1)从A或B两题中任选一个作答,若两题均作答,按A计分。
A.Fe2O3的名称: 。
B.2N2表示: 。
(2)如图1是Ar(氩)在元素周期表中的部分信息,氩-39原子可用于测定地下水和冰层的年龄,它的质子数和中子数之和为39,则其中子数为 。

(3)若要鉴别一瓶火星低层大气和一瓶空气,可采用的化学方法是 。
(4)为了人类未来可在火星上生活,化学家研究通过如图2所示过程将二氧化碳转化为氧气。
①反应Ⅰ的化学方程式为 。
②若将44g二氧化碳通过图2所示过程转化为氧气,理论上可得 g氧气。
15.阅读下列科普短文,回答问题。
二氧化氯(ClO2)在通常情况下是一种黄绿色、具有强烈刺激性气味的气体,沸点为11℃,极易溶于水且不与水反应,在空气中的体积分数超过10%时有爆炸性。它具有广谱、高效、安全、环保等优点,被世界卫生组织(WHO)列为Al级高效杀菌、消毒剂,广泛应用于水体的杀菌、消毒。
实验室中常以氯酸钠(NaClO3)等物质为原料制备ClO2,工业上则常用甲醇还原法和盐酸法来制备ClO2。甲醇还原法的优点是原子利用率高,污染较小,但设备较为复杂,要求高;盐酸法的优势是工艺简单、对设备的要求不高,反应条件易于控制,但易产生杂质气体,且污染较大,不利于绿色环保。盐酸法的反应原理为2NaClO3+4HCl═2NaCl+2H2O+2ClO2↑+Cl2↑。
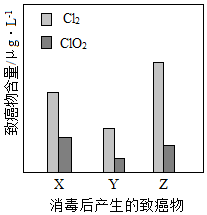
氯气和二氧化氯均可用于城市污水再生水的消毒,实验测得消毒后水中三种不同的致癌物(X、Y、Z)的含量如图所示。
依据文章内容,回答下列问题:
(1)ClO2分子的结构与水分子相似,分子内两个氧原子仅与氯原子结合。以●表示氯原子,以〇表示氧原子,请画出ClO2分子的模型: 。
(2)实验室中制备ClO2的反应方程式为2NaClO3+M+H2SO4═2NaHSO4+2ClO2(已配平),则M的化学式为 ,反应后,氯元素的化合价 (填“升高”、“降低”或“不变”)。
(3)甲醇还原法制备ClO2的优点是 ;盐酸法制备ClO2时产生的具有污染性的杂质气体是 (写化学式)。
(4)历史上曾用CuCl2作催化剂,在加热时,用空气中的氧气来氧化HCl气体制取氯气,所得另一产物的相对分子质量为18,则该反应的化学方程式为 。
(5)跟Cl2相比,使用ClO2对城市污水再生水进行消毒,致癌物 (选“X”、“Y”或“Z”)的减少最显著。
二氧化氯(ClO2)在通常情况下是一种黄绿色、具有强烈刺激性气味的气体,沸点为11℃,极易溶于水且不与水反应,在空气中的体积分数超过10%时有爆炸性。它具有广谱、高效、安全、环保等优点,被世界卫生组织(WHO)列为Al级高效杀菌、消毒剂,广泛应用于水体的杀菌、消毒。
实验室中常以氯酸钠(NaClO3)等物质为原料制备ClO2,工业上则常用甲醇还原法和盐酸法来制备ClO2。甲醇还原法的优点是原子利用率高,污染较小,但设备较为复杂,要求高;盐酸法的优势是工艺简单、对设备的要求不高,反应条件易于控制,但易产生杂质气体,且污染较大,不利于绿色环保。盐酸法的反应原理为2NaClO3+4HCl═2NaCl+2H2O+2ClO2↑+Cl2↑。
氯气和二氧化氯均可用于城市污水再生水的消毒,实验测得消毒后水中三种不同的致癌物(X、Y、Z)的含量如图所示。

依据文章内容,回答下列问题:
(1)ClO2分子的结构与水分子相似,分子内两个氧原子仅与氯原子结合。以●表示氯原子,以〇表示氧原子,请画出ClO2分子的模型: 。
(2)实验室中制备ClO2的反应方程式为2NaClO3+M+H2SO4═2NaHSO4+2ClO2(已配平),则M的化学式为 ,反应后,氯元素的化合价 (填“升高”、“降低”或“不变”)。
(3)甲醇还原法制备ClO2的优点是 ;盐酸法制备ClO2时产生的具有污染性的杂质气体是 (写化学式)。
(4)历史上曾用CuCl2作催化剂,在加热时,用空气中的氧气来氧化HCl气体制取氯气,所得另一产物的相对分子质量为18,则该反应的化学方程式为 。
(5)跟Cl2相比,使用ClO2对城市污水再生水进行消毒,致癌物 (选“X”、“Y”或“Z”)的减少最显著。
16.水的硬度与水中所含的可溶性钙、镁化合物的量有关,钙、镁化合物的含量越高,则水的硬度越大,兴趣小组利用相关仪器和试剂以“探究水的硬度”为主题开展项目式学习。
【任务一】探究水的硬度、肥皂水的用量与产生的泡沫量的关系
步骤一:取2支洁净试管,分别编号为Ⅰ、Ⅱ,均加入5mL蒸馏水,然后依次滴加不同体积的肥皂水,振荡。
步骤二:另取4支试管,分别编号为Ⅲ、Ⅳ、Ⅴ、Ⅵ,先各自加入5mL蒸馏水,然后依次滴加一定量的CaCl2和MgCl2的混合液、肥皂水,振荡。
实验过程中所加CaCl2和MgCl2的混合液、肥皂水的量与振荡后产生的泡沫量如下表所示:
(1)肥皂水能区分软水和硬水,依据的现象是 。
(2)由Ⅱ、Ⅳ、Ⅵ中的实验现象可得到的结论是 。
(3)用硬水洗涤衣服既浪费肥皂也洗不净衣物的原因之一是硬水中的CaCl2与肥皂中的C17H35COONa反应生成难溶的Ca(C17H35COO)2,写出该反应的化学方程式: 。
【任务二】比较不同水样的硬度
取市售纯净水、自来水和煮沸的自来水各5mL于3支洁净的试管中,逐滴加入肥皂水并及时振荡,记录有泡沫产生时所加肥皂水的量。实验装置如图所示,实验数据如下:


(4)硬度最大的水样是 。
(5)设计实验方案,比较西双湖水与自来水的硬度:另取一支试管, 。
(6)煮沸的自来水产生泡沫时所需肥皂水的量比自来水的少,原因是 。
【任务一】探究水的硬度、肥皂水的用量与产生的泡沫量的关系
步骤一:取2支洁净试管,分别编号为Ⅰ、Ⅱ,均加入5mL蒸馏水,然后依次滴加不同体积的肥皂水,振荡。
步骤二:另取4支试管,分别编号为Ⅲ、Ⅳ、Ⅴ、Ⅵ,先各自加入5mL蒸馏水,然后依次滴加一定量的CaCl2和MgCl2的混合液、肥皂水,振荡。
实验过程中所加CaCl2和MgCl2的混合液、肥皂水的量与振荡后产生的泡沫量如下表所示:
| 试管编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ |
| 混合液用量/滴 | 0 | 0 | 1 | 1 | 2 | 2 |
| 肥皂水用量/滴 | 5 | 10 | 5 | 10 | 5 | 10 |
| 产生的泡沫量 | 少 | 多 | 无 | 少 | 无 | 无 |
(1)肥皂水能区分软水和硬水,依据的现象是 。
(2)由Ⅱ、Ⅳ、Ⅵ中的实验现象可得到的结论是 。
(3)用硬水洗涤衣服既浪费肥皂也洗不净衣物的原因之一是硬水中的CaCl2与肥皂中的C17H35COONa反应生成难溶的Ca(C17H35COO)2,写出该反应的化学方程式: 。
【任务二】比较不同水样的硬度
取市售纯净水、自来水和煮沸的自来水各5mL于3支洁净的试管中,逐滴加入肥皂水并及时振荡,记录有泡沫产生时所加肥皂水的量。实验装置如图所示,实验数据如下:


| 水样 | 纯净水 | 自来水 | 煮沸的自来水 |
| 肥皂水用量/滴 | 2 | 9 | 6 |
(4)硬度最大的水样是 。
(5)设计实验方案,比较西双湖水与自来水的硬度:另取一支试管, 。
(6)煮沸的自来水产生泡沫时所需肥皂水的量比自来水的少,原因是 。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解