下载高清试卷
【2019年广西省桂林市中考化学试卷】-第1页
试卷格式:2019年广西省桂林市中考化学试卷.PDF
试卷热词:最新试卷、2019年、广西试卷、桂林市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.垃圾分类回收是绿色新时尚,矿泉水瓶可归为( )
- A. 厨余垃圾
- B. 有害垃圾
- C. 其他垃圾
- D. 可回收垃圾
2.下列变化过程中,一定存在化学变化的是( )
- A. 木条折断
- B. 木条燃烧
- C. 玻璃破碎
- D. 石蜡熔化
3.下列仪器中,可用于准确量取一定体积液体的是( )
- A. 量筒
- B. 试管
- C. 集气瓶
- D. 锥形瓶
4.下列实验操作正确的是( )
- A.
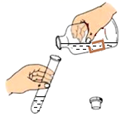
倾倒液体 - B.
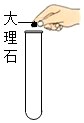
取固体药品 - C.
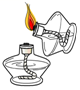
点燃酒精灯 - D.
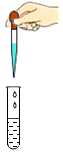
向试管中滴加液体
5.导致人"煤气中毒"的物质是( )
- A. 氮气
- B. 氧气
- C. 一氧化碳
- D. 二氧化碳
6.元素"Al"的名称是( )
- A. 氯
- B. 铝
- C. 硅
- D. 氦
7.已知K2O中O元素的化合价为-2,则K元素的化合价是( )
- A. -1
- B. 0
- C. +1
- D. +2
8.下列物质能在纯氧中剧烈燃烧,火星四射的是( )
- A. 铁丝
- B. 红磷
- C. 氢气
- D. 蜡烛
9.下列物质不能用于实验室制取氧气的是( )
- A. KMnO4
- B. KClO3
- C. KCl
- D. H2O2
10.下列物品不是由有机合成材料制成的是( )
- A. 金戒指
- B. 塑料桶
- C. 人造羊毛毯
- D. 合成橡胶管
11.俗称"纯碱"的物质是( )
- A. H2SO4
- B. HCl
- C. Na2CO3
- D. Cu(OH)2
12.下列物质由阴阳离子构成的是( )
- A. 铜
- B. 氧气
- C. 金刚石
- D. 氯化钠
13.下列方法可将海水转化为淡水的是( )
- A. 蒸馏
- B. 静置
- C. 过滤
- D. 消毒
14.下列做法错误的是( )
- A. 加油站内严禁烟火
- B. 电器起火应立即用水灭火
- C. 炒菜时油锅起火可盖上锅盖灭火
- D. 发现火情应及时拨打119
15.下列关于物质用途的说法,错误的是( )
- A. 工业酒精可用于配制饮用酒
- B. 活性炭可用于防毒面具
- C. 氮气可用于制氮肥
- D. 食盐可用作调味品
16.如图所示的四种物质中,碱性最强的是( )


- A. 陈醋
- B. 橙汁
- C. 纯净水
- D. 肥皂水
17.《吕氏春秋》记载"金(即铜单质)柔锡(即锡单质)柔,合两柔则刚(即坚硬)"。这句话说明合金具有的特性是( )
- A. 合金的熔点一般比其组分低
- B. 合金的硬度一般比其组分大
- C. 合金的抗腐蚀性一般比其组分强
- D. 合金的耐磨性一般比其组分好
18.甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是( )
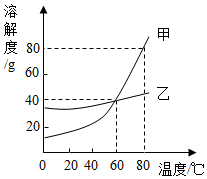

- A. 80℃时,甲的饱和溶液中溶质与溶剂的质量比为4:5
- B. 用蒸发结晶的方法可从乙的饱和溶液中获得大量的乙
- C. 分别将60℃的甲、乙饱和溶液升温至80℃,此时甲溶液的溶质质量分数最大
- D. 60℃时,向140g甲饱和溶液中先加50g水,再加20g甲,充分溶解后,溶液仍为饱和状态
19.某混合气中可能有CO、水蒸气、CO2和N2中的两种或多种。为测定其组成,现将混合气依次通过浓硫酸、灼热的Fe2O3、澄清石灰水。一段时间后,浓硫酸质量增加,Fe2O3固体由红变黑,澄清石灰水变浑浊且有剩余气体。下列说法正确的是( )
- A. 该混合气体中一定有CO、水蒸气和N2,可能有CO2
- B. 该混合气体中一定有水蒸气、CO和CO2,可能有N2
- C. 该混合气体中一定有CO2和N2,可能有CO或水蒸气
- D. 该混合气体中一定有水蒸气和CO,可能有CO2或N2
20.我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120℃时进行,反应过程如图所示。下列说法错误的是( )


- A. 反应前后分子的总数不变
- B. 反应每消耗28g甲,可生成44g丙
- C. 该过程体现了催化剂吸附微粒的选择性
- D. 反应过程中,每消耗1个甲分子,同时消耗1个乙分子
21.用化学用语填空
(1)磷元素 。
(2)3个氮原子 。
(3)钠离子 。
(4)二氧化硫分子 。
(1)磷元素 。
(2)3个氮原子 。
(3)钠离子 。
(4)二氧化硫分子 。
22.2019年是元素周期表发现150周年,该表是学习化学的重要工具。请回答下列问题:
(1)钪是一种稀土元素,在元素周期表中的有关信息如图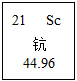 ,由此可知钪是一种 (填"金属"或"非金属")元素,它的相对原子质量是 。
,由此可知钪是一种 (填"金属"或"非金属")元素,它的相对原子质量是 。
(2)如图是一些微粒的结构示意图,请用字母序号填空。
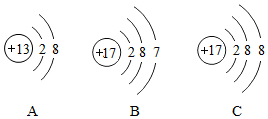
①表示阳离子的是 ,表示原子的是 。
②以上微粒对应的元素有 种。
(1)钪是一种稀土元素,在元素周期表中的有关信息如图
 ,由此可知钪是一种 (填"金属"或"非金属")元素,它的相对原子质量是 。
,由此可知钪是一种 (填"金属"或"非金属")元素,它的相对原子质量是 。(2)如图是一些微粒的结构示意图,请用字母序号填空。

①表示阳离子的是 ,表示原子的是 。
②以上微粒对应的元素有 种。
23.某品牌饼干的配料中含有小麦粉、食用植物油、食用盐、碳酸氢钠等物质。请回答问题:
(1)配料中富含糖类的是 ,食用植物油主要含有的营养素是 (填"油脂"、"蛋白质"或"维生素")。
(2)配料中可用于面点发酵的物质是 。
(3)配料中的食用盐一般为加碘食盐,食盐加碘可预防 (填字母序号)。
a.骨质疏松 b.大脖子病 c.贫血病
(1)配料中富含糖类的是 ,食用植物油主要含有的营养素是 (填"油脂"、"蛋白质"或"维生素")。
(2)配料中可用于面点发酵的物质是 。
(3)配料中的食用盐一般为加碘食盐,食盐加碘可预防 (填字母序号)。
a.骨质疏松 b.大脖子病 c.贫血病
24.金属在生活中随处可见。请回答以下问题:
(1)用金属的下列特性填空(填字母序号):
a.导热性 b.导电性 c.延展性。
①黄金经反复捶打可制成金箔,利用了金有良好的 。
②铁锅常用于烹饪,利用了铁有良好的 。
(2)《淮南万毕术》记载有"曾青(指硫酸铜溶液)得铁化为铜",相关的化学方程式是 ,该反应说明铁的金属活动性比铜 (填"强"或"弱")。
(3)下列钢铁制品最容易生锈的是 (填字母序号)。
a.不锈钢杯子 b.涂油的自行车链条 c.切酸菜后没有洗干净的菜刀
(1)用金属的下列特性填空(填字母序号):
a.导热性 b.导电性 c.延展性。
①黄金经反复捶打可制成金箔,利用了金有良好的 。
②铁锅常用于烹饪,利用了铁有良好的 。
(2)《淮南万毕术》记载有"曾青(指硫酸铜溶液)得铁化为铜",相关的化学方程式是 ,该反应说明铁的金属活动性比铜 (填"强"或"弱")。
(3)下列钢铁制品最容易生锈的是 (填字母序号)。
a.不锈钢杯子 b.涂油的自行车链条 c.切酸菜后没有洗干净的菜刀
25.含碳物质种类繁多。请回答下列问题:
(1)葡萄糖(C6H12O6)中C、H、O原子的数目之比是 。
(2)石墨烯和金刚石均为碳单质,但导电性差异很大,原因是 (填字母序号)。
a.原子的排列方式不同 b.原子在不断运动 c.原子的体积很小
(3)乙醇(C2H5OH)是 (填"可再生"或"不可再生")能源,乙醇完全燃烧的化学方程式是 。该反应中,化学能转变为 能。
(1)葡萄糖(C6H12O6)中C、H、O原子的数目之比是 。
(2)石墨烯和金刚石均为碳单质,但导电性差异很大,原因是 (填字母序号)。
a.原子的排列方式不同 b.原子在不断运动 c.原子的体积很小
(3)乙醇(C2H5OH)是 (填"可再生"或"不可再生")能源,乙醇完全燃烧的化学方程式是 。该反应中,化学能转变为 能。
26.常温下,一锥形瓶中盛有20g溶质质量分数为4%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加溶质质量分数为6.3%的稀硝酸,用pH传感器测得溶液的pH与加入稀硝酸的关系曲线如图。请回答问题:

(1)本实验反应的化学方程式是 。
(2)pH=7时,锥形瓶中的溶液呈 色,此时溶液的溶质质量分数是 (结果精确到0.01%)。
(3)图中a点对应的溶液中溶质的化学式是 。
(4)若改用溶质质量分数为12.6%的稀硝酸进行本实验,pH传感器测得的曲线可能经过 (填“甲”、“乙”或“丙”)点。

(1)本实验反应的化学方程式是 。
(2)pH=7时,锥形瓶中的溶液呈 色,此时溶液的溶质质量分数是 (结果精确到0.01%)。
(3)图中a点对应的溶液中溶质的化学式是 。
(4)若改用溶质质量分数为12.6%的稀硝酸进行本实验,pH传感器测得的曲线可能经过 (填“甲”、“乙”或“丙”)点。
27.甲、乙、丙均为初中化学常见的物质,三者之间的转化也均为初中化学常见的反应。如图是它们的转化关系("→"表示某一物质可转化为另外一种物质,部分反应物、生成物及反应条件已略去)。请回答问题:
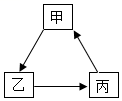
(1)若甲是一种红色单质,则甲的化学式是 ,乙→丙的现象是 。
(2)若甲的相对分子质量比乙小18,则甲→乙的基本反应类型是 ,丙的物质类别是 (填"酸"、"碱"、"盐"或"氧化物")。
(3)若甲→乙的现象是产生大量白烟,则甲→乙的化学方程式是 ,检验乙中阴离子需要的试剂是 (填化学式)。

(1)若甲是一种红色单质,则甲的化学式是 ,乙→丙的现象是 。
(2)若甲的相对分子质量比乙小18,则甲→乙的基本反应类型是 ,丙的物质类别是 (填"酸"、"碱"、"盐"或"氧化物")。
(3)若甲→乙的现象是产生大量白烟,则甲→乙的化学方程式是 ,检验乙中阴离子需要的试剂是 (填化学式)。
28.请帮助小红利用下列实验装置制备并研究CO2的性质。
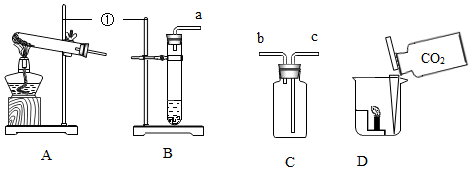
(1)仪器①的名称是 ,装入药品之前应先进行的操作是 。
(2)实验室里制取一瓶CO2气体,应选择的气体发生装置是 (填"A"或"B")。按气体从左到右流动,导管口的连接顺序是a→ → (填接口小写字母)。检验本实验中CO2已经收集满的操作是 。
(3)将收集到的CO2气体按图D进行实验,可观察到蜡烛熄灭。通过该实验可知CO2具有的性质是 (填字母序号)。
a、密度比空气大 b、既不能燃烧也不支持燃烧

(1)仪器①的名称是 ,装入药品之前应先进行的操作是 。
(2)实验室里制取一瓶CO2气体,应选择的气体发生装置是 (填"A"或"B")。按气体从左到右流动,导管口的连接顺序是a→ → (填接口小写字母)。检验本实验中CO2已经收集满的操作是 。
(3)将收集到的CO2气体按图D进行实验,可观察到蜡烛熄灭。通过该实验可知CO2具有的性质是 (填字母序号)。
a、密度比空气大 b、既不能燃烧也不支持燃烧
29.实验课上,老师指导某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
【实验名称】粗盐的提纯
【查阅资料】
1.粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
2.Ba(OH)2是一种易溶于水的强碱。
【主要玻璃仪器】量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
【主要试剂】粗盐样品、稀盐酸、BaCl2溶液,NaOH溶液,Na2CO3溶液,蒸馏水
【实验过程】
(1)以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时: ;过滤时: 。
(2)“加入过量氢氧化钠”时,发生反应的化学方程式是 。
(3)过滤后,所得的滤渣成分有 种。
(4)判断“稀盐酸适量”的方法是 。
(5)将溶液Ⅱ注入 (填仪器名称)中,蒸发结晶,观察到 ,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。
【结果与反思】
(6)实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是 。
(7)小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你 (填“同意”或“不同意”)小明的观点。
【实验名称】粗盐的提纯
【查阅资料】
1.粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
2.Ba(OH)2是一种易溶于水的强碱。
【主要玻璃仪器】量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
【主要试剂】粗盐样品、稀盐酸、BaCl2溶液,NaOH溶液,Na2CO3溶液,蒸馏水
【实验过程】
| 步骤及目的 | 过程及说明 |
| 一、去除粗盐 中的泥沙 | 1.称取粗盐样品10.0g,用蒸馏水充分溶解 2.过滤去除泥沙得到溶液I (1)以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时:________;过滤时:________。 |
| 二、去除可溶 性杂质 | 将溶液I按如图流程图进行处理: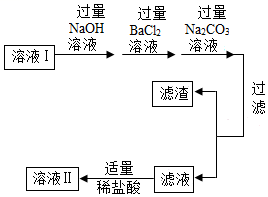 (2)“加入过量氢氧化钠”时,发生反应的化学方程式是________。 (3)过滤后,所得的滤渣成分有________种。 (4)判断“稀盐酸适量”的方法是________。 |
| 三、获得产品 | (5)将溶液Ⅱ注入________(填仪器名称)中,蒸发结晶,观察到________,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。 |
| 四、数据处理 | 该粗盐样品中氯化钠的质量分数是94%。 |
(1)以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时: ;过滤时: 。
(2)“加入过量氢氧化钠”时,发生反应的化学方程式是 。
(3)过滤后,所得的滤渣成分有 种。
(4)判断“稀盐酸适量”的方法是 。
(5)将溶液Ⅱ注入 (填仪器名称)中,蒸发结晶,观察到 ,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。
【结果与反思】
(6)实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是 。
(7)小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你 (填“同意”或“不同意”)小明的观点。
30.为测定某过氧化钠样品的纯度,将2g该样品与足量水发生如下反应(杂质不参与反应):2Na2O2+2H2O═4NaOH+O2↑生成气体质量与时间的关系如图所示。回答问题:
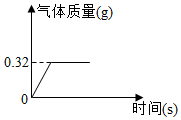
(1)生成氧气的质量是 g。
(2)列式计算该样品中过氧化钠的质量分数。

(1)生成氧气的质量是 g。
(2)列式计算该样品中过氧化钠的质量分数。
查看全部题目