下载高清试卷
【2021年内蒙古赤峰市中考化学二模试卷】-第1页
试卷格式:2021年内蒙古赤峰市中考化学二模试卷.PDF
试卷热词:最新试卷、2021年、内蒙古试卷、赤峰市试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷

扫码查看解析
试卷题目
1.膳食平衡是人体健康的重要保证。蛋白质是构成细胞的基本物质,下列食物中富含蛋白质的是( )
- A. 大米、小麦
- B. 牛奶、鸡蛋
- C. 花生油、猪油
- D. 黄瓜、苹果
2.空气中各成分体积分数如图所示,其中区域“a”代表的是( )
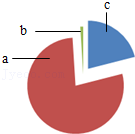

- A. 氧气
- B. 氦气
- C. 氮气
- D. 二氧化碳
3.下列描述正确的是( )
- A. “滴水成冰”是化学变化
- B. “花香四溢”表明分子在不断运动
- C. “釜底抽薪”是为了降低可燃物的着火点
- D. “百炼成钢”指生铁经多次煅炼转化为纯铁
4.在化学反应Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O中没有涉及到的物质类别是( )
| △ |
- A. 单质
- B. 酸
- C. 碱
- D. 盐
5.水是化学学习和研究的重要物质。下列有关水的说法正确的是( )
- A. 冰和水的共存物属于混合物
- B. 有水生成的反应一定属于中和反应
- C. 可用肥皂水区分软水和硬水
- D. 水汽化时体积增大是因水分子变大
6.下面是某同学的化学用语复习笔记,需要改正的是( )
- A. CO2中含有氧分子
- B. 铁离子的符号为Fe3+
- C. 5He表示5个氦原子
- D. O表示氧化镁中镁元素的化合价为+2价
+2 Mg
7.如图是X、Y、Z三种液体的对应近似pH,下列判断不正确的是( )


- A. X显酸性
- B. Y可能是水
- C. Z可能是某种盐溶液
- D. Z可使紫色石蕊试液变红
8.为了及时发现燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),乙硫醇也可以充分燃烧,其反应的化学方程式为:2C2H5SH+9O2
4CO2+2X+6H2O。下列关于X的说法不正确的是( )
| 点燃 |
- A. X由碳、硫、氧三种元素组成
- B. 一个乙硫醇分子中含有6个氢原子
- C. X中硫、氧元素的原子个数比为1:2
- D. X中氧元素的质量分数为50%
9.归纳总结是学习的重要方法。下列各组对主题知识的归纳完全正确的是( )
| A.化学与材料 | B.化学与生活 |
| ①钢筋混凝土属于复合材料 ②青铜和钢属于金属材料 ③塑料、合金、合成橡胶属于合成材料 | ①鉴别棉织物和羊毛织物可灼烧闻气味 ②炒菜时油锅不慎着火可用锅盖盖灭 ③为了食品卫生,大量使用一次性餐具 |
| C.化学与健康 | D.化学与安全 |
| ①食用水果、蔬菜可以补充维生素 ②食用甲醛溶液浸泡的水产品对人体有害 ③碘摄入不足或过量均会引起人体甲状腺肿大 | ①室内发生火灾时,迅速打开门窗 ②夜晚煤气泄漏时,立即开灯检查 ③进入久未开启的菜窖,应先做灯火实验 |
- A. A
- B. B
- C. C
- D. D
10.逻辑推理是一种重要的化学思维方法。下列推理合理的是( )
- A. 阴离子带负电,所以带负电的粒子一定是阴离子
- B. 碱的溶液显碱性,所以显碱性的溶液就是碱的溶液
- C. 化学变化常伴随着能量的变化,所以有能量变化的一定是化学变化
- D. 不纯的可燃性气体燃烧可能发生爆炸,所以点燃可燃性气体之前必须要验纯
11.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是( )


- A. 三种物质的溶解度大小关系为甲>乙>丙
- B. t2℃时,将20g甲加入50g水中,得到70g溶液
- C. t3℃时,用等质量的甲、乙、丙固体配成饱和溶液,需要水的质量大小关系是乙>甲>丙
- D. 将t2℃的三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数大小关系为乙>丙>甲
12.在溶液中能大量共存且呈无色的离子组是( )
- A. Na+、Fe3+、NO3﹣、Cl﹣
- B. Ba2+、NH4+、SO42﹣、OH﹣
- C. Ag+、H+、Cl﹣、NO3﹣
- D. H+、Na+、NO3﹣、SO42﹣
13.下列图象与对应的叙述相符合的是( )
- A.
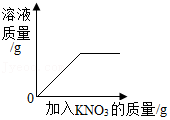 一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体 - B.
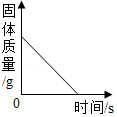 高温灼烧一定质量的大理石
高温灼烧一定质量的大理石 - C.
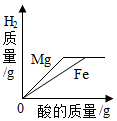 将等质量的Mg、Fe分别与溶质质量分数相同的足量稀硫酸反应
将等质量的Mg、Fe分别与溶质质量分数相同的足量稀硫酸反应 - D.
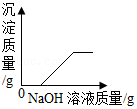 向一定质量的HCl和MgCl2的混合溶液中,逐滴加入NaOH溶液
向一定质量的HCl和MgCl2的混合溶液中,逐滴加入NaOH溶液
14.下列实验方案设计合理的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 除去氢氧化钠溶液中少量碳酸钠 | 加过量的氢氧化钙溶液后过滤 |
| B | 除去氧化钙中少量碳酸钙 | 加适量的稀盐酸 |
| C | 鉴别硝酸钾和氯化铵固体 | 取样,分别与熟石灰混合研磨 |
| D | 鉴别稀盐酸和氯化钠溶液 | 取样,分别滴加硝酸银溶液 |
- A. A
- B. B
- C. C
- D. D
15.能源、环境和安全已成为人类日益关注的问题。请回答下列问题。
(1)目前世界上多数国家利用的能量主要来自煤、石油和 等化石燃料的燃烧。
(2)科技发展可促进新能源的开发利用。下列能源不属于新能源的是 (选填字母序号)。
A.煤
B.地热能
C.太阳能
D.核能
(3)2020年6月23日,北斗三号最后一颗全球组网卫星发射成功。此次卫星发射用的火箭推进剂为液氢和液氧,其反应产物无污染。写出氢气在氧气中燃烧的化学方程式 ,因此氢能源被称为理想的高能燃料,从其燃烧特点看,其具有的特征是 。
(1)目前世界上多数国家利用的能量主要来自煤、石油和 等化石燃料的燃烧。
(2)科技发展可促进新能源的开发利用。下列能源不属于新能源的是 (选填字母序号)。
A.煤
B.地热能
C.太阳能
D.核能
(3)2020年6月23日,北斗三号最后一颗全球组网卫星发射成功。此次卫星发射用的火箭推进剂为液氢和液氧,其反应产物无污染。写出氢气在氧气中燃烧的化学方程式 ,因此氢能源被称为理想的高能燃料,从其燃烧特点看,其具有的特征是 。
16.化学是研究物质的组成、性质、结构和变化规律的一门科学,镁是一种常见的金属,如图为镁的相关信息,请回答下列问题。
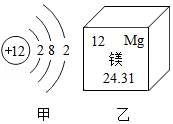
(1)组成和结构:
①从宏观看,镁是由 组成的。
②从微观看,镁原子在化学反应中容易 电子形成镁离子。
(2)性质和变化:
①镁具有可燃性,4.8g镁完全燃烧需要氧气的质量为 。
②向镁条中滴加稀盐酸,产生大量气泡,此反应是一个 (填“放热”或“吸热”)反应。
③把一定量的镁放入硝酸铜和硝酸银的混合溶液中,充分反应后过滤,滤液为无色,则滤渣的组成可能是 (填化学式)。

(1)组成和结构:
①从宏观看,镁是由 组成的。
②从微观看,镁原子在化学反应中容易 电子形成镁离子。
(2)性质和变化:
①镁具有可燃性,4.8g镁完全燃烧需要氧气的质量为 。
②向镁条中滴加稀盐酸,产生大量气泡,此反应是一个 (填“放热”或“吸热”)反应。
③把一定量的镁放入硝酸铜和硝酸银的混合溶液中,充分反应后过滤,滤液为无色,则滤渣的组成可能是 (填化学式)。
17.制造芯片的基材主要是高纯硅。如图是制备高纯硅的一种工艺流程:

回答下列问题:
(1)反应Ⅰ的化学方程式是 。
(2)过滤所得粗硅应充分洗涤,以除去表面可能吸附的HCl和 (填化学式)。
(3)反应Ⅱ的基本类型属于 ;反应Ⅱ要在无氧气环境中进行,原因是 (答出一种即可)。
(4)上述生产流程中,可以循环利用的物质是 (填化学式)。

回答下列问题:
(1)反应Ⅰ的化学方程式是 。
(2)过滤所得粗硅应充分洗涤,以除去表面可能吸附的HCl和 (填化学式)。
(3)反应Ⅱ的基本类型属于 ;反应Ⅱ要在无氧气环境中进行,原因是 (答出一种即可)。
(4)上述生产流程中,可以循环利用的物质是 (填化学式)。
18.阅读下列材料,回答问题。
溶洞里奇妙的石笋和钟乳石许多同学可能参观过溶洞吧?你一定会为洞里千姿百态的石笋和钟乳石而惊叹不已。你是否思考过它们是怎样形成的呢?原来,形成石灰岩地区溶洞岩石的主要成分是碳酸钙,碳酸钙遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙【Ca(HCO3)2】,这也是导致自然界中水的硬度较大的重要原因。溶有碳酸氢钙的水遇热或减压时,溶解在水里的碳酸氢钙又会逐渐分解成难溶的碳酸钙沉积下来,同时产生二氧化碳和水。
上述的变化是一个十分缓慢、长年累月积累的过程。那么,为什么又有石笋、钟乳石和石柱的不同呢?原来洞顶的水在缓慢向下渗漏时,水中的碳酸氢钙发生分解,有的沉积在洞底,慢慢地形成石笋,有的残留在洞顶,渐渐地形成钟乳石,当石笋和钟乳石逐渐相连时就形了石柱。
由于溶有碳酸氢钙的水遇热或减压时,溶解在水里的碳酸氢钙又会逐渐分解成难溶的碳酸钙沉积下来,从而使水中的可溶性钙的化合物又有所减少,水的硬度降低,这也正是我们日常生活中用煮沸的方法来降低水的硬度的原理之一。
请回答下列问题:
(1)石笋和钟乳石的主要成分是 (用化学用语表示)。
(2)溶洞附近水源中的水硬度较大的原因之一是 。
(3)通过煮沸的方法降低水硬度与钟乳石的形成过程有着相同的原理,请用化学方程式表示这一过程 。
(4)小强由上面的材料联想到了在学习二氧化碳的性质时,做了向澄清石灰水中通入二氧化碳的实验,刚通入二氧化碳时,发现澄清的石灰水变浑浊了,他想,如过继续通二氧化碳到过量,则观察到的现象是 。
溶洞里奇妙的石笋和钟乳石许多同学可能参观过溶洞吧?你一定会为洞里千姿百态的石笋和钟乳石而惊叹不已。你是否思考过它们是怎样形成的呢?原来,形成石灰岩地区溶洞岩石的主要成分是碳酸钙,碳酸钙遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙【Ca(HCO3)2】,这也是导致自然界中水的硬度较大的重要原因。溶有碳酸氢钙的水遇热或减压时,溶解在水里的碳酸氢钙又会逐渐分解成难溶的碳酸钙沉积下来,同时产生二氧化碳和水。
上述的变化是一个十分缓慢、长年累月积累的过程。那么,为什么又有石笋、钟乳石和石柱的不同呢?原来洞顶的水在缓慢向下渗漏时,水中的碳酸氢钙发生分解,有的沉积在洞底,慢慢地形成石笋,有的残留在洞顶,渐渐地形成钟乳石,当石笋和钟乳石逐渐相连时就形了石柱。
由于溶有碳酸氢钙的水遇热或减压时,溶解在水里的碳酸氢钙又会逐渐分解成难溶的碳酸钙沉积下来,从而使水中的可溶性钙的化合物又有所减少,水的硬度降低,这也正是我们日常生活中用煮沸的方法来降低水的硬度的原理之一。
请回答下列问题:
(1)石笋和钟乳石的主要成分是 (用化学用语表示)。
(2)溶洞附近水源中的水硬度较大的原因之一是 。
(3)通过煮沸的方法降低水硬度与钟乳石的形成过程有着相同的原理,请用化学方程式表示这一过程 。
(4)小强由上面的材料联想到了在学习二氧化碳的性质时,做了向澄清石灰水中通入二氧化碳的实验,刚通入二氧化碳时,发现澄清的石灰水变浑浊了,他想,如过继续通二氧化碳到过量,则观察到的现象是 。
19.在过氧化氢溶液的分解反应中,某化学兴趣小组发现:除了二氧化锰,硫酸铜溶液也能对H2O2的分解起催化作用。对此,他们进行了有关探究。
【提出问题】CuSO4溶液是混合物,是其中哪一种成分起到了催化作用呢?
【查阅资料】①稀硫酸中主要含有H2O、H+、SO42﹣三种微粒。
②CuSO4溶液中主要含有H2O、Cu2+、SO42﹣三种微粒。
【作出猜想】根据以上信息,同学们作出了如下三个猜想:
Ⅰ:SO42﹣催化分解H2O2
Ⅱ:Cu2+催化分解H2O2
Ⅲ:H2O催化分解H2O2
(1)其中,明显不合理的是 (填序号),理由是 。
【实验验证】
为了验证自己的猜想,同学们设计了如下两个实验(所取H2O2溶液的浓度相同):
(2)现象: ;
(3) ;结论: 。
【实验拓展】
用图甲装置探究影响H2O2分解速率的因素,得到图乙、图丙所示曲线(在等温条件下,产生氧气体积与装置内压强成正比,反应放热忽略不计)。
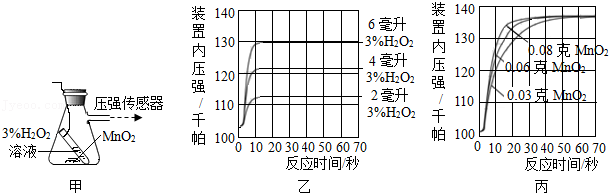
(4)写出图甲中反应的化学方程式 。
(5)图乙是“0.1g MnO2与不同体积的3% H2O2溶液混合”的实验结果,从图中可以看出 。
(6)图丙是用“8mL浓度为3%的H2O2溶液与不同质量的MnO2混合”时,所得到的曲线,通过该曲线可以得到的结论是 。
【提出问题】CuSO4溶液是混合物,是其中哪一种成分起到了催化作用呢?
【查阅资料】①稀硫酸中主要含有H2O、H+、SO42﹣三种微粒。
②CuSO4溶液中主要含有H2O、Cu2+、SO42﹣三种微粒。
【作出猜想】根据以上信息,同学们作出了如下三个猜想:
Ⅰ:SO42﹣催化分解H2O2
Ⅱ:Cu2+催化分解H2O2
Ⅲ:H2O催化分解H2O2
(1)其中,明显不合理的是 (填序号),理由是 。
【实验验证】
为了验证自己的猜想,同学们设计了如下两个实验(所取H2O2溶液的浓度相同):
| 操作 | 现象 | 结论 |
| (2)取5mL H2O2溶液于试管中,滴入少量的稀硫酸,伸入带火星的木条 | ________ | SO42﹣对H2O2的分解不起催化作用 |
| (3)________ | 产生大量气泡,带火星的木条复燃 | ________ |
(2)现象: ;
(3) ;结论: 。
【实验拓展】
用图甲装置探究影响H2O2分解速率的因素,得到图乙、图丙所示曲线(在等温条件下,产生氧气体积与装置内压强成正比,反应放热忽略不计)。

(4)写出图甲中反应的化学方程式 。
(5)图乙是“0.1g MnO2与不同体积的3% H2O2溶液混合”的实验结果,从图中可以看出 。
(6)图丙是用“8mL浓度为3%的H2O2溶液与不同质量的MnO2混合”时,所得到的曲线,通过该曲线可以得到的结论是 。
20.以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想1:不相等;猜想2:相等。
【查阅资料】白磷燃烧的产物在空气中能与水反应生成有毒的偏磷酸(HPO3)等物质。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
(1)有 产生,天平指针向右偏转;
(2)白磷燃烧,产生大量的白烟,放热;气球 ,天平指针没有偏转。
(3)【反思评价】究竟哪种猜想正确?通过对比、讨论,同学们发现甲组中有气体逸出,导致天平指针向右偏转。乙组中反应的化学方程式是 ,有气体参加反应,同时生成易扩散的五氧化二磷粉末。气球起到了缓冲气压和密封的作用,装置内的水除了起到降温作用外还能 。于是得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在 中进行。
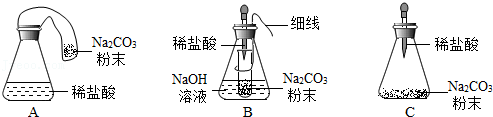
(4)【优化装置】同学们对甲组的反应装置进行了如下3种改进(B中NaOH溶液用于吸收CO2),你认为最佳装置是 (填序号),从另外两种装置中任选一种指出其不足 。
(5)【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步分析发现,反应体系中的器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论: 的各物质的质量总和等于反应后生成的各物质的质量总和。
(6)【解释应用】解释:化学反应前后,原子的 、质量均不变,所以质量守恒。
(7)应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳3种物质,则该固体物质一定由 种元素组成。
【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想1:不相等;猜想2:相等。
【查阅资料】白磷燃烧的产物在空气中能与水反应生成有毒的偏磷酸(HPO3)等物质。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
| 甲组:碳酸钠与稀盐酸反应 | 乙组:白磷燃烧 | |
| 实验方案(天平未画出) | 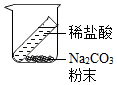 | 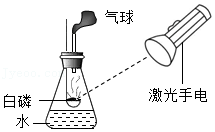 |
| 实验现象 | (1)有________产生,天平指针向右偏转 | (2)白磷燃烧,产生大量的白烟,放热;气球________,天平指针没有偏转 |
| 结论 | 猜想1正确 | 猜想2正确 |
(1)有 产生,天平指针向右偏转;
(2)白磷燃烧,产生大量的白烟,放热;气球 ,天平指针没有偏转。
(3)【反思评价】究竟哪种猜想正确?通过对比、讨论,同学们发现甲组中有气体逸出,导致天平指针向右偏转。乙组中反应的化学方程式是 ,有气体参加反应,同时生成易扩散的五氧化二磷粉末。气球起到了缓冲气压和密封的作用,装置内的水除了起到降温作用外还能 。于是得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在 中进行。
(4)【优化装置】同学们对甲组的反应装置进行了如下3种改进(B中NaOH溶液用于吸收CO2),你认为最佳装置是 (填序号),从另外两种装置中任选一种指出其不足 。

(5)【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步分析发现,反应体系中的器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论: 的各物质的质量总和等于反应后生成的各物质的质量总和。
(6)【解释应用】解释:化学反应前后,原子的 、质量均不变,所以质量守恒。
(7)应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳3种物质,则该固体物质一定由 种元素组成。
查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解