下载高清试卷
【2021-2022学年山东省烟台市莱州市九年级(上)期中化学试卷(五四学制)】-第1页
试卷格式:2021-2022学年山东省烟台市莱州市九年级(上)期中化学试卷(五四学制).PDF
试卷热词:最新试卷、2022年、山东试卷、烟台市试卷、化学试卷、九年级上学期试卷、期中试卷、初中试卷
扫码查看解析
试卷题目
1.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是( )
- A. 白酒
- B. 蒸馏水
- C. 医用酒精
- D. 生理盐水
2.下列为四种食物的近似pH,其中酸性最强的是( )
| 食物 | 牛奶 | 豆浆 | 苹果汁 | 鸡蛋清 |
| pH | 6.3~6.6 | 7.4~7.9 | 2.9~3.3 | 7.6~8.0 |
- A. 牛奶
- B. 豆浆
- C. 苹果汁
- D. 鸡蛋清
3.用汽油或加了洗涤剂的水都能除去衣服上的油污,两者去油污的原理分别是( )
- A. 乳化、乳化
- B. 溶解、乳化
- C. 乳化、溶解
- D. 溶解、溶解
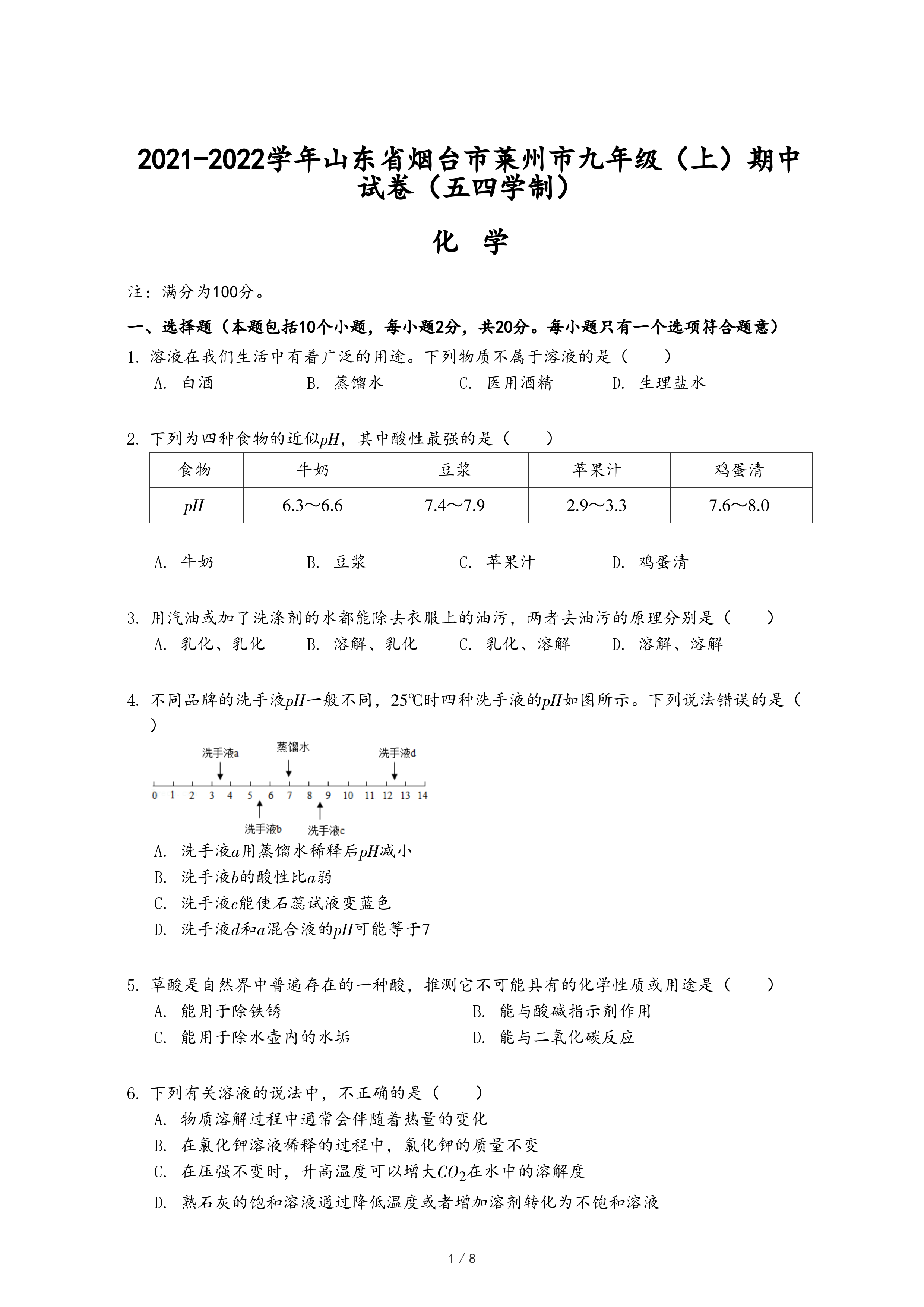
4.不同品牌的洗手液pH一般不同,25℃时四种洗手液的pH如图所示。下列说法错误的是( )
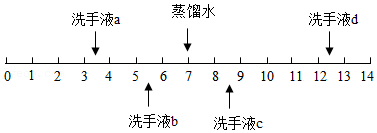

- A. 洗手液a用蒸馏水稀释后pH减小
- B. 洗手液b的酸性比a弱
- C. 洗手液c能使石蕊试液变蓝色
- D. 洗手液d和a混合液的pH可能等于7
5.草酸是自然界中普遍存在的一种酸,推测它不可能具有的化学性质或用途是( )
- A. 能用于除铁锈
- B. 能与酸碱指示剂作用
- C. 能用于除水壶内的水垢
- D. 能与二氧化碳反应
6.下列有关溶液的说法中,不正确的是( )
- A. 物质溶解过程中通常会伴随着热量的变化
- B. 在氯化钾溶液稀释的过程中,氯化钾的质量不变
- C. 在压强不变时,升高温度可以增大CO2在水中的溶解度
- D. 熟石灰的饱和溶液通过降低温度或者增加溶剂转化为不饱和溶液
7.正确的实验操作对实验结果和人身安全都非常重要。下列实验操作错误的是( )
- A.
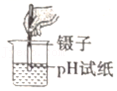 测定溶液的pH
测定溶液的pH - B.
 读取液体体积
读取液体体积 - C.
 稀释浓硫酸
稀释浓硫酸 - D.
 熄灭酒精灯
熄灭酒精灯
8.中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )
- A. 生石灰用于加热即热食品
- B. 氢氧化铝用于治疗胃酸过多
- C. 熟石灰用于改良酸性土壤
- D. 硼酸用于处理皮肤上沾有的碱
9.下列有关说法错误的是( )
- A. 用润湿的pH试纸测定氢氧化钠的pH会使结果偏小
- B. 中和反应可能有沉淀生成
- C. 升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
- D. 饱和溶液的溶质质量分数一定大于不饱和溶液的
10.下列溶液在空气中敞口久置,因发生化学变化导致溶液质量减小的是( )
- A. 浓盐酸
- B. 浓硫酸
- C. 石灰水
- D. 烧碱溶液
11.实验测得Na2CO3和NH4Cl的溶解度曲线如图所示,下列有关说法错误的是( )


- A. t1℃时,100g的Na2CO3饱和溶液中含溶质20g
- B. t1℃时,NH4Cl的溶解度大于Na2CO3的溶解度
- C. t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相同
- D. 将t2℃的NH4Cl的饱和溶液降温至t1℃,有NH4Cl晶体析出
12.稀盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是( )
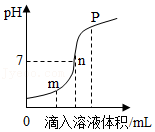

- A. 该反应的基本类型是中和反应
- B. P点所示溶液中的溶质为NaOH
- C. n点表示的溶液中Na+和Cl﹣微粒数目相同
- D. 该图所对应操作是将氢氧化钠溶液滴入稀盐酸中
13.氢氧化钠和碳酸钠的溶解度如表所示。
表:氢氧化钠和碳酸钠溶解度
下列有关分析和推理不正确的是( )
表:氢氧化钠和碳酸钠溶解度
| 溶剂 | 氢氧化钠 | 碳酸钠 | ||
| 20℃ | 40℃ | 20℃ | 40℃ | |
| 水 | 109g | 129g | 21.8g | 49g |
| 酒精 | 17.3g | 40g | 难溶 | 难溶 |
下列有关分析和推理不正确的是( )
- A. 氢氧化钠易溶于水和酒精
- B. 温度相同,同种物质在不同溶剂中溶解度不同
- C. 40℃碳酸钠饱和水溶液溶质质量分数为49%
- D. 20℃时,将足量二氧化碳通入饱和氢氧化钠酒精溶液中,溶液变浑浊
14.推理是化学学习中常用的思维方法,下列推理正确的是( )
- A. 生理盐水、酒精溶液是无色透明的,所以溶液都是无色透明的
- B. 碱溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定显碱性
- C. 盐酸与碳酸盐反应生成CO2气体,与盐酸反应生成气体的物质一定是碳酸盐
- D. 中和反应有盐和水生成,有盐和水生成的反应一定是中和反应
15.向盛有CuSO4和H2SO4混合溶液的烧杯中,逐滴加入NaOH溶液至过量,沉淀质量、溶质质量和溶剂质量随NaOH溶液质量变化关系如图所示。下列说法正确的是( )


- A. 曲线乙代表溶剂质量
- B. Q点溶液中溶质为Na2SO4
- C. O→P过程反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O
- D. 原溶液中CuSO4和H2SO4质量相等
16.生活处处有化学,请用所学知识回答下列问题:
(1)某胃粘膜保护咀嚼片含有碳酸镁成分,服用下此药片后,发生反应的化学方程式为 。
(2)稀盐酸可除去铁锈,反应的化学方程式为 ,实验现象为 、 ;盐酸的加入方式应“少量多次”,因为如果不小心加盐酸过量的话,还会发生反应的化学方程式为 。
(3)硫酸铜、生石灰和水配制农业生产上重要杀菌剂“波尔多液”,发生反应的化学方程式为 、 。
(1)某胃粘膜保护咀嚼片含有碳酸镁成分,服用下此药片后,发生反应的化学方程式为 。
(2)稀盐酸可除去铁锈,反应的化学方程式为 ,实验现象为 、 ;盐酸的加入方式应“少量多次”,因为如果不小心加盐酸过量的话,还会发生反应的化学方程式为 。
(3)硫酸铜、生石灰和水配制农业生产上重要杀菌剂“波尔多液”,发生反应的化学方程式为 、 。
17.研究物质的溶解对于生产、生活有着重要意义。
下表是碳酸钠的部分溶解度数据。
(1)由表中数据可知,碳酸钠属于 物质(填“易溶”“可溶”“微溶”或“难溶”)。
(2)由表中数据可知,碳酸钠的溶解度随温度升高 。
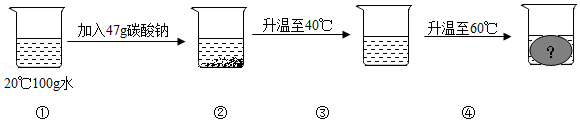
(3)小东同学进行了如图所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入 g碳酸钠;升温至60℃时,烧杯④中会出现的现象是 。
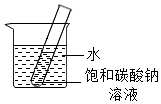
(4)20℃时,将装有饱和碳酸钠溶液(底部有碳酸钠粉末)的小试管放入盛水的烧杯中(如图)。向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是 (填字母序号),该物质形成的溶液中存在的微粒有 。
A. 氢氧化钠
B. 碳酸钙
C. 硝酸铵
D. 氯化钠
下表是碳酸钠的部分溶解度数据。
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 | 45.1 | 44.7 |
(1)由表中数据可知,碳酸钠属于 物质(填“易溶”“可溶”“微溶”或“难溶”)。
(2)由表中数据可知,碳酸钠的溶解度随温度升高 。
(3)小东同学进行了如图所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入 g碳酸钠;升温至60℃时,烧杯④中会出现的现象是 。

(4)20℃时,将装有饱和碳酸钠溶液(底部有碳酸钠粉末)的小试管放入盛水的烧杯中(如图)。向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是 (填字母序号),该物质形成的溶液中存在的微粒有 。

A. 氢氧化钠
B. 碳酸钙
C. 硝酸铵
D. 氯化钠
18.自然界中,有许多植物色素在不同的酸碱性溶液中呈现不同的颜色,这些植物色素也可以作为酸碱指示剂。某兴趣小组用以下仪器自制酸碱指示剂:
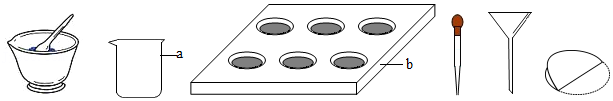
(1)仪器a、b的名称为 a 、b 。
(2)从紫甘蓝叶中提取植物色素的操作步骤如下:
①取适量紫甘蓝叶放在研钵中研碎;
②用水和酒精(体积比1:1)浸泡, (填“过滤”或“蒸发”),取液备用;
③将紫甘蓝提取液分别滴入白醋、石灰水、蒸馏水中,颜色变化如表:
(3)请用紫甘蓝提取液,选用题中给出的仪器,用最少量的试剂鉴别失去标签的稀盐酸和氢氧化钠溶液。写出实验操作及现象与结论。

(1)仪器a、b的名称为 a 、b 。
(2)从紫甘蓝叶中提取植物色素的操作步骤如下:
①取适量紫甘蓝叶放在研钵中研碎;
②用水和酒精(体积比1:1)浸泡, (填“过滤”或“蒸发”),取液备用;
③将紫甘蓝提取液分别滴入白醋、石灰水、蒸馏水中,颜色变化如表:
| 物质 | 白醋 | 石灰水 | 蒸馏水 |
| 显色情况 | 红色 | 绿色 | 蓝色 |
(3)请用紫甘蓝提取液,选用题中给出的仪器,用最少量的试剂鉴别失去标签的稀盐酸和氢氧化钠溶液。写出实验操作及现象与结论。
| 实验操作 | 现象与结论 |
19.同学们走进实验室配制80g 10%的氯化钠溶液,回答下列问题:
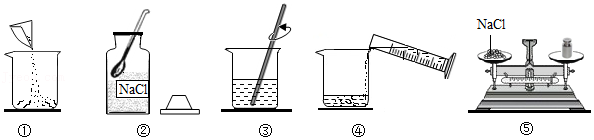
(1)用图中的序号表示配制溶液的正确操作顺序 。图②中的塑料仪器是 。
(2)计算配制80g 10%的氯化钠溶液时,需要称量氯化钠固体的质量为 ,需要蒸馏水的体积为 (室温下,水的密度为1g/mL),量取体积时除量筒外还需要的仪器是 ,所用量筒的规格是 mL(填“10”、“50”或“100”)。
(3)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。
A. 增加适量氯化钠固体
B. 减少适量氯化钠固体
C. 调节平衡螺母
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒目的是 。
(5)下列操作会引起溶液中氯化钠的质量分数偏小的是
A.用量筒量取水时俯视读数
B.配制溶液的烧杯用少量蒸馏水润洗
C.氯化钠晶体不纯
D. 转移已配好的溶液时,有少量溶液溅出

(1)用图中的序号表示配制溶液的正确操作顺序 。图②中的塑料仪器是 。
(2)计算配制80g 10%的氯化钠溶液时,需要称量氯化钠固体的质量为 ,需要蒸馏水的体积为 (室温下,水的密度为1g/mL),量取体积时除量筒外还需要的仪器是 ,所用量筒的规格是 mL(填“10”、“50”或“100”)。
(3)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。
A. 增加适量氯化钠固体
B. 减少适量氯化钠固体
C. 调节平衡螺母
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒目的是 。
(5)下列操作会引起溶液中氯化钠的质量分数偏小的是
A.用量筒量取水时俯视读数
B.配制溶液的烧杯用少量蒸馏水润洗
C.氯化钠晶体不纯
D. 转移已配好的溶液时,有少量溶液溅出
20.某化学兴趣小组探究碱的化学性质,设计实验如下:

(1)实验一能够观察到的明显现象是溶液由无色变为 色。
(2)实验二澄清石灰水变浑浊,反应的化学方程式为 。
(3)实验三发生反应的化学方程式为 。
(4)实验四产生白色沉淀,对反应后的物质进行过滤,并对滤液中溶质的成分产生了兴趣,经分析,滤液中一定有氢氧化钠,滤液一定显 (选填“酸性”、“中性”或“碱性”)。
【提出问题】滤液中溶质除了氢氧化钠还有什么呢?同学们对滤液中溶质的成分进行了猜想和实验探究。
(5)【猜想与假设】猜想①:溶质只有NaOH;猜想②:溶质为NaOH和 。猜想③:溶质为NaOH和Ba(OH)2。
(6)【实验探究】
b.实验现象:
(7)【反思与评价】
Ⅰ.同学们经过讨论认为,如果只向滤液中加入过量的一种试剂,也能得出猜想①正确的结论,该试剂为 ,反应现象为 。
Ⅱ.实验后的废液直接倒入下水道,会造成环境污染,需将废液处理后再排放。

(1)实验一能够观察到的明显现象是溶液由无色变为 色。
(2)实验二澄清石灰水变浑浊,反应的化学方程式为 。
(3)实验三发生反应的化学方程式为 。
(4)实验四产生白色沉淀,对反应后的物质进行过滤,并对滤液中溶质的成分产生了兴趣,经分析,滤液中一定有氢氧化钠,滤液一定显 (选填“酸性”、“中性”或“碱性”)。
【提出问题】滤液中溶质除了氢氧化钠还有什么呢?同学们对滤液中溶质的成分进行了猜想和实验探究。
(5)【猜想与假设】猜想①:溶质只有NaOH;猜想②:溶质为NaOH和 。猜想③:溶质为NaOH和Ba(OH)2。
(6)【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| a.取少量滤液于试管中,加入过量稀盐酸 | 无明显现象 | 由a、b两个实验的现象,得出猜想①正确 |
| b.另取少量滤液于试管中,加入过量碳酸钠溶液 | ________ |
b.实验现象:
(7)【反思与评价】
Ⅰ.同学们经过讨论认为,如果只向滤液中加入过量的一种试剂,也能得出猜想①正确的结论,该试剂为 ,反应现象为 。
Ⅱ.实验后的废液直接倒入下水道,会造成环境污染,需将废液处理后再排放。
21.某化学兴趣小组为验证硫酸化学性质,使用氢氧化钠、碳酸钠、金属铝和另外一种不同类别的物质A进行了相关实验。
(1)实验时观察到稀硫酸与A反应有蓝色溶液生成,则A物质是 。
(2)稀硫酸与氢氧化钠溶液反应时没有明显现象,为了证明二者发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化的情况见图二、图三,则B溶液是 溶液,图三中的M与图二中X、Y、Z中的 数值相等。由图三看出,此反应是 (填“放热”或“吸热”)反应。
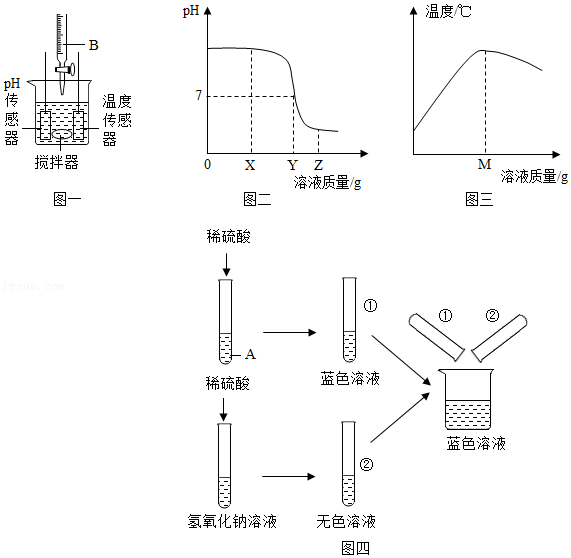
该化学兴趣小组又做了如图四所示实验。
【提出问题】②号试管中无色溶液的溶质是什么?
(3)【作出猜想】猜想一:硫酸钠;猜想二:硫酸钠、硫酸;猜想三: 。
(4)【实验验证】该小组同学用试管取适量②号试管中的无色溶液,加入一种试剂后,根据产生的现象推断出了②号试管中溶质的成分,该试剂是 。
(5)【质疑反思】甲同学认为猜想三不能成立,因为①②号试管中溶液混合后烧杯中没有蓝色沉淀生成。乙同学则认为猜想三是可以成立的,理由是 。
(1)实验时观察到稀硫酸与A反应有蓝色溶液生成,则A物质是 。
(2)稀硫酸与氢氧化钠溶液反应时没有明显现象,为了证明二者发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化的情况见图二、图三,则B溶液是 溶液,图三中的M与图二中X、Y、Z中的 数值相等。由图三看出,此反应是 (填“放热”或“吸热”)反应。

该化学兴趣小组又做了如图四所示实验。
【提出问题】②号试管中无色溶液的溶质是什么?
(3)【作出猜想】猜想一:硫酸钠;猜想二:硫酸钠、硫酸;猜想三: 。
(4)【实验验证】该小组同学用试管取适量②号试管中的无色溶液,加入一种试剂后,根据产生的现象推断出了②号试管中溶质的成分,该试剂是 。
(5)【质疑反思】甲同学认为猜想三不能成立,因为①②号试管中溶液混合后烧杯中没有蓝色沉淀生成。乙同学则认为猜想三是可以成立的,理由是 。
22.(1)某兴趣小组探究了镁与稀盐酸的反应。将打磨后的镁条放入稀盐酸中,一段时间后发现有“灰白色沉淀”产生的异常现象。镁与稀盐酸反应的化学方程式为 。
【提出问题】灰白色沉淀可能含有什么物质?
【查阅资料】①Mg(OH)2受热分解生成MgO和H2O;
②变色硅胶遇水由蓝色变为粉红色;
③碱式氯化镁【Mg(OH)Cl】不溶于水,受热易分解生成MgO和HCl气体。
(2)【提出假设】甲同学认为洗涤干燥后的灰白色沉淀中不含MgCl2,你认为原因是 。
乙同学认为灰白色沉淀中可能含有:①Mg;②Mg(OH)Cl;③Mg(OH)2。
(3)【实验探究】乙同学将灰白色沉淀洗涤、干燥后,分别置于编号为①、②、③的试管中。
实验1:向试管①中加入适量 (填物质名称)
实验2:生成
实验3:生成
(4)【讨论分析】灰白色沉淀的组成为 ,实验2中发生反应的化学方程式是 。
【提出问题】灰白色沉淀可能含有什么物质?
【查阅资料】①Mg(OH)2受热分解生成MgO和H2O;
②变色硅胶遇水由蓝色变为粉红色;
③碱式氯化镁【Mg(OH)Cl】不溶于水,受热易分解生成MgO和HCl气体。
(2)【提出假设】甲同学认为洗涤干燥后的灰白色沉淀中不含MgCl2,你认为原因是 。
乙同学认为灰白色沉淀中可能含有:①Mg;②Mg(OH)Cl;③Mg(OH)2。
(3)【实验探究】乙同学将灰白色沉淀洗涤、干燥后,分别置于编号为①、②、③的试管中。
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| 实验1 | 向试管①中加入适量________(填物质名称) | 沉淀消失,无气泡产生 | 不含有Mg |
| 实验2 | 加热试管②,并将蘸有紫色石蕊溶液的滤纸条置于试管口 | 滤纸条变红 | 生成________ |
| 实验3 | 加热试管③,将产生的气体通过变色硅胶 | 硅胶由蓝色变为粉红色 | 生成________ |
实验1:向试管①中加入适量 (填物质名称)
实验2:生成
实验3:生成
(4)【讨论分析】灰白色沉淀的组成为 ,实验2中发生反应的化学方程式是 。
23.请根据所示的实验过程和提供的信息作答:

(1)K2CO3中钾、碳、氧元素的质量比为 (写最简比)。
(2)实验结束后溶液中的溶质为 。
(3)实验所用K2CO3溶液的溶质质量分数为 (精确至0.1%)。
(4)计算原混合液中CaCl2的质量分数。(写出计算过程,精确至0.1%)

(1)K2CO3中钾、碳、氧元素的质量比为 (写最简比)。
(2)实验结束后溶液中的溶质为 。
(3)实验所用K2CO3溶液的溶质质量分数为 (精确至0.1%)。
(4)计算原混合液中CaCl2的质量分数。(写出计算过程,精确至0.1%)
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解