下载高清试卷
【2022年北京市东城区中考化学一模试卷】-第1页
试卷格式:2022年北京市东城区中考化学一模试卷.PDF
试卷热词:最新试卷、2022年、北京试卷、东城区试卷、化学试卷、九年级试卷、中考模拟试卷、初中试卷

扫码查看解析
试卷题目
1.地壳中含量最多的元素是( )
- A. 铝
- B. 硅
- C. 氧
- D. 铁
2.下列气体能供给动植物呼吸的是( )
- A. CO2
- B. H2
- C. O2
- D. N2
3.下列属于纯净物的是( )
- A. 空气
- B. 海水
- C. 自来水
- D. 冰水
4.能表示两个氮原子的符号是( )
- A. 2N
- B. N2
- C. 2N2
- D. 2NO
5.下列属于化石燃料的是( )
- A. 氢气
- B. 石油
- C. 乙醇
- D. 一氧化碳
6.鉴别硬水和软水的试剂是( )
- A. 肥皂水
- B. 食盐水
- C. 矿泉水
- D. 蒸馏水
7.如图所示的图标表示( )


- A. 禁止吸烟
- B. 禁止燃放鞭炮
- C. 禁止带火种
- D. 禁止堆放易燃物
8.下列属于溶液的是( )
- A. 米粥
- B. 牛奶
- C. 糖水
- D. 豆浆
9.下列物质中,不含金属元素的是( )
- A. MgO
- B. CaCO3
- C. FeCl2
- D. H2SO4
10.能闻到丁香花散发的香味,主要原因是( )
- A. 分子之间有间隔
- B. 分子在不断运动
- C. 分子的质量很小
- D. 分子的体积很小
11.硫酸钠的化学式是( )
- A. Na2SO4
- B. Na2S2O3
- C. Na2SO3
- D. Na2S
12.下列操作不正确的是( )
- A.
 滴加液体
滴加液体 - B.
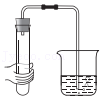 检查气密性
检查气密性 - C.
 稀释浓硫酸
稀释浓硫酸 - D.
 读取液体体积
读取液体体积
13.下列不属于铁在氧气中燃烧现象的是( )
- A. 生成白色固体
- B. 火星四射
- C. 剧烈燃烧
- D. 放热
14.下列物质属于有机化合物的是( )
- A. CO2
- B. CH4
- C. CaCO3
- D. HCl
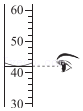
15.锰是人体必需的微量元素之一。锰元素在元素周期表中的信息如图所示。下列有关锰元素的说法不正确的是( )


- A. 原子序数是25
- B. 元素符号是Mn
- C. 原子核外电子数是55
- D. 相对原子质量为54.94
16.下列物质能用作钾肥的是( )
- A. CO(NH2)2
- B. K2CO3
- C. NH4Cl
- D. Ca3(PO4)2
17.电解水的实验如图。下列说法不正确的是( )


- A. 试管2中得到H2
- B. 实验说明水分子是可分的
- C. 实验能证明水的元素组成
- D. 产生的O2与H2的质量比为1:2
18.下列不属于二氧化碳性质的是( )
- A. 能溶于水
- B. 能燃烧
- C. 密度比空气的大
- D. 能与水反应
19.下列做法不符合“低碳环保”理念的是( )
- A. 乘坐公交出行
- B. 提倡无纸化办公
- C. 垃圾分类回收
- D. 使用一次性筷子
20.下列物质的用途中,利用其化学性质的是( )
- A. 硫酸用于除铁锈
- B. 铜用于制作导线
- C. 铁用于制作炒锅
- D. 干冰用于人工降雨
21.KCl的溶解度曲线如图所示。回答问题。
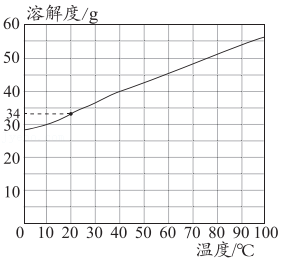
能将KCl饱和溶液变为不饱和溶液的方法是( )

能将KCl饱和溶液变为不饱和溶液的方法是( )
- A. 降低温度
- B. 加KCl固体
- C. 加水
- D. 蒸发溶剂
22.KCl的溶解度曲线如图所示。回答问题。

下列说法正确的是( )

下列说法正确的是( )
- A. KCl溶液是纯净物
- B. 20℃时,100g饱和KCl溶液中含有34gKCl
- C. 20℃时,向100g水中加入40gKCl固体,可得140gKCl溶液
- D. 20℃时,KCl的饱和溶液中溶质的质量分数小于34%
23.高效消毒杀菌剂二氧化氯(ClO2)可用NaClO2与Cl2反应制得,反应的化学方程式为2NaClO2+Cl2═2ClO2+2X,其中X是( )
- A. Na2O
- B. NaCl
- C. Na2O2
- D. NaClO
24.甲烷可制备水煤气,该反应前后分子种类变化的微观示意图如下。下列说法不正确的是( )
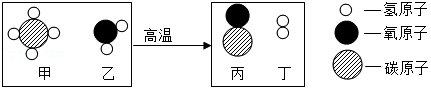

- A. 反应物乙是水
- B. 丙属于氧化物
- C. 参加反应的乙与生成的丙的分子个数比为1:1
- D. 参加反应的甲与生成的丁的质量比为4:1
25.用如图装置(夹持装置已略去)进行实验,依据②中的现象,不能判断①中发生了反应的是( )

| 选项 | ①中实验 | ②中实验及现象 |
| A | H2O2溶液与MnO2 | 将带火星的木条伸入试管内,木条复燃 |
| B | Na2CO3溶液与稀硫酸 | 澄清石灰水变浑浊 |
| C | CO2与NaOH溶液 | 试管中的水进入导管 |
| D | 大理石与稀盐酸 | 将燃着的木条伸入试管内,木条熄灭 |

- A. A
- B. B
- C. C
- D. D
26.磷酸亚铁锂(LiFePO4)电池是电动车常用的电池之一。
(1)磷酸亚铁锂由 种元素组成。
(2)磷酸亚铁锂中铁元素与氧元素的质量比为 (填计算式)。
(1)磷酸亚铁锂由 种元素组成。
(2)磷酸亚铁锂中铁元素与氧元素的质量比为 (填计算式)。
27.空气炸锅可以烹饪:①鸡翅、②虾、③红薯、④青椒等食物。
(1)上述富含蛋白质的食物有 (填序号)。
(2)虾中含钙丰富,人体缺钙可能会导致 (填序号)。
A. 贫血
B. 甲状腺肿大
C. 骨质疏松
(1)上述富含蛋白质的食物有 (填序号)。
(2)虾中含钙丰富,人体缺钙可能会导致 (填序号)。
A. 贫血
B. 甲状腺肿大
C. 骨质疏松
28.分子筛制氧机以空气为原料,将空气中的O2与N2进行分离,获得高浓度的O2。
(1)空气经过分子筛时氮气被吸附,氧气通过,其微观示意图如下,请在方框中画出微粒图示。
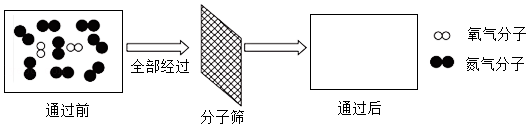
(2)分离过程中的变化属于 (填“物理”或“化学”)变化。
(1)空气经过分子筛时氮气被吸附,氧气通过,其微观示意图如下,请在方框中画出微粒图示。

(2)分离过程中的变化属于 (填“物理”或“化学”)变化。
29.《天工开物》中收录了井盐生产过程和金属冶炼技术。
(1)井盐中含有丰富的钠、氯等。这里的“钠”是指 (填序号)。
A.分子
B.单质
C.元素
(2)高温条件下,用CO还原赤铁矿(主要成分是Fe2O3)冶炼铁,该反应的化学方程式为 。
(1)井盐中含有丰富的钠、氯等。这里的“钠”是指 (填序号)。
A.分子
B.单质
C.元素
(2)高温条件下,用CO还原赤铁矿(主要成分是Fe2O3)冶炼铁,该反应的化学方程式为 。
30.阅读下面科普短文。
土壤酸化是农业面临的问题之一。我国南方部分稻田土壤已出现不同程度的酸化,表现为部分稻田土壤的pH低于5.5。土壤酸化面积与强度仍在加剧。水稻和油菜是耐酸性较强的作物,但在土壤酸化程度逐渐加剧的情况下,水稻和油菜的生产明显受到影响。向土壤中加入熟石灰调节pH可有效改良酸性土壤。
科研人员通过实验研究土壤的pH对水稻、油菜产量的影响。原有土壤的pH为4.5,加入一定量的熟石灰,将土壤的pH分别调至5.0、5.5、6.0、6.5和7.0,需要加入熟石灰的用量如表所示。
在同一土壤交替种植水稻和油菜,水稻、油菜产量随土壤pH的变化如图所示。
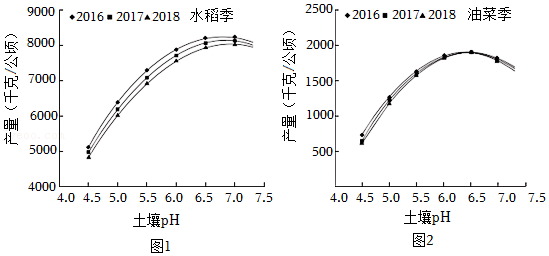
实验结果表明:用熟石灰对酸性土壤进行改良可以提高水稻和油菜的产量。
依据文章内容回答下列问题。
(1)我国南方部分稻田土壤出现酸化的表现是 。
(2)熟石灰的化学式为 。
(3)将pH=4.5的酸性土壤改良为pH=6.5,每公顷需要加入熟石灰的质量为 kg。
(4)依据图1,判断下列说法是否正确(填“对”或“错”)。
A.稻田土壤酸性越强,水稻产量越高。
B.2016、2017、2018三年,土壤的pH对水稻产量影响的变化趋势基本相同。
(5)由图2可得出,油菜的产量与土壤pH的关系为 。
土壤酸化是农业面临的问题之一。我国南方部分稻田土壤已出现不同程度的酸化,表现为部分稻田土壤的pH低于5.5。土壤酸化面积与强度仍在加剧。水稻和油菜是耐酸性较强的作物,但在土壤酸化程度逐渐加剧的情况下,水稻和油菜的生产明显受到影响。向土壤中加入熟石灰调节pH可有效改良酸性土壤。
科研人员通过实验研究土壤的pH对水稻、油菜产量的影响。原有土壤的pH为4.5,加入一定量的熟石灰,将土壤的pH分别调至5.0、5.5、6.0、6.5和7.0,需要加入熟石灰的用量如表所示。
| 土壤pH | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
| 熟石灰用量(千克/公顷) | 0 | 1492 | 3154 | 4815 | 6477 | 8139 |
在同一土壤交替种植水稻和油菜,水稻、油菜产量随土壤pH的变化如图所示。

实验结果表明:用熟石灰对酸性土壤进行改良可以提高水稻和油菜的产量。
依据文章内容回答下列问题。
(1)我国南方部分稻田土壤出现酸化的表现是 。
(2)熟石灰的化学式为 。
(3)将pH=4.5的酸性土壤改良为pH=6.5,每公顷需要加入熟石灰的质量为 kg。
(4)依据图1,判断下列说法是否正确(填“对”或“错”)。
A.稻田土壤酸性越强,水稻产量越高。
B.2016、2017、2018三年,土壤的pH对水稻产量影响的变化趋势基本相同。
(5)由图2可得出,油菜的产量与土壤pH的关系为 。
31.电石(CaC2)是重要的化工原料。传统氧热法煤制电石生产设备如图。
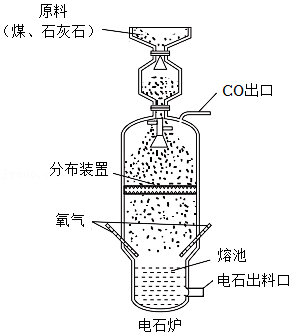
(1)为使煤、石灰石反应更充分,需将块状原料进行预处理,处理方法是 。
(2)煤受热分解得到焦炭(主要成分是碳),石灰石在高温条件下分解产生CaO。电石生产过程中的主要反应有:
①CaO+3C
CaC2+CO
②CaO+C
Ca+CO
③Ca+2C
CaC2
④2CaO+CaC2
3Ca+2CO
反应①中碳元素的化合价有 种。
反应①~④中属于置换反应的是 (填序号)。

(1)为使煤、石灰石反应更充分,需将块状原料进行预处理,处理方法是 。
(2)煤受热分解得到焦炭(主要成分是碳),石灰石在高温条件下分解产生CaO。电石生产过程中的主要反应有:
①CaO+3C
| 高温 |
②CaO+C
| 高温 |
③Ca+2C
| 高温 |
④2CaO+CaC2
| 高温 |
反应①中碳元素的化合价有 种。
反应①~④中属于置换反应的是 (填序号)。
32.硫酸铝[Al2(SO4)3广泛用于造纸、处理工业用水等。铝土矿(主要成分为Al2O3和SiO2)生产硫酸铝的流程如图所示。
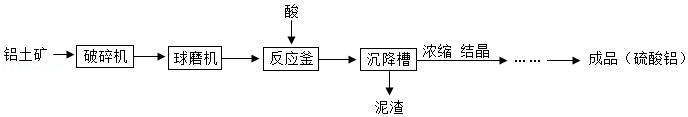
(1)反应釜中加入的酸是 。
(2)利用酸与Al2O3反应将Al2O3从矿石中溶出来,酸的浓度与铝溶出率的关系如图,为使矿石充分利用,酸的浓度最好选择 (填序号)。
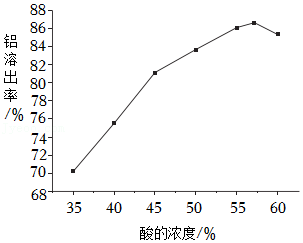
A.40%~45%
B.55%~60%
C.60%以上
(3)泥渣中含有Al2(SO4)3和SiO2,加水溶解、过滤,可回收Al2(SO4)3溶液,实现Al2(SO4)3与SiO2的分离,利用的性质是 。

(1)反应釜中加入的酸是 。
(2)利用酸与Al2O3反应将Al2O3从矿石中溶出来,酸的浓度与铝溶出率的关系如图,为使矿石充分利用,酸的浓度最好选择 (填序号)。

A.40%~45%
B.55%~60%
C.60%以上
(3)泥渣中含有Al2(SO4)3和SiO2,加水溶解、过滤,可回收Al2(SO4)3溶液,实现Al2(SO4)3与SiO2的分离,利用的性质是 。
33.依据如图回答问题。
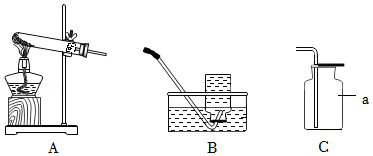
(1)仪器a的名称是 。
(2)用A装置制取O2的化学方程式为 。
(3)从①或②两小题中任选一个作答,若两题均作答,按①计分。
①
②

(1)仪器a的名称是 。
(2)用A装置制取O2的化学方程式为 。
(3)从①或②两小题中任选一个作答,若两题均作答,按①计分。
| 序号 | ① | ② |
| 收集O2选择装置 | B | C |
| 依据O2的性质 | ________ | ________ |
①
②
34.配制50g质量分数为10%的NaCl溶液。
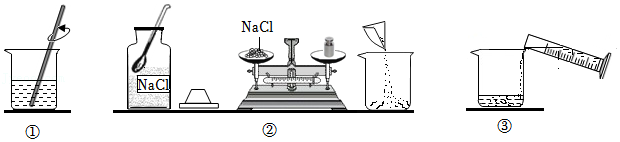
(1)该实验正确的操作顺序是 (填序号)。
(2)本实验需要称量氯化钠 g。

(1)该实验正确的操作顺序是 (填序号)。
(2)本实验需要称量氯化钠 g。
35.小组同学用化学试剂制作奥运五环。已知甲基橙是一种酸碱指示剂,其变色范围是:pH≤3.1时呈红色,pH在3.1~4.4之间呈橙色,pH≥4.4时呈黄色。
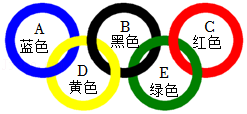
(1)A环:NaOH溶液中加入 溶液。
(2)B环:CuSO4溶液中加入Na2S溶液,生成难溶于水的黑色物质CuS,写出该复分解反应的化学方程式: 。
(3)依据如图,向D环中加入 (选一种即可)后滴加甲基橙溶液,呈现黄色。
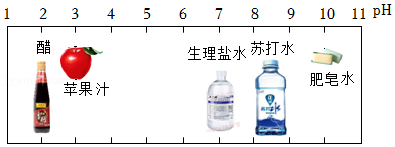

(1)A环:NaOH溶液中加入 溶液。
(2)B环:CuSO4溶液中加入Na2S溶液,生成难溶于水的黑色物质CuS,写出该复分解反应的化学方程式: 。
(3)依据如图,向D环中加入 (选一种即可)后滴加甲基橙溶液,呈现黄色。

36.用如图装置研究碱的性质(已知Na2CO3溶液呈碱性)。
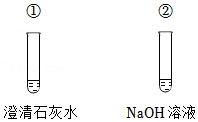
(1)向①中加入适量Na2CO3溶液,溶液变浑浊,反应的化学方程式为 。
(2)向②中通入CO2气体,无明显现象。证明CO2与NaOH反应的实验方案为 。

(1)向①中加入适量Na2CO3溶液,溶液变浑浊,反应的化学方程式为 。
(2)向②中通入CO2气体,无明显现象。证明CO2与NaOH反应的实验方案为 。
37.用下列装置验证可燃物的燃烧条件。将适量水滴入烧杯中,一段时间后,试管内的白磷开始燃烧,待火焰熄灭,试管内仍有白磷剩余。
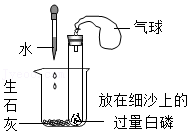
(1)白磷燃烧的化学方程式为 。
(2)生石灰与水的反应属于 (填“放热”或“吸热”)反应,该反应的化学方程式为 。
(3)能验证白磷燃烧需要温度达到着火点的现象是 。
(4)试管内仍有白磷剩余的原因是 。

(1)白磷燃烧的化学方程式为 。
(2)生石灰与水的反应属于 (填“放热”或“吸热”)反应,该反应的化学方程式为 。
(3)能验证白磷燃烧需要温度达到着火点的现象是 。
(4)试管内仍有白磷剩余的原因是 。
38.实验小组探究金属与酸的置换反应。
【进行实验】
实验1:向分别盛有Fe片、Cu片的试管中加入稀盐酸。
(1)Fe与稀盐酸发生反应,化学方程式为 。
(2)Cu与稀盐酸不反应,原因是 。
实验2:探究Fe与硫酸的反应(Fe片大小相同且已除去表面氧化膜;硫酸溶液体积相等)
(3)对比实验①和②,可得到的结论是 。
(4)实验③中没有气泡产生的原因是 。
实验3:探究Cu与浓盐酸的反应
用如下装置进行实验(硫酸溶液与浓盐酸中H+的浓度接近)。
【解释与结论】
(5)④是对照实验,目的是排除 的干扰。
(6)点燃⑥中气球内的气体,发出爆鸣声,则⑥中气球变鼓是因为生成了 ;经检测,⑥反应后的溶液中主要成分是H3CuCl4。
【反思与评价】
(7)综合以上实验,请写出你对金属与酸的置换反应的新认识 。
【进行实验】
实验1:向分别盛有Fe片、Cu片的试管中加入稀盐酸。
(1)Fe与稀盐酸发生反应,化学方程式为 。
(2)Cu与稀盐酸不反应,原因是 。
实验2:探究Fe与硫酸的反应(Fe片大小相同且已除去表面氧化膜;硫酸溶液体积相等)
| 序号 | 药品 | 现象 |
| ① | Fe片+硫酸溶液(V浓硫酸:V水=1:2) | 快速产生气泡 |
| ② | Fe片+硫酸溶液(V浓硫酸:V水=1:200) | 缓慢产生气泡 |
| ③ | Fe片+硫酸溶液(V浓硫酸:V水=1:200000) | 无气泡产生 |
(3)对比实验①和②,可得到的结论是 。
(4)实验③中没有气泡产生的原因是 。
实验3:探究Cu与浓盐酸的反应
用如下装置进行实验(硫酸溶液与浓盐酸中H+的浓度接近)。
| 装置 | 序号 | 药品 | 现象 |
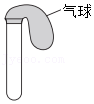 | ④ | 浓盐酸 | 24小时后仍无明显变化 |
| ⑤ | Cu粉+硫酸溶液 | 24小时后仍无明显变化 | |
| ⑥ | Cu粉+浓盐酸 | 24小时后气球变鼓 |
【解释与结论】
(5)④是对照实验,目的是排除 的干扰。
(6)点燃⑥中气球内的气体,发出爆鸣声,则⑥中气球变鼓是因为生成了 ;经检测,⑥反应后的溶液中主要成分是H3CuCl4。
【反思与评价】
(7)综合以上实验,请写出你对金属与酸的置换反应的新认识 。
39.用NaH制H2的反应为:NaH+H2O═H2↑+NaOH。若制备2gH2,计算理论上需要NaH的质量(写出计算过程及结果)。
查看全部题目
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解