下载高清试卷
【2021-2022学年江苏省南京市溧水区九年级(上)期末化学试卷】-第1页
试卷格式:2021-2022学年江苏省南京市溧水区九年级(上)期末化学试卷.PDF
试卷热词:最新试卷、2021年、江苏试卷、南京市试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷

扫码查看解析
试卷题目
1.下列金属中,金属活动性最强的是( )
- A. 金
- B. 铝
- C. 铜
- D. 铁
2.下列物质中,属于纯净物的是( )
- A. 煤
- B. 生理盐水
- C. 氢气
- D. 可燃冰
3.下列物质由分子构成的是( )
- A. 氯化钠
- B. C60
- C. 金刚石
- D. 铁
4.氮化镓(GaN)是生产5G芯片的关键材料。已知氮化镓中镓元素的化合价为+3,则氮元素的化合价为( )
- A. -3
- B. 0
- C. +3
- D. +5
5.党的十九大提出要加快生态文明体制改革,建设美丽中国。下列做法正确的是( )
- A. 为保护空气,积极植树造林
- B. 为增加粮食产量,大量使用农药、化肥
- C. 为节约金属资源,不开采矿物
- D. 为节约水资源,用工业废水直接灌溉农田
6.下列图示实验操作中,正确的是( )
- A.

加入大理石 - B.

称量固体 - C.

倾倒溶液 - D.

过滤
7.下列原子结构示意图中,表示相对稳定结构的是( )
- A.

- B.

- C.

- D.

8.根据实践经验,下列家庭小实验不能成功的是( )
- A. 将冷碟子放在蜡烛火焰上方制炭黑
- B. 用6B铅笔芯代替导线点亮小灯泡
- C. 用肥皂水可以区分硬水和软水
- D. 将缝衣针淬火处理后弯曲成钓鱼钩
9.有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z表面没有变化.根据以上事实,判断这三种金属的活动性由强到弱的顺序为( )
- A. Z、Y、X
- B. Y、X、Z
- C. X、Y、Z
- D. Y、Z、X
10.花青素(化学式为C15H11O6)具有缓解眼睛疲劳,保护视力的作用。该物质主要来源于各种蔬菜和水果,青少年应多吃蔬菜和水果。下列关于花青素的说法正确的是( )
- A. 花青素属氧化物
- B. 花青素的相对分子质量287g
- C. 每个花青素分子由32个原子构成
- D. 花青素中氧元素质量分数最大
11.根据下列实验事实得出的结论不正确的是( )
| 实验事实 | 结论 | |
| A | 在空气中点燃纯净的一氧化碳,燃烧,火焰呈蓝色 | 一氧化碳能支持燃烧 |
| B | 将铁丝和铜丝分别放入稀盐酸中,铁丝表面有气泡产生,铜丝表面无变化 | 铁的金属活动性比铜强 |
| C | 品红在静置的水中会扩散,且在热水中扩散得更快 | 分子在不停地运动,且温度越高,分子的运动速率越快 |
| D | 两块干燥的玻璃片,放在空气中的一块无明显变化,对着哈气的玻璃片上有无色液滴出现 | 呼出的气体中水蒸气的含量比吸入的空气中水蒸气的含量高 |
- A. A
- B. B
- C. C
- D. D
12.除去物质中的少量杂质(括号内为杂质),拟定实验方案可行的是( )
- A. 氮气(氧气)——通过足量灼热的炭粉
- B. CO2(CO)——点燃
- C. 氧气(水蒸气)——通过装有足量无水氯化钙的干燥管
- D. FeSO4溶液(CuSO4)——加入过量的Zn粉,过滤
13.对比实验是化学学习中常用的方法。下列通过对比实验得出的结论不正确的是( )

- A. 实验一探究呼出气体和空气中氧气含量的不同
- B. 实验二金属锌的活动性比铁的活动性强
- C. 实验三探究水对铁钉锈蚀的影响
- D. 实验四探究同种物质在不同溶剂中的溶解性
14.按如图所示装置,将试剂x(足量)注入装有固体试剂y的小试管中,发现U形管中右端液面升高,小试管内固体消失。下列对物质xy的判断正确的是( )


| 选项 | x | y |
| A | 水 | 硝酸铵 |
| B | 水 | 氧化钙 |
| C | 过氧化氢 | 二氧化锰 |
| D | 稀盐酸 | 镁粉 |
- A. A
- B. B
- C. C
- D. D
15.某无色气体可能含是CO2、CO、H2中的一种或几种,依次进行以下实验(假设每步反应均完全进行);①通过赤热的炭层后,恢复到原状态,气体体积增大;②通过灼热的CuO时,固体变成红色;③通过白色CuSO4粉末时,粉末变成蓝色晶体;④通入澄清石灰水中,石灰水变浑浊。下列判断正确的是( )
- A. 原混合气体中一定没有CO2和H2,一定含有CO
- B. 原混合气体中一定含有CO2、CO、H2
- C. 原混合气体中一定含有CO2和H2,可能含有CO
- D. 步骤②中,一定只有置换反应
16.根据下列装置图,回答有关问题。

(1)写出装置图中标号①的仪器名称: 。
(2)写出利用A装置制取氧气的化学方程式为 。若用F装置收集氧气,氧气应从 端通入(填“a”或“b”)。
(3)实验室用装置B和C制取二氧化碳,化学方程式为 。
(4)实验室用100g质量分数为19.6%的稀硫酸与足量的锌充分反应,求生成氢气的质量是多少?

(1)写出装置图中标号①的仪器名称: 。
(2)写出利用A装置制取氧气的化学方程式为 。若用F装置收集氧气,氧气应从 端通入(填“a”或“b”)。
(3)实验室用装置B和C制取二氧化碳,化学方程式为 。
(4)实验室用100g质量分数为19.6%的稀硫酸与足量的锌充分反应,求生成氢气的质量是多少?
17.随着经济的发展,能源、环境、材料成为人们日益关注的问题:
(1)化石燃料有石油、 和天然气,天然气(主要成分甲烷)燃烧的化学方程式是 。
(2)化石燃料燃烧会产生大量二氧化碳,通过“捕捉”的CO2来生产甲醇(CH3OH),可减少二氧化碳的排放。反应的微观示意图如下:
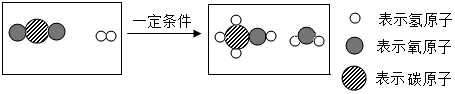
该反应的化学方程式为 。在该变化过程中,发生变化的微粒是 (填微粒名称)。
(3)防治污染,保护环境,可以实现可持续发展。
①大量使用煤作为燃料,会导致 (填字母)。
A.PM2.5增加
B.全球气候变暖
C.空气质量指数下降
D.酸雨
②设计实验证明甲烷中含有碳元素,请完成实验报告。
(1)化石燃料有石油、 和天然气,天然气(主要成分甲烷)燃烧的化学方程式是 。
(2)化石燃料燃烧会产生大量二氧化碳,通过“捕捉”的CO2来生产甲醇(CH3OH),可减少二氧化碳的排放。反应的微观示意图如下:

该反应的化学方程式为 。在该变化过程中,发生变化的微粒是 (填微粒名称)。
(3)防治污染,保护环境,可以实现可持续发展。
①大量使用煤作为燃料,会导致 (填字母)。
A.PM2.5增加
B.全球气候变暖
C.空气质量指数下降
D.酸雨
②设计实验证明甲烷中含有碳元素,请完成实验报告。
| 实验步骤 | 实验现象 | 实验结论 |
| 甲烷中含有碳元素 |
18.水和溶液在生产生活中起着重要的作用。
(1)电解水实验可以得出水是由 组成的。
(2)天然水中含有许多杂质,现向水样中加入明矾搅拌溶解,静置一段时间后,进行过滤,过滤时需要用到的玻璃仪器有 (填序号)。
①带铁圈的铁架台
②酒精灯
③漏斗
④玻璃棒
⑤量筒
⑥烧杯
⑦滤纸
(3)少量下列物质加入到水中,充分搅拌后,可以得到无色溶液的是 。
A.植物油
B.蔗糖
C.乙醇
D.高锰酸钾
(4)Ⅰ、甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图1。下列说法正确的是 。

A.t1℃时,三种物质的溶解度:乙>甲=丙
B.20℃时,将30g甲放入50g水中,充分搅拌,所得溶液的质量是80g
C.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体质量最大
D.分别将t1℃时三种物质的饱和溶液升温到t2℃,溶液中溶质的质量分数:乙>甲>丙
(5)Ⅱ、硝酸钾在不同温度时的溶解度见表:
如图2A、B、C、D四个烧杯中分别盛有100g水,分别向其中加入110g、86g、64g、32g硝酸钾,充分溶解后得到40℃时的溶液。
① 中的溶液是饱和溶液(选填字母)。
②表中的一组数据“20、32”的含义是 。
③将一瓶接近饱和的硝酸钾溶液变成饱和溶液的方法是 (任写一种)。
④向B烧杯中加适量的水得到饱和溶液(保持40℃)的最大质量为 g。
⑤A烧杯中溶液的溶质质量分数为 。
(1)电解水实验可以得出水是由 组成的。
(2)天然水中含有许多杂质,现向水样中加入明矾搅拌溶解,静置一段时间后,进行过滤,过滤时需要用到的玻璃仪器有 (填序号)。
①带铁圈的铁架台
②酒精灯
③漏斗
④玻璃棒
⑤量筒
⑥烧杯
⑦滤纸
(3)少量下列物质加入到水中,充分搅拌后,可以得到无色溶液的是 。
A.植物油
B.蔗糖
C.乙醇
D.高锰酸钾
(4)Ⅰ、甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图1。下列说法正确的是 。

A.t1℃时,三种物质的溶解度:乙>甲=丙
B.20℃时,将30g甲放入50g水中,充分搅拌,所得溶液的质量是80g
C.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体质量最大
D.分别将t1℃时三种物质的饱和溶液升温到t2℃,溶液中溶质的质量分数:乙>甲>丙
(5)Ⅱ、硝酸钾在不同温度时的溶解度见表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 溶解度/g | 21 | 32 | 46 | 64 | 86 | 110 | 138 |
如图2A、B、C、D四个烧杯中分别盛有100g水,分别向其中加入110g、86g、64g、32g硝酸钾,充分溶解后得到40℃时的溶液。
① 中的溶液是饱和溶液(选填字母)。
②表中的一组数据“20、32”的含义是 。
③将一瓶接近饱和的硝酸钾溶液变成饱和溶液的方法是 (任写一种)。
④向B烧杯中加适量的水得到饱和溶液(保持40℃)的最大质量为 g。
⑤A烧杯中溶液的溶质质量分数为 。
19.金属材料是日常生活中应用广泛的材料,请回答下列与金属有关的问题。
(1)生铁和钢都是铁的合金,其中 含碳量较高。
(2)我国首架大型客机C919中使用了大量的铝镁合金,铝制品在空气中不易被腐蚀,具有“自我保护”能力,其原因是 (用化学方程式表示)。
(3)用以下试剂对铝、铁、铜三种金属材料的金属活动性顺序进行探究,能达到目的的是 (填序号)。
A.Cu、FeCl2溶液、AlCl3溶液
B.Fe、AlCl3溶液、CuSO4溶液
C.Cu、Fe、AlCl3溶液
D.Al、Fe、Cu、稀盐酸
(4)将一定质量的锌粒投入含有Cu(NO3)2和Fe(NO3)2的混合溶液中,充分反应后过滤,发现溶液仍有颜色,则溶液中一定含的溶质是 (写出化学式)。
(1)生铁和钢都是铁的合金,其中 含碳量较高。
(2)我国首架大型客机C919中使用了大量的铝镁合金,铝制品在空气中不易被腐蚀,具有“自我保护”能力,其原因是 (用化学方程式表示)。
(3)用以下试剂对铝、铁、铜三种金属材料的金属活动性顺序进行探究,能达到目的的是 (填序号)。
A.Cu、FeCl2溶液、AlCl3溶液
B.Fe、AlCl3溶液、CuSO4溶液
C.Cu、Fe、AlCl3溶液
D.Al、Fe、Cu、稀盐酸
(4)将一定质量的锌粒投入含有Cu(NO3)2和Fe(NO3)2的混合溶液中,充分反应后过滤,发现溶液仍有颜色,则溶液中一定含的溶质是 (写出化学式)。
20.下图中的A~I表示几种初中化学常见的物质(或是其水溶液);B、C、D、E是单质,B物质的状态与其它物质均不同;C是红色固体;G、H、I中含有同种金属元素,I是氧化物。图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系。部分反应物、生成物和溶剂水已略去。
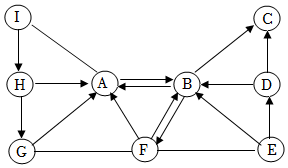
(1)写出C的化学式 。
(2)写出下列反应的化学方程式:
E→D ;H→G 。
(3)I和A的反应是 反应(填“吸热”或“放热”)。

(1)写出C的化学式 。
(2)写出下列反应的化学方程式:
E→D ;H→G 。
(3)I和A的反应是 反应(填“吸热”或“放热”)。
21.学习完金属相关知识后,对金属冶炼进行了以下梳理。
【实验1】装置如图甲。

(1)木炭还原氧化铜的化学方程式为 ,该反应的基本反应类型是 。
(2)下列有关本实验的说法正确的是 (填字母)。
A.酒精灯加网罩以使火焰集中并提高温度
B.氧化铜发生了还原反应,木炭发生了氧化反应
C.实验中观察到试管内粉末变红时可证明氧化铜被还原了
D.反应后先撤出导气管,再熄灭酒精灯
(3)我国古代人民运用湿法炼铜,将铁放入硫酸铜溶液中。该反应的化学方程式为 。
【实验2】装置如图乙。
(4)实验过程中玻璃管内的现象是 。
【问题反思】装置乙中玻璃管内的产物一定就是单质铁吗?
【查阅资料】
①氢氧化钠溶液可以充分吸收二氧化碳气体
②还原氧化铁的实验过程中固体产物可能有Fe3O4、FeO、Fe。
③还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
【进行实验】
①反应前乙装置中玻璃管和内盛氧化铁的总质量为68.0g(玻璃管的质量为60.0g)。
②充分反应后玻璃管和内盛黑色固体的总质量为65.8g(冷却到室温称量)。
③将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引。
(5)【进行猜想】黑色固体粉末可能是:a、全部为铁,b、 ,c、 。
(6)【得出结论】该黑色固体粉末的成分 。
(7)【拓展延伸】
实验装置图中采用虚线框内的装置,其作用有 。
A.收集一氧化碳
B.吸收二氧化碳
C.检验二氧化碳。
【实验1】装置如图甲。

(1)木炭还原氧化铜的化学方程式为 ,该反应的基本反应类型是 。
(2)下列有关本实验的说法正确的是 (填字母)。
A.酒精灯加网罩以使火焰集中并提高温度
B.氧化铜发生了还原反应,木炭发生了氧化反应
C.实验中观察到试管内粉末变红时可证明氧化铜被还原了
D.反应后先撤出导气管,再熄灭酒精灯
(3)我国古代人民运用湿法炼铜,将铁放入硫酸铜溶液中。该反应的化学方程式为 。
【实验2】装置如图乙。
(4)实验过程中玻璃管内的现象是 。
【问题反思】装置乙中玻璃管内的产物一定就是单质铁吗?
【查阅资料】
①氢氧化钠溶液可以充分吸收二氧化碳气体
②还原氧化铁的实验过程中固体产物可能有Fe3O4、FeO、Fe。
③还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
| 铁及铁的氧化物 | Fe | FeO | Fe2O3 | Fe3O4 |
| 颜色 | 黑色 | 黑色 | 红棕色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【进行实验】
①反应前乙装置中玻璃管和内盛氧化铁的总质量为68.0g(玻璃管的质量为60.0g)。
②充分反应后玻璃管和内盛黑色固体的总质量为65.8g(冷却到室温称量)。
③将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引。
(5)【进行猜想】黑色固体粉末可能是:a、全部为铁,b、 ,c、 。
(6)【得出结论】该黑色固体粉末的成分 。
(7)【拓展延伸】
实验装置图中采用虚线框内的装置,其作用有 。
A.收集一氧化碳
B.吸收二氧化碳
C.检验二氧化碳。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解