下载高清试卷
【2019年四川省泸州市中考化学试卷】-第1页
试卷格式:2019年四川省泸州市中考化学试卷.PDF
试卷热词:最新试卷、2019年、四川试卷、泸州市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.下列物质不溶于水的是( )
- A. 酒精
- B. 硝酸
- C. 蔗糖
- D. 铁锈
2.下列物质不能与盐酸反应的是( )
- A. Mg

- B. AgNO3
- C. Cu(OH)2
- D. FeSO4
3.下列说法错误的是( )
- A. H2O2属于氧化物
- B. 碳元素与氧元素位于同一周期
- C. NaNO2中氮元素的化合价为+5价
- D. 1个钠原子失去1个电子变成钠离子
4.下列叙述错误的是( )
- A. 氢氧燃料电池是将电能转换成热能的装置
- B. 人体必需元素长期摄入不足不利于健康
- C. 食品在霉变过程中发生了化学变化
- D. 油脂可在小肠中转化为脂肪酸和甘油
5.某品牌牛奶的营养成分如表所示,对1盒250mL的牛奶,叙述正确的是( )
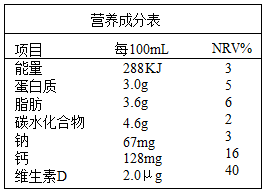

- A. 碳水化合物提供的能量为288kJ
- B. 维生素D有助于骨骼和牙齿的生长发育
- C. 含Ca单质的质量为128mg
- D. 蛋白质在人体内仅转化为N2排出体外
6.下列装置有误或不能完成对应实验的是( )
- A. 用于过滤粗盐水中的泥沙杂质

- B. 用于食盐水的蒸发结晶
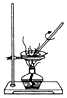
- C. 用于实验室即关即停制取H2
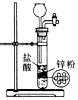

- D. 用于除去H2中的HCl杂质
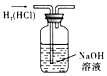
7.下列反应的化学方程式及其应用都正确的是( )
- A. Fe3O4+4CO3Fe+4CO2 , 工业上用于冶炼铁
高温 - B. BaCl2+H2O+CO2═BaCO3↓+2HCl,用于制取透视检查胃肠的钡餐
- C. Al3O2=3Al+O2↑,工业上用于冶炼铝
- D. NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl↓,用于制取复合肥料
8.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
| Na2CO3的溶解度(g/100g水) | 7. 1 | 12. 5 | 21. 5 | 39. 7 | 49. 0 | 48. 5 | 46. 0 |
| NaHCO3的溶解度(g/100g水) | 6. 9 | 8. 1 | 9. 6 | 11. 1 | 12. 7 | 14. 5 | 16. 4 |
- A. 40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
- B. 60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
- C. 30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
- D. 20℃的饱和Na2CO3溶液中通足量CO2 , 生成的NaHCO3会部分析出
9.如图为世界最长的跨海大桥--港珠澳大桥,于2018年10月24日正式通车,凸显了我国领先的造桥技术。回答下列问题:

(1)建造大桥使用了大量钢材、水泥、玻璃、橡胶等材料,其中属于有机物的是 ,能导电的是 。
(2)造桥用的钢管浸泡在海水中易发生腐蚀,造成钢管腐蚀的物质包括水、二氧化碳、 。

(1)建造大桥使用了大量钢材、水泥、玻璃、橡胶等材料,其中属于有机物的是 ,能导电的是 。
(2)造桥用的钢管浸泡在海水中易发生腐蚀,造成钢管腐蚀的物质包括水、二氧化碳、 。
10.我国科学家屠呦呦因成功提取了青蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素的使用在全世界"拯救了几百万人的生命"。青蒿用乙醚浸泡可提取其有效成分青蒿素,再利用乙醚沸点低易分离的特点,回收循环利用乙醚。回答下列问题:
(1)提取青蒿素的过程是 变化(填"物理"或"化学")。
(2)青蒿素的分子式为C15H22O5 , 则1个青蒿素分子中含有 个原子,其中碳元素与氧元素的质量比为 。

(1)提取青蒿素的过程是 变化(填"物理"或"化学")。
(2)青蒿素的分子式为C15H22O5 , 则1个青蒿素分子中含有 个原子,其中碳元素与氧元素的质量比为 。
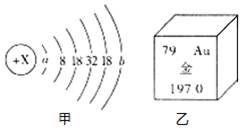
11.1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验。他们用一束质量远大于电子的高速运动的α粒子轰击金箔,发现:"大多数α粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。"回答下列问题:
甲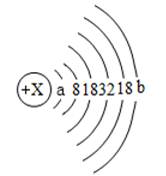 乙
乙 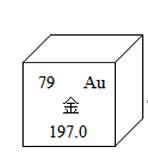
(1)1个α粒子由2个中子和2个质子构成,则α粒子带 电(填"正"或"负"),1个α粒子与1个He-4原子构成上的差别是 。
(2)甲图为金的原子结构示意图,乙图摘自元素周期表,据此推断a= ,b= 。
(3)根据实验现象中α粒子"大多数"与"极少数"的对比分析,你能想象出关于Au原子结构的结论是 。
甲
 乙
乙 
(1)1个α粒子由2个中子和2个质子构成,则α粒子带 电(填"正"或"负"),1个α粒子与1个He-4原子构成上的差别是 。
(2)甲图为金的原子结构示意图,乙图摘自元素周期表,据此推断a= ,b= 。
(3)根据实验现象中α粒子"大多数"与"极少数"的对比分析,你能想象出关于Au原子结构的结论是 。
12.水污染与防治是当今人类需要关注的环境问题之一,工农业废水和生活污水是水污染的主要来源。回答下列问题:
(1)酸雨 (填"能"或"不能")污染水体,煤燃烧产生SO2 , SO2形成酸雨的主要原因是 。
(2)废旧电池中含有的汞、镉等重金属会污染水体,造成生物体中毒,其原因是重金属能使生物体内的 (填化学物质)结构破坏,失去生理活性。
(3)某工业废水含HgSO4 , 可通过铁网而将汞留下,加热将汞形成蒸气回收利用。其反应的化学方程式为 ,汞的沸点 (填"低于"或"高于")铁的沸点。也可以向废水中加入Na2S溶液形成沉淀而除去汞,该沉淀的化学式为 。
(4)甲厂污水含硫酸的质量分数为0. 98%,其流速为45kg/s,乙厂污水含烧碱的质量分数为0. 4%,为排放达标,现将两厂的污水混合处理,反应的化学方程式为 ,则乙厂污水的最佳流速为 kg/s。
(1)酸雨 (填"能"或"不能")污染水体,煤燃烧产生SO2 , SO2形成酸雨的主要原因是 。
(2)废旧电池中含有的汞、镉等重金属会污染水体,造成生物体中毒,其原因是重金属能使生物体内的 (填化学物质)结构破坏,失去生理活性。
(3)某工业废水含HgSO4 , 可通过铁网而将汞留下,加热将汞形成蒸气回收利用。其反应的化学方程式为 ,汞的沸点 (填"低于"或"高于")铁的沸点。也可以向废水中加入Na2S溶液形成沉淀而除去汞,该沉淀的化学式为 。
(4)甲厂污水含硫酸的质量分数为0. 98%,其流速为45kg/s,乙厂污水含烧碱的质量分数为0. 4%,为排放达标,现将两厂的污水混合处理,反应的化学方程式为 ,则乙厂污水的最佳流速为 kg/s。
13.已知:Na2O为白色,Na2O2为淡黄色;Na2O+H2O=2NaOH.某兴趣小组对钠和铜的单质及其化合物的性质进行了如下实验探究。
①将铜片置于铁架台的铁圈上,用酒精灯加热,观察到铜片表面变黑;
②趁热将钠置于铜片表面,钠剧烈燃烧,有淡黄色物质生成,将此淡黄色物质转移到试管中待用,再用蒸馏水冲洗铜片,观察到铜片上钠燃烧处出现了光亮的铜斑;
③向盛装淡黄色物质的试管中滴加蒸馏水,观察到冒气泡,将带火星的木条伸入试管,木条复燃。
回答下列问题:
(1)步骤①产生的黑色物质是 ,步骤②淡黄色产物中氧元素的化合价为 价。
(2)步骤②中产生铜斑反应的另一产物,进一步与氧气反应也转化为淡黄色物质,则产生铜斑反应的化学方程式为 。
(3)步骤③产生的气体物质为 。
(4)猜想步骤③还可能有一种常见物质 (填化学式)生成,向反应后的溶液中滴加 溶液(可供选择的试剂:H2SO4、CuSO4、KOH、Na2CO3),观察到 的现象时,即证明了你的猜想。
①将铜片置于铁架台的铁圈上,用酒精灯加热,观察到铜片表面变黑;
②趁热将钠置于铜片表面,钠剧烈燃烧,有淡黄色物质生成,将此淡黄色物质转移到试管中待用,再用蒸馏水冲洗铜片,观察到铜片上钠燃烧处出现了光亮的铜斑;
③向盛装淡黄色物质的试管中滴加蒸馏水,观察到冒气泡,将带火星的木条伸入试管,木条复燃。
回答下列问题:
(1)步骤①产生的黑色物质是 ,步骤②淡黄色产物中氧元素的化合价为 价。
(2)步骤②中产生铜斑反应的另一产物,进一步与氧气反应也转化为淡黄色物质,则产生铜斑反应的化学方程式为 。
(3)步骤③产生的气体物质为 。
(4)猜想步骤③还可能有一种常见物质 (填化学式)生成,向反应后的溶液中滴加 溶液(可供选择的试剂:H2SO4、CuSO4、KOH、Na2CO3),观察到 的现象时,即证明了你的猜想。
14.已知:相同条件下,氨气的密度比空气小,极易溶于水,其水溶液称为氨水,溶质NH3•H2O能解离出NH
和OH- 。某同学对其制备与性质进行了如下探究。回答下列问题:
(1)氨气制取:固体NH4Cl与足量消石灰混合加热可以制取氨气。
①选择的发生装置是 ,收集装置是 (选填大写字母)。
②结合选择的装置完成氨气的制取、收集并吸收氨气制取氨水,按气流顺序各装置的接口从左到右依次为 (用小写字母表示)。

③充分反应后冷却,将残余固体转移到烧杯中,加水溶解,还需要的玻璃仪器是 ,溶液中的阳离子为 。
(2)性质探究:向滴加了酚酞试液的氨水中再滴加足量AlCl3溶液,观察到的现象是 ,反应的化学方程式为 。
| + |
| 4 |
(1)氨气制取:固体NH4Cl与足量消石灰混合加热可以制取氨气。
①选择的发生装置是 ,收集装置是 (选填大写字母)。
②结合选择的装置完成氨气的制取、收集并吸收氨气制取氨水,按气流顺序各装置的接口从左到右依次为 (用小写字母表示)。

③充分反应后冷却,将残余固体转移到烧杯中,加水溶解,还需要的玻璃仪器是 ,溶液中的阳离子为 。
(2)性质探究:向滴加了酚酞试液的氨水中再滴加足量AlCl3溶液,观察到的现象是 ,反应的化学方程式为 。
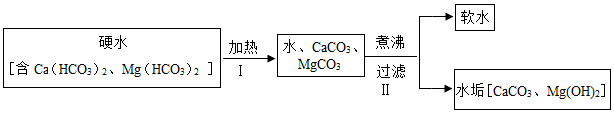
15.水与自然界中矿石长期接触,常含Ca(HCO3)2、Mg(HCO3)2等物质,导致钙离子、镁离子含量较多,称之为硬水.生活中,水的硬度过高会造成一定危害.长期使用硬水烧水的热水壶,内部会形成一层水垢,其主要成分为碳酸钙和氢氧化镁,说明加热煮沸可使这类硬水成为软水.其原理的流程如下、题(气体产物已略去):
回答下列问题:
(1)反应Ⅰ属于四大基本反应类型中的 反应;反应Ⅱ除产生水垢外,还有一种气体产物为 ;如果当地硬水中CaSO4含量较多,则水垢中还常含有少量CaSO4,CaSO4析出的原因是 。
(2)向200g水垢中加入400g过量的稀盐酸,充分反应,测得3分钟内混合物质量的变化(不考虑水与HCl的挥发)如下表所示:
①观察到的现象是 。
②计算水垢中碳酸钙的质量分数,写出必要的计算过程。

回答下列问题:
(1)反应Ⅰ属于四大基本反应类型中的 反应;反应Ⅱ除产生水垢外,还有一种气体产物为 ;如果当地硬水中CaSO4含量较多,则水垢中还常含有少量CaSO4,CaSO4析出的原因是 。
(2)向200g水垢中加入400g过量的稀盐酸,充分反应,测得3分钟内混合物质量的变化(不考虑水与HCl的挥发)如下表所示:
| 时间/s(秒) | 0 | 30 | 60 | 90 | 120 | 180 |
| 混合物的质量/g | 600 | 574 | 554 | 547.2 | 547.2 | 547.2 |
①观察到的现象是 。
②计算水垢中碳酸钙的质量分数,写出必要的计算过程。
查看全部题目