下载高清试卷
【2017年四川省攀枝花市中考化学试卷】-第1页
试卷格式:2017年四川省攀枝花市中考化学试卷.PDF
试卷热词:最新试卷、2017年、四川试卷、攀枝花市试卷、化学试卷、九年级试卷、中考试卷、初中试卷
扫码查看解析
试卷题目
1.下列我国著名科学家中,为相对原子质量的测定作出了卓越贡献的是( )
- A. 钱学森
- B. 屠呦呦
- C. 张青莲
- D. 侯德榜
2.银针是中医针灸的常用器械。银的元素符号是( )
- A. Au
- B. Ag
- C. Mg
- D. Hg
3.开发和利用新能源是国家能源战略发展的方向。下列不属于新能源的是( )
- A. 天然气
- B. 核能
- C. 太阳能
- D. 风能
4.下列物质中,由分子构成的是( )
- A. 镁
- B. 金刚石
- C. 氯化钠
- D. 水
5.研究结果显示:用2%的小苏打溶液漱口能有效预防口腔粘膜溃疡的发生。小苏打属于( )
- A. 盐
- B. 酸
- C. 碱
- D. 氧化物
6.洋葱中含有一种具有强烈刺激性气味的物质﹣正丙硫醇。切洋葱时人会流眼泪,从分子的角度解释正确的是( )
- A. 分子大小发生改变
- B. 分子之间有间隔
- C. 分子在不断运动
- D. 分子可以再分
7.小林从冰箱里拿出冰冻的饮料,用干布擦净瓶外壁的水,放置于桌面片刻,发现瓶外壁又挂满水珠。这说明空气中有( )
- A. 氮气
- B. 水蒸气
- C. 二氧化碳
- D. 氧气
8.攀枝花市某地的土壤呈弱碱性.下列农作物中,适宜在该地种植的是( )
| 选项 | A | B | C | D |
| 农作物 | 茶树 | 油菜 | 棉花 | 甘 草 |
| 适宜作物生长的pH | 5.0~5.5 | 5.8~6.7 | 6.0~6.8 | 7.2~8.5 |
- A. A
- B. B
- C. C
- D. D
9.下列各图所示实验操作中,正确的是( )
- A.
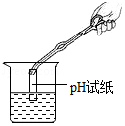 测溶液的pH
测溶液的pH - B.
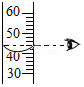 读出液体体积
读出液体体积 - C.
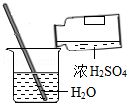 稀释浓硫酸
稀释浓硫酸 - D.
 移走蒸发皿
移走蒸发皿
10.下列现象中,没有发生化学变化的是( )
- A. 浓硫酸溅到白纸上,白纸变黑
- B. 建筑工地上生石灰长时间露天放置
- C. 盛放澄清石灰水的试剂瓶口出现一层白色固体
- D. 敞口放置的氯化钠饱和溶液中有白色固体析出
11.雷阵雨过后,空气特别清新,原因之一是空气中少量氧气(O2 )转化为臭氧(O3),表示为:3O2
2O3。下列说法中正确的是( )
| 放电 |
- A. 等质量的 O2与O3所含原子数相等
- B. O2 转化为O3属于物理变化
- C. O2与O3的相对分子质量相等
- D. O2 与O3都是化合物
12.质量相同的下列四种物质,完全分解后制得氧气质量最多的是( )
- A. H2O2
- B. H2O
- C. KClO3
- D. KMnO4
13.在氯化钡溶液中滴入某种液体,生成白色沉淀。有关说法错误的是( )
- A. 滴入的可能是硝酸银溶液
- B. 反应后溶液可能呈酸性
- C. 白色沉淀可能溶于盐酸
- D. 该反应可能是中和反应
14.活性炭可处理大气污染物NO。在一定条件下的密闭容器中,NO气体与活性炭中的C反应生成甲、乙两种气体,其中甲是空气中含量最多的气体。测得各物质的质量如下表所示:
下列说法正确的是( )
| 物质质量/g反应时间/min | 活性炭 | NO | 甲 | 乙 |
| 0 | 28.72 | 5.00 | 0 | 0 |
| 4 | 28.00 | 1.40 | x | 2.64 |
下列说法正确的是( )
- A. 生成甲、乙的分子数之比为1:1
- B. 反应消耗的C与NO的质量之比为2:5
- C. x的值为26.76
- D. 反应中活性炭只起吸附作用
15.某研究所利用热分析仪对草酸钙晶体(CaC2O4•xH2O)进行热分解,获得数据,绘制成固体质量﹣分解温度的关系如图所示。下列说法正确的是( )


- A. CaC2O4•xH2O中x=2
- B. 500~650℃范围内的残留固体为CaC2O4
- C. 固体质量由12.8g变为10.0g时发生的反应为CaC2O4CaCO3+CO↑
高温 - D. 800℃以上时,固体成分的化学式为CaCO3
16.用铁粉和氧化铜的混合物8.32g进行如下实验:
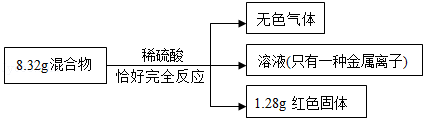
下列说法正确的是( )

下列说法正确的是( )
- A. 8.32g混合物中含铁粉7.04g
- B. 无色气体质量为0.20g
- C. 溶液中硫酸亚铁的质量为15.20g
- D. 实验中参与反应的H2SO4的质量为9.80g
17.用化学用语填空:
(1)4个钾离子 。 (2)4个二氧化硫分子 。
(3)干冰的化学式 。(4)由4个磷原子构成的单质分子 。
(1)4个钾离子 。 (2)4个二氧化硫分子 。
(3)干冰的化学式 。(4)由4个磷原子构成的单质分子 。
18.我国自主研发的"硅衬底高光效氮化镓(GaN)发光二极管(简称LED)技术"已广泛应用于照明、显像等多个领域。请回答下列问题:
(1)有以下微粒的结构示意图:

上述微粒中,属于硅原子的是 (填序号),属于阳离子的是 (填序号),化学性质相似的是 (填序号),D粒子的化学符号为 。
(2)镓(Ga)的原子结构示意图为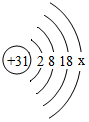 ,x= 。磷化镓也是制造LED的一种材料,其化学式为 。
,x= 。磷化镓也是制造LED的一种材料,其化学式为 。
(1)有以下微粒的结构示意图:

上述微粒中,属于硅原子的是 (填序号),属于阳离子的是 (填序号),化学性质相似的是 (填序号),D粒子的化学符号为 。
(2)镓(Ga)的原子结构示意图为
 ,x= 。磷化镓也是制造LED的一种材料,其化学式为 。
,x= 。磷化镓也是制造LED的一种材料,其化学式为 。19.铬(Cr)及其化合物如:三氧化二铬(Cr2O3)、铬酸钠 (Na2CrO4)、重铬酸钠(Na2Cr2O7)等是工业中有重要作用的物质。有如下反应:
①Cr2O3+3Ca
2Cr+3CaO
②2Cr2O3+3O2+8NaOH
4Na2CrO4+4H2O
③2Na2CrO4+H2SO4═Na2Cr2O7+X+H2O
回答下列问题:
(1)反应③中X的化学式为 。在上述反应中,属于置换反应的是 ,反应后铬元素化合价升高的是 。
(2)Ca﹣CaCrO4电池是战术导弹的常用电源。向Na2CrO4溶液中加入CaCl2溶液可得CaCrO4沉淀,反应的化学方程式是 。
①Cr2O3+3Ca
| 高温 |
②2Cr2O3+3O2+8NaOH
| 高温 |
③2Na2CrO4+H2SO4═Na2Cr2O7+X+H2O
回答下列问题:
(1)反应③中X的化学式为 。在上述反应中,属于置换反应的是 ,反应后铬元素化合价升高的是 。
(2)Ca﹣CaCrO4电池是战术导弹的常用电源。向Na2CrO4溶液中加入CaCl2溶液可得CaCrO4沉淀,反应的化学方程式是 。
20.甲、乙、丙三种固体物质的溶解度曲线如图所示。回答下列问题:

(1)t1℃时,将25g丙固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为 g。
(2)现有操作步骤:
A.溶解 B.过滤 C.降温结晶 D.加热浓缩。
若甲固体中含有少量乙,则提纯甲的操作步骤是 (填序号)。
(3)将t2℃时甲、乙、丙三种固体物质的饱和溶液降温到t1℃,其溶质质量分数由大到小的顺序是 。
(4)向100g t2℃的水中加入55g甲的固体,发现全部溶解,一段时间后又有部分甲的固体析出。“全部溶解”的原因可能是 。

(1)t1℃时,将25g丙固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为 g。
(2)现有操作步骤:
A.溶解 B.过滤 C.降温结晶 D.加热浓缩。
若甲固体中含有少量乙,则提纯甲的操作步骤是 (填序号)。
(3)将t2℃时甲、乙、丙三种固体物质的饱和溶液降温到t1℃,其溶质质量分数由大到小的顺序是 。
(4)向100g t2℃的水中加入55g甲的固体,发现全部溶解,一段时间后又有部分甲的固体析出。“全部溶解”的原因可能是 。
21.生活中处处有化学知识.回答下列问题:
(1)人们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 作用.
(2)常用 检验水样是否属于硬水. 若为硬水,常采取 的方法降低硬度.
(3)炒菜时锅中的油起火燃烧,若向燃着的油锅里加水,不但不能灭火,还会使油滴飞溅出来燃烧更加剧烈,其原因是 .正确的方法是用锅盖盖灭,其原理是 .
(1)人们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 作用.
(2)常用 检验水样是否属于硬水. 若为硬水,常采取 的方法降低硬度.
(3)炒菜时锅中的油起火燃烧,若向燃着的油锅里加水,不但不能灭火,还会使油滴飞溅出来燃烧更加剧烈,其原因是 .正确的方法是用锅盖盖灭,其原理是 .
22.小明将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。
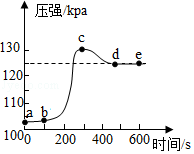
回答下列问题:
(1)ab段发生反应的化学方程式是 。
(2)bc段发生反应的化学方程式是 。
(3)cd段压强变化的主要原因是 。

回答下列问题:
(1)ab段发生反应的化学方程式是 。
(2)bc段发生反应的化学方程式是 。
(3)cd段压强变化的主要原因是 。
23.工业上常利用石灰浆[主要成分为Ca(OH)2]制备化工原料KClO3的流程如下:
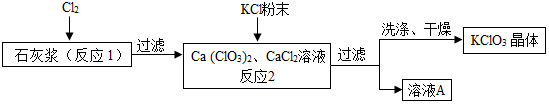
已知:①反应1为:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。
②有关物质在常温下的溶解度如下:
回答下列问题:
(1)在实验中两次涉及过滤操作,完成此操作需要的玻璃仪器有烧杯、玻璃棒、 ,该操作中玻璃棒的作用是 。
(2)Ca(ClO3)2的名称是 。对于反应1,参加反应的Cl2中有一部分Cl的化合价升高,另一部分降低,则化合价升高的Cl与化合价降低的Cl 的个数比为 。
(3)反应2为KCl与Ca(ClO3)2发生的复分解反应,该反应能发生的主要原因是 。溶液A中含有的溶质为CaCl2和 (填化学式)。
(4)上述流程中析出的KClO3晶体表面通常吸附有Ca2+、Cl﹣等杂质离子,过滤时洗涤KClO3晶体,应选用下列中的 饱和溶液(填编号)。
A.KCl B.CaCl2 C.KClO3 D.Na2CO3。

已知:①反应1为:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。
②有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.0 |
回答下列问题:
(1)在实验中两次涉及过滤操作,完成此操作需要的玻璃仪器有烧杯、玻璃棒、 ,该操作中玻璃棒的作用是 。
(2)Ca(ClO3)2的名称是 。对于反应1,参加反应的Cl2中有一部分Cl的化合价升高,另一部分降低,则化合价升高的Cl与化合价降低的Cl 的个数比为 。
(3)反应2为KCl与Ca(ClO3)2发生的复分解反应,该反应能发生的主要原因是 。溶液A中含有的溶质为CaCl2和 (填化学式)。
(4)上述流程中析出的KClO3晶体表面通常吸附有Ca2+、Cl﹣等杂质离子,过滤时洗涤KClO3晶体,应选用下列中的 饱和溶液(填编号)。
A.KCl B.CaCl2 C.KClO3 D.Na2CO3。
24.某学习小组在实验室中看到氢氧化钠(固体)试剂瓶标签上标注着"NaOH含量不少于96。0%",提出对氢氧化钠固体中主要含有的杂质成分进行探究。
【提出问题】氢氧化钠固体中主要含有什么杂质?
【查阅资料】工业制取NaOH的反应原理是2NaCI+2H2O
2NaOH+H2↑+CI2↑,然后蒸发溶剂获得氢氧化钠固体。
【提出猜想】氢氧化钠固体中主要杂质为NaCI和Na2CO3。
小组同学猜想含有NaCI的理由是原料中的氯化钠没有完全转化为氢氧化钠;含有Na2CO3的理由是 。
【实验探究】
【实验反思】步骤②所得溶液中的溶质除NaCI外,还有 。
【提出问题】氢氧化钠固体中主要含有什么杂质?
【查阅资料】工业制取NaOH的反应原理是2NaCI+2H2O
| 通电 |
【提出猜想】氢氧化钠固体中主要杂质为NaCI和Na2CO3。
小组同学猜想含有NaCI的理由是原料中的氯化钠没有完全转化为氢氧化钠;含有Na2CO3的理由是 。
【实验探究】
【实验反思】步骤②所得溶液中的溶质除NaCI外,还有 。
25.氯化亚铁具有独特的脱色能力,广泛用于印染、造纸等行业。某课题小组设计如下方案制备氯化亚铁。
已知:①氯化铁易与水反应;②在加热条件下,氢气能与氯化铁反应生成FeCl2和HCl。③碱石灰中含有CaO与NaOH。
小组同学设计下列装置制备少量氯化亚铁(装置不能重复使用)。

回答下列问题:
(1)实验开始前应先检验装置的气密性。请叙述检验装置A气密性的方法:关闭活塞, 。
(2)气流从左至右,装置接口连接顺序是:a→ → → → →d
(3)装置D中发生反应的化学方程式是 。
(4)装置C中碱石灰的作用是防止空气中的水蒸气进入和 。
(5)实验过程中,在点燃装置D中的酒精灯之前,从安全角度考虑必须要进行的操作是 。
已知:①氯化铁易与水反应;②在加热条件下,氢气能与氯化铁反应生成FeCl2和HCl。③碱石灰中含有CaO与NaOH。
小组同学设计下列装置制备少量氯化亚铁(装置不能重复使用)。

回答下列问题:
(1)实验开始前应先检验装置的气密性。请叙述检验装置A气密性的方法:关闭活塞, 。
(2)气流从左至右,装置接口连接顺序是:a→ → → → →d
(3)装置D中发生反应的化学方程式是 。
(4)装置C中碱石灰的作用是防止空气中的水蒸气进入和 。
(5)实验过程中,在点燃装置D中的酒精灯之前,从安全角度考虑必须要进行的操作是 。
26.施肥是农业增产的重要手段,CO(NH2)2、(NH4)2HPO4是常用的化学肥料。
回答下列问题:
(1)(NH4)2HPO4中N和H原子的个数比为 。
(2)CO(NH2)2的相对分子质量 。
(3)经农科所技术人员检测,某农户的农作物缺磷和氮。若需补充磷3.1kg和氮7.0kg,则至少需要施用 kg(NH4)2HPO4和 kg CO(NH2)2。
回答下列问题:
(1)(NH4)2HPO4中N和H原子的个数比为 。
(2)CO(NH2)2的相对分子质量 。
(3)经农科所技术人员检测,某农户的农作物缺磷和氮。若需补充磷3.1kg和氮7.0kg,则至少需要施用 kg(NH4)2HPO4和 kg CO(NH2)2。
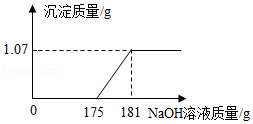
27.工业合成盐酸中通常溶有少量的FeCl3。工业合成盐酸的国家质量标准规定:含HCl的质量分数<31.0%或含铁(以Fe计) 的质量分数>0.01%的产品均为不合格产品。某厂质检室对本厂生产的某一批次工业合成盐酸进行质量检验,方法是:取该批次产品l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。请你计算产品中含HCl的质量分数和含铁(以Fe计) 的质量分数,并判断该批次产品是否合格。(写出计算过程,计算结果精确到0.1%)

查看全部题目