下载高清试卷
【2018年山东省潍坊市中考化学试卷】-第9页
试卷格式:2018年山东省潍坊市中考化学试卷.PDF
试卷热词:最新试卷、2018年、山东试卷、潍坊市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.人体缺铁会引起缺铁性贫血。这里“铁”一般是指( )
- A. 元素
- B. 单质
- C. 原子
- D. 分子
2.下列实验用品中,由有机合成材料制成的是( )
- A.
 玻璃烧杯
玻璃烧杯 - B.
 铁架台
铁架台 - C.
 橡胶塞
橡胶塞 - D.
 蒸发皿
蒸发皿
3.6000L氧气在加压的情况下可装入容积为40L的钢瓶中。这主要说明( )
- A. 分子在不断的运动
- B. 分子之间有间隔
- C. 分子是由原子构成的
- D. 分子质量很小
4.下列物质不属于溶液的是( )
- A. 碘酒
- B. 矿泉水
- C. 白醋
- D. 蒸馏水
5.下列符号能表示两个氢原子的是( )
- A. H2
- B. 2H2
- C. 2H
- D. 2H+
6.2017年9月,我国成功提纯了“超级金属”铼。铼在元素周期表中信息如图所示。下列说法不正确的是( )
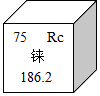

- A. 原子序数为75
- B. 原子的核外电子数为75
- C. 元素符号为Re
- D. 相对原子质量为186.2g
7.为保障“舌尖上的安全”,下列做法合理的是( )
- A. 霉变大米蒸煮后食用
- B. 甲醛溶液浸泡虾仁防腐
- C. 按规定使用食品添加剂
- D. 用工业用盐如亚硝酸钠烹调食物
8.下列属于置换反应的是( )
- A. 2H2O2H2↑+O2↑
通电 - B. S+O2SO2
点燃 - C. NaOH+HCl=NaCl+H2O
- D. 2Al+6HCl=2AlCl3+3H2↑
9.某矿石样本只含有如图所示的四种元素,该矿石中可能含有的物质是( )
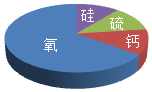

- A. CaCO3
- B. SiO2
- C. Al2O3
- D. CuFeS2
10.下列“家庭小实验”中,不能达到预期目的是( )
- A. 用铜片和食醋混合制氢气
- B. 用某些植物的花瓣制酸碱指示剂
- C. 用柠檬酸、果汁、白糖、水、小苏打等制汽水
- D. 用塑料瓶、小卵石、石英砂、活性炭、蓬松棉、纱布等制作简易净水器
11.“绿水青山就是金山银山”是建设生态文明的重要理念。下列说法不正确的是( )
- A. 用乙醇汽油替代部分燃油可减少空气污染
- B. 电动机车逐步替代燃油机车符合绿色发展理念
- C. “可燃冰”主要含有甲烷水合物,将成为未来新能源
- D. 含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中
12.汉黄芩素(C16H12O5)是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是( )
- A. 汉黄芩素由碳、氢、氧三种元素组成
- B. 汉黄芩素中碳氧元素的质量比为12:5
- C. 汉黄芩素在氧气中完全燃烧生成二氧化碳和水
- D. 汉黄芩素中含有16个碳原子,12个氢原子和5个氧原子
13.一种新型火箭推进剂在火箭发射过程中,发生反应的微观过程如图所示。
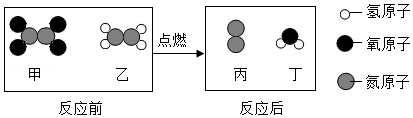
下列说法不正确的是( )

下列说法不正确的是( )
- A. 反应前后分子种类改变
- B. 反应前后原子种类不变
- C. 反应前后氧元素质量减小
- D. 生成物丙和丁的分子个数比为3:4
14.下列根据实验操作所得出的现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用小木条蘸少量浓硫酸 | 小木条变成黑色 | 浓硫酸具有吸水性 |
| B | 向紫色石蕊溶液中通入CO2气体 | 溶液变成紅色 | 不能说明CO2与水反应 |
| C | 向盛有红棕色NO2气体的集气瓶中加入活性炭 | 红棕色消失 | 碳与NO2发生化学反应 |
| D | 向H2O2溶液中加入少量MnO2粉末 | 产生大量气体 | MnO2是该反应的催化剂 |
- A. A
- B. B
- C. C
- D. D
15.如图是自然界中碳、氧循环简图(X为H2CO3,Y为C6H12O6)。下列说法不正确的是( )
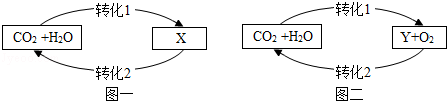

- A. 图一中的转化1是酸雨形成的主要原因
- B. 图二中可实现有机物与无机物的相互转化
- C. 绿色植物通过光合作用,将太阳能转化成化学能
- D. 碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
16.化学与生产、生活密切相关。对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用洗涤剂洗去油污 | 洗涤剂能溶解油污 |
| B | 堆放杂物的纸箱着火,用水浇灭 | 水能降低纸箱的着火点 |
| C | 熬胆矾铁釜,久之亦化为铜 | Fe+CuSO4═FeSO4+Cu |
| D | 书写具有保存价值的档案时,规定应使用碳素墨水 | 使用方便,宇迹清晰 |
- A. A
- B. B
- C. C
- D. D
17.NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气中过量条件下的NOx排放。其工作原理如图所示。
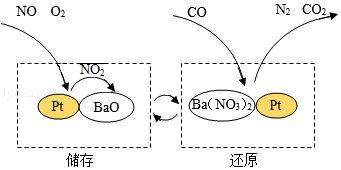
下列说法不正确的是( )

下列说法不正确的是( )
- A. BaO属于金属氧化物,Ba(NO3)2属于硝酸盐
- B. CO2、甲烷(CH4)、臭氧(O3)等气体都能产生温室效应
- C. 该技术实现了由NOx到N2的转化,减少了对空气的污染
- D. 还原时发生反:5CO+Ba(NO3)2N2+BaO+5CO2,其中N、C、Ba三种元素的化合价在反应前后均发生改变
一定条件
18.M是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组用物质M进行了如图2所示实验。下列说法不正确的是( )
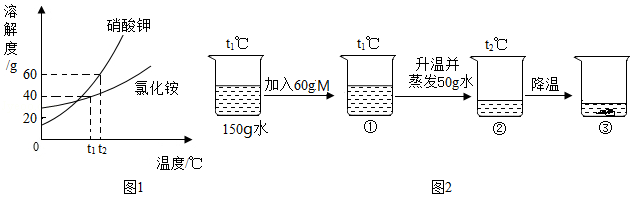

- A. 物质M是硝酸钾
- B. 溶液②中溶质质量分数为37.5%
- C. 溶液①②③中,溶质质量分数的关系是②>③>①
- D. 溶液①为不饱和溶液,溶液②和③为饱和溶液
19.升温、增大浓度、加大压强和使用催化剂均可以提高化学反应速率。现把镁条投入盛有稀盐酸的试管中,试管外壁发烫。产生氢气的速率变化情况(v)和反应进行的时间(t) 的关系如图所示,则下列说法不正确的是( )
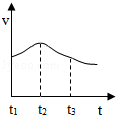

- A. 反应过程中溶液的pH逐渐增大
- B. t1~t2速率变化的主要原因是反应物的量较多
- C. t2~t3速率变化的主要原因是盐酸的浓度逐渐减小
- D. t1~t2速率变化的主要原因是反应放热使溶液温度升高
20.甲、乙、丙、丁四种物质的转化关系如图所示(“→”表示反应一步实现,部分物质及条件已略去)。下列选项能实现图示转化的是( )
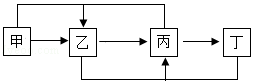
| 物质选项 | 甲 | 乙 | 丙 | 丁 |
| A | C | CO | CO2 | CaCO3 |
| B | Na2CO3 | NaOH | NaCl | CuCl2 |
| C | Ca( OH)2 | CaCO3 | CO2 | H2CO3 |
| D | H2SO4 | H2 | Fe | Fe3O4 |

- A. A
- B. B
- C. C
- D. D
21.化学源于生活,与工农业生产密切相关。
(1)空气是一种宝贵的自然资源。
①食品包装中充N2以防腐,是由于N2 。
②法国化学家拉瓦锡用 (填“定性”或“定量”)的方法研究了空气的成分。
(2)水作为一种化学物质,能参与许多反应。
①铁制品锈蚀是铁与空气中的 、水蒸气等发生化学反应的结果。
②NaCl溶液能导电,是因为NaCl在水分子的作用下,解离出 。
(3)合理膳食,均衡营养使我们更健康。某食品包装袋上的部分说明如图。
①在饼干配料中,富含油脂的是 。饼干要置于阴凉干燥处,从变化的角度看,是为了 (填“加快”或“减慢”)氧化的速度。
②在农业上碳酸氢铵可用做 肥,但不能跟碱性物质混用,原因是 。

(1)空气是一种宝贵的自然资源。
①食品包装中充N2以防腐,是由于N2 。
②法国化学家拉瓦锡用 (填“定性”或“定量”)的方法研究了空气的成分。
(2)水作为一种化学物质,能参与许多反应。
①铁制品锈蚀是铁与空气中的 、水蒸气等发生化学反应的结果。
②NaCl溶液能导电,是因为NaCl在水分子的作用下,解离出 。
(3)合理膳食,均衡营养使我们更健康。某食品包装袋上的部分说明如图。
①在饼干配料中,富含油脂的是 。饼干要置于阴凉干燥处,从变化的角度看,是为了 (填“加快”或“减慢”)氧化的速度。
②在农业上碳酸氢铵可用做 肥,但不能跟碱性物质混用,原因是 。

22.近五年来,我国在科技、文化、环境等方面创新发展。
I、大国重器航天、航空取得重大突破
2018年4月2日,天宫一号目标飞行器圆满完成各项任务返回大气层。这标志着我国航天航空事业进入了新时代。
(1)硅是天宫一号动力源太阳能电池的主要构成材料。单质硅是由石英(SiO2)固体与碳在高温条件下反应制得的,同时生成一种可燃性气体,该反应的化学方程式为 。
(2)硅还是计算机芯片的基体材料,但其导热性不好,而金刚石在导热性方面远超过硅,于是它成了芯片基体材料的最佳选择。
①从原子结构上分析,金刚石(C)和硅有相似化学性质的原因是 。
②因天然金刚石资源稀少,难以满足要求。人们就根据金刚石的组成和结构设法制造金刚石。现有两种制造金刚石的方法,一是以石墨为原料在高温高压和催化剂的条件下合成;二是在较低温度和压力下用甲烷(CH4)等为原料制造金刚石薄膜。
下列说法不正确的是 (写字母序号)。
A、一种元素可以组成多种性质不同的单质
B、石墨合成金刚石发生的是物理变化
C、石墨与金刚石物理性质不同是因为结构不同
D、物质的性质在很大程度上决定了物质的用途,但不是唯一的决定因素
③不仅硅与碳具有相似化学性质,其氧化物二氧化硅和二氧化碳也有相似化学性质。试写出二氧化硅与氢氧化钠溶液反应的化学方程式 。
Ⅱ、文化自信一传承中华优秀传统文化
古代我国人民就积累了许多对物质变化的认识。春秋末期齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳灰)混合加水所得溶液来洗涤丝帛。这种溶液能洗涤丝帛主要是因为其中一定含有 (写化学式,水除外)。(注:草木灰的主要成分为碳酸钾,贝壳灰的主要成分为氧化钙)
I、大国重器航天、航空取得重大突破
2018年4月2日,天宫一号目标飞行器圆满完成各项任务返回大气层。这标志着我国航天航空事业进入了新时代。
(1)硅是天宫一号动力源太阳能电池的主要构成材料。单质硅是由石英(SiO2)固体与碳在高温条件下反应制得的,同时生成一种可燃性气体,该反应的化学方程式为 。
(2)硅还是计算机芯片的基体材料,但其导热性不好,而金刚石在导热性方面远超过硅,于是它成了芯片基体材料的最佳选择。
①从原子结构上分析,金刚石(C)和硅有相似化学性质的原因是 。
②因天然金刚石资源稀少,难以满足要求。人们就根据金刚石的组成和结构设法制造金刚石。现有两种制造金刚石的方法,一是以石墨为原料在高温高压和催化剂的条件下合成;二是在较低温度和压力下用甲烷(CH4)等为原料制造金刚石薄膜。
下列说法不正确的是 (写字母序号)。
A、一种元素可以组成多种性质不同的单质
B、石墨合成金刚石发生的是物理变化
C、石墨与金刚石物理性质不同是因为结构不同
D、物质的性质在很大程度上决定了物质的用途,但不是唯一的决定因素
③不仅硅与碳具有相似化学性质,其氧化物二氧化硅和二氧化碳也有相似化学性质。试写出二氧化硅与氢氧化钠溶液反应的化学方程式 。
Ⅱ、文化自信一传承中华优秀传统文化
古代我国人民就积累了许多对物质变化的认识。春秋末期齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳灰)混合加水所得溶液来洗涤丝帛。这种溶液能洗涤丝帛主要是因为其中一定含有 (写化学式,水除外)。(注:草木灰的主要成分为碳酸钾,贝壳灰的主要成分为氧化钙)
23.酸、碱、盐是我们身边重要的化合物,在生活和生产中具有广泛的应用。
(1)锅炉水垢既会降低燃料的利用率,影响锅炉的使用寿命,还可能造成安全隐患。某锅炉水垢的主要成分有CaCO3、Mg(OH)2、Fe2O3,用“酸洗”法可除去该水垢。
①“酸洗”时,一般不选用稀硫酸的原因是 。
②写出稀盐酸与氧化铁反应的化学方程式 。
(2)两种抗胃酸药剂的主要成分及建议每次剂量见表:
服用Mg(OH)2的药效比服用NaHCO3“强”的原因是 。
(3)某校化学兴趣小组在课外活动中,对三种溶液进行了检验,检验的结果如表所示:
其中第 组结果肯定不正确。
(4)在CuO和Fe的混合物中加入一定量的稀硫酸,微热,待反应停止后过滤,滤出不溶物后再往滤液里加入一枚铁钉,若铁钉无变化,不溶物中一定含有 ,滤液中含有的溶质是 。
(1)锅炉水垢既会降低燃料的利用率,影响锅炉的使用寿命,还可能造成安全隐患。某锅炉水垢的主要成分有CaCO3、Mg(OH)2、Fe2O3,用“酸洗”法可除去该水垢。
①“酸洗”时,一般不选用稀硫酸的原因是 。
②写出稀盐酸与氧化铁反应的化学方程式 。
(2)两种抗胃酸药剂的主要成分及建议每次剂量见表:
| 主要成分 | NaHCO3 | Mg(OH)2 |
| 建议每次剂量/g | 0.5 | 0.3 |
服用Mg(OH)2的药效比服用NaHCO3“强”的原因是 。
(3)某校化学兴趣小组在课外活动中,对三种溶液进行了检验,检验的结果如表所示:
| 组别 | 溶液中检验出的物质 |
| 1 | CaCl2、NaCl、CaCO3 |
| 2 | Ba(OH)2、H2SO4、NaCl |
| 3 | KCl、Na2SO4、NaCl |
其中第 组结果肯定不正确。
(4)在CuO和Fe的混合物中加入一定量的稀硫酸,微热,待反应停止后过滤,滤出不溶物后再往滤液里加入一枚铁钉,若铁钉无变化,不溶物中一定含有 ,滤液中含有的溶质是 。
24.侯德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展作出了杰出的贡献。工业上以半水煤气(主要成分是N2、H2、CO、CO2和H2O)、食盐等为原料制取纯碱的流程如下:

(1)流程中循环利用的物质有H2O和 。
(2)步骤Ⅰ中,在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了CO转化,化学方程式是 。
(3)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图所示。广口瓶和分液漏斗中盛放的药品分别是 、 。
(4)除去纯碱中少量碳酸氢钠杂质的方法是 。
(5)纯碱用途广泛。工业上可用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,达到减少污染、节约资源的目的。反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为 。
②不断通入SO2,最终产物是 。



(1)流程中循环利用的物质有H2O和 。
(2)步骤Ⅰ中,在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了CO转化,化学方程式是 。
(3)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图所示。广口瓶和分液漏斗中盛放的药品分别是 、 。
(4)除去纯碱中少量碳酸氢钠杂质的方法是 。
(5)纯碱用途广泛。工业上可用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,达到减少污染、节约资源的目的。反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为 。
②不断通入SO2,最终产物是 。


25.某课外研究小组,用废弃的黄铜(铜锌合金),通过两种途径制取硫酸铜晶体。实验流程如图所示:
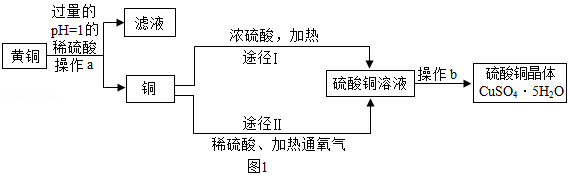
(1)操作a为 ,该操作中用到的玻璃仪器有烧杯、 、玻璃棒。
(2)浓硫酸是化学实验室里一种常见的酸。
①实验室稀释浓硫酸的操作是:将 ,并用玻璃棒不断搅拌。
②化学实验应高度关注安全问题。若不慎将少量浓硫酸沾到皮肤上,应先用大量水冲洗,再涂 溶液。
(3)如图2是实验室用过氧化氢溶液和二氧化锰制取氧气的装置。
①主要实验操作步骤有:
a、收集气体 b、检查装置气密性 c、将二氧化锰放入锥形瓶中 d、从长颈漏斗中注入过氧化氢溶液
正确的操作顺序是 (写字母序号)。
②在实验过程中,某同学因加入的药品量不足,致使集气瓶内剩余少量水。若想集满这瓶氧气,在不拆卸装置和不添加药品的前提下,请帮他想出种解决的方法 。
(4)操作b的顺序为蒸发浓缩、 过滤、干燥。
(5)下列测定稀硫酸pH的操作正确的是 (写字母序号)。
A、将pH试纸直接插入稀硫酸中
B、先将pH试纸用蒸馏水润湿
C、用玻璃棒蘸取少量稀硫酸,滴在pH试纸上
D、根据试纸显示的颜色估算出溶液的pH


(1)操作a为 ,该操作中用到的玻璃仪器有烧杯、 、玻璃棒。
(2)浓硫酸是化学实验室里一种常见的酸。
①实验室稀释浓硫酸的操作是:将 ,并用玻璃棒不断搅拌。
②化学实验应高度关注安全问题。若不慎将少量浓硫酸沾到皮肤上,应先用大量水冲洗,再涂 溶液。
(3)如图2是实验室用过氧化氢溶液和二氧化锰制取氧气的装置。
①主要实验操作步骤有:
a、收集气体 b、检查装置气密性 c、将二氧化锰放入锥形瓶中 d、从长颈漏斗中注入过氧化氢溶液
正确的操作顺序是 (写字母序号)。
②在实验过程中,某同学因加入的药品量不足,致使集气瓶内剩余少量水。若想集满这瓶氧气,在不拆卸装置和不添加药品的前提下,请帮他想出种解决的方法 。
(4)操作b的顺序为蒸发浓缩、 过滤、干燥。
(5)下列测定稀硫酸pH的操作正确的是 (写字母序号)。
A、将pH试纸直接插入稀硫酸中
B、先将pH试纸用蒸馏水润湿
C、用玻璃棒蘸取少量稀硫酸,滴在pH试纸上
D、根据试纸显示的颜色估算出溶液的pH

26.金属镁可与热水反应生成氢氧化镁和氢气,所得溶液呈碱性,可使酚酞溶液显紅色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
(1)镁与热水反应的化学方程式是 。
(2)查阅资料:溶液红色褪去的原因是溶液碱性减弱。
【提出问题】导致溶液碱性减弱的原因是什么?
【假设与分析】
假设1:可能是氢氧化镁与N2或O2发生了反应。
假设2:可能是溶液吸收了空气中的 。
假设3:可能是氢氧化镁的溶解度随温度的降低而 。
由碱的性质可知,假设1不成立。
【实验探究】
【拓展延伸】
(3)将一小块金属钠投入硫酸铜溶液时,产生蓝色沉淀。请解释其原因: 。
(4)除上述金属外,根据金属活动性顺序,预测 也能跟硫酸铜溶液反应产生上述现象(举一例即可)。
(1)镁与热水反应的化学方程式是 。
(2)查阅资料:溶液红色褪去的原因是溶液碱性减弱。
【提出问题】导致溶液碱性减弱的原因是什么?
【假设与分析】
假设1:可能是氢氧化镁与N2或O2发生了反应。
假设2:可能是溶液吸收了空气中的 。
假设3:可能是氢氧化镁的溶解度随温度的降低而 。
由碱的性质可知,假设1不成立。
【实验探究】
| 实验操作 | 实验现象 | 结论 |
| 1、取上述紅色溶液,保持温度不变,在空气中放置一段时间,观察现象。 | ① | 假设2成立 |
| 2、取上述红色溶液,② ,③ 观察现象。 | 红色褪去 | 假设③成立 |
【拓展延伸】
(3)将一小块金属钠投入硫酸铜溶液时,产生蓝色沉淀。请解释其原因: 。
(4)除上述金属外,根据金属活动性顺序,预测 也能跟硫酸铜溶液反应产生上述现象(举一例即可)。
27.工业纯碱中常含有少量的氯化钠。某学习小组对其组成展开探究。现取24g纯碱样品,加入100g水使其完全溶解,再加入96g过量的氯化钙溶液,完全反应后,过滤、洗涤、干燥得沉淀20g。完成下列问题:
(1)反应后溶液中含有的溶质是 。(写化学式)。
(2)通过已知数据,能求出的量有 (写字母序号)。
A、反应后溶液的总质量
B、参加反应的氯化钙的质量
C、样品中碳酸钠的质量分数
D、氯化钙溶液中溶质的质量分数
(3)计算反应后溶液中氯化钠的质量分数。(写出计算过程,结果保留到0.1%)
(1)反应后溶液中含有的溶质是 。(写化学式)。
(2)通过已知数据,能求出的量有 (写字母序号)。
A、反应后溶液的总质量
B、参加反应的氯化钙的质量
C、样品中碳酸钠的质量分数
D、氯化钙溶液中溶质的质量分数
(3)计算反应后溶液中氯化钠的质量分数。(写出计算过程,结果保留到0.1%)
查看全部题目