下载高清试卷
【2021年江苏省连云港市中考化学试卷】-第1页
试卷格式:2021年江苏省连云港市中考化学试卷.PDF
试卷热词:最新试卷、2021年、江苏试卷、连云港市试卷、化学试卷、九年级试卷、中考试卷、初中试卷
扫码查看解析
试卷题目
1.2021年5月15日“祝融号”火星车成功着陆。该车使用了新型镁锂合金,下列说法正确的是( )


- A. 镁锂合金属于金属材料
- B. 锂属于非金属元素
- C. 镁是地壳中含量最高的金属元素
- D. 镁锂合金的硬度比镁的小
2.变化无处不在。生活中的下列现象是由化学变化引起的是( )
- A. 湿衣晾干
- B. 铁锅生锈
- C. 小麦磨粉
- D. 滴水成冰
3.阅读下列材料:氟在元素周期表中相关信息如图1所示,其原子在化学反应中容易得到1个电子达到相对稳定结构,两个氟原子构成一个氟气分子。在牙膏中添加氟化钠可降低患蛀牙的概率。钠原子的结构示意图如图2所示。

下列化学用语表示错误的是( )

下列化学用语表示错误的是( )
- A. 2个钠离子:2Na+
- B. 2个氟原子:F2
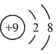
- C. F﹣的结构示意图:
- D. 氟化钠的化学式:NaF
4.阅读下列材料:氟在元素周期表中相关信息如图1所示,其原子在化学反应中容易得到1个电子达到相对稳定结构,两个氟原子构成一个氟气分子。在牙膏中添加氟化钠可降低患蛀牙的概率。钠原子的结构示意图如图2所示。

下列说法正确的是( )

下列说法正确的是( )
- A. 氟元素的相对原子质量为19.00g
- B. 1个氟气分子中含有9个质子
- C. 钠原子在化学反应中易失去1个电子
- D. F﹣和Na+的最外层电子数不相等
5.下列有关粗盐提纯实验中的相关装置和操作,正确的是( )
- A.
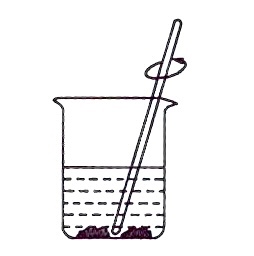 溶解粗盐
溶解粗盐 - B.
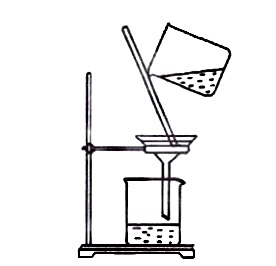 过滤食盐水
过滤食盐水 - C.
 蒸发食盐水
蒸发食盐水 - D.
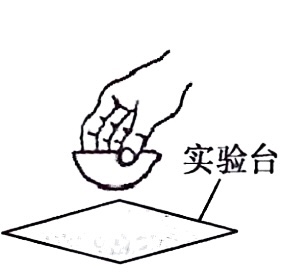 冷却蒸发皿
冷却蒸发皿
6.空气是人类生产活动的重要资源。下列空气中各组分的性质与用途具有对应关系的是( )
- A. 氧气无色无味,可用于医疗急救吸氧
- B. 氮气化学性质不活泼,可用于制造硝酸
- C. 二氧化碳能与水反应,可用于制干冰
- D. 稀有气体在通电时能发出不同颜色的光,可用于制航标灯
7.化学就在我们身边。下列说法正确的是( )
- A. 生活中常用煮沸的方法来降低水的硬度
- B. 霉变的大米、花生经蒸煮后可继续食用
- C. 铵态氮肥与熟石灰混合使用可以提高肥效
- D. 炒菜时油锅起火可放入菜叶灭火,原理是降低了油的着火点
8.化学是实验科学。下列实验方法能达到实验目的的是( )
| 选项 | 实验目的 | 实验方法 |
| A | 配制质量分数为5%的KNO3溶液 | 向盛有5.0g KNO3固体的烧杯中,加入100g水,搅拌 |
| B | 验证Al、Cu、Ag的金属活动性顺序 | 向CuSO4溶液和AgNO3溶液中各放入大小、形状相同的Al丝 |
| C | 检验氢气的纯度 | 用拇指堵住集满氢气的试管口,管口向下靠近火焰,移开拇指点火 |
| D | 鉴别CuSO4、BaSO4和CaCO3三种白色固体 | 分别取少量固体样品,加适量水,搅拌 |
- A. A
- B. B
- C. C
- D. D
9.NH3的合成开启了工业催化新纪元,为世界粮食增产做出了巨大贡献。以N2和H2为反应物合成NH3的微观过程如图:
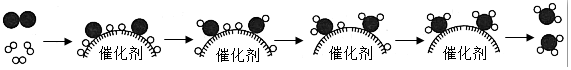
下列说法正确的是( )

下列说法正确的是( )
- A.
 表示氢气分子
表示氢气分子 - B. 过程中有“NH”“NH2”原子团生成
- C. 参加反应的H2与生成的NH3个数比为2:3
- D. 反应结束后催化剂的质量增加
10.回收含铜废料(主要成分为Cu)中的铜,部分实验流程如图:
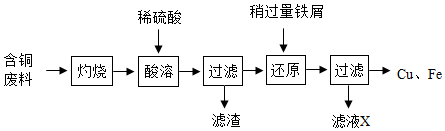
注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
下列关于该流程的说法,错误的是( )

注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
下列关于该流程的说法,错误的是( )
- A. “灼烧”的主要目的是将Cu转变为CuO
- B. 滤液X中的溶质为FeSO4
- C. “酸溶”和“还原”过程中发生的反应均为置换反应
- D. 将Cu、Fe混合物加入足量稀硫酸中,充分反应后过滤得Cu
11.向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法正确的是( )
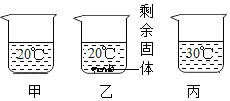

- A. 可采用升温的方法使乙烧杯中剩余的固体溶解
- B. 甲、丙烧杯中的溶液一定属于不饱和溶液
- C. 乙、丙烧杯中溶质的质量分数相等
- D. 蔗糖的溶解度随温度的升高而减小
12.常温下,通过下列实验探究Ca(OH)2的性质:
步骤一:向两支试管中分别加入0.2g Ca(OH)2粉末,然后各加入2mL水,振荡后静置,试管底部有粉末,溶液呈无色.
步骤二:向两支试管中再各滴入2滴酚酞溶液,振荡后静置,溶液由无色变为红色,试管底部粉末无明显变化.
步骤三:继续向其中一支试管中加入2mL水,振荡后静置,无明显变化;向另一支试管中加入2mL稀盐酸,振荡后静置,溶液由红色变为无色,试管底部的粉末消失.
下列说法正确的是( )
步骤一:向两支试管中分别加入0.2g Ca(OH)2粉末,然后各加入2mL水,振荡后静置,试管底部有粉末,溶液呈无色.
步骤二:向两支试管中再各滴入2滴酚酞溶液,振荡后静置,溶液由无色变为红色,试管底部粉末无明显变化.
步骤三:继续向其中一支试管中加入2mL水,振荡后静置,无明显变化;向另一支试管中加入2mL稀盐酸,振荡后静置,溶液由红色变为无色,试管底部的粉末消失.
下列说法正确的是( )
- A. 步骤一说明常温下Ca(OH)2不溶于水
- B. 步骤二中溶液变红是因为Ca(OH)2在水溶液中解离出Ca2+
- C. 步骤三中消失的Ca(OH)2固体溶解在稀盐酸所含的水中
- D. 步骤三中溶液由红色变为无色的原因是Ca(OH)2+2HCl═CaCl2+2H2O
13.“十四五”期间,我国将独立完成“天宫二号”空间实验室建造。
①氢气目前还不能在生活和生产中大规模使用的原因之一是 (填字母)。
a.制取成本高
b.产物无污染
c.燃烧热值高
②为使煤油充分燃烧,一是要有足够的氧气,二是 。
(2)长期驻留空间实验室会导致航天员肌肉萎缩、骨钙丢失。通过航天食品摄取优质蛋白质补充钙元素有利于维持航天员的身体健康。
①下列航天食品中富含蛋白质的是 (填字母)。
a.脱水米饭
b.鱼香肉丝
c.冻干水果
②可在航天食品中添加 (填字母)来补钙。
a.C12H22O14Ca
b.FeC6H6O7
c.KIO3
(3)舱段建造使用的新型铝基碳化硅复合材料是由颗粒状的铝和碳化硅(SiC)复合而成。
①铝在空气中具有很好的抗腐蚀性能,原因是 。
②制取SiC的反应为SiO2+3C
SiC+2CO↑。关于该反应说法正确的是 (填字母)。
a.SiO2是由Si原子和O2分子构成
b.反应前后元素的化合价均未发生变化
c.反应后固体减少的质量等于生成的CO质量
①氢气目前还不能在生活和生产中大规模使用的原因之一是 (填字母)。
a.制取成本高
b.产物无污染
c.燃烧热值高
②为使煤油充分燃烧,一是要有足够的氧气,二是 。
(2)长期驻留空间实验室会导致航天员肌肉萎缩、骨钙丢失。通过航天食品摄取优质蛋白质补充钙元素有利于维持航天员的身体健康。
①下列航天食品中富含蛋白质的是 (填字母)。
a.脱水米饭
b.鱼香肉丝
c.冻干水果
②可在航天食品中添加 (填字母)来补钙。
a.C12H22O14Ca
b.FeC6H6O7
c.KIO3
(3)舱段建造使用的新型铝基碳化硅复合材料是由颗粒状的铝和碳化硅(SiC)复合而成。
①铝在空气中具有很好的抗腐蚀性能,原因是 。
②制取SiC的反应为SiO2+3C
| 高温 |
a.SiO2是由Si原子和O2分子构成
b.反应前后元素的化合价均未发生变化
c.反应后固体减少的质量等于生成的CO质量
14.过氧乙酸(CH3COOOH)作为一种消毒剂,在新冠防疫中发挥了重要作用。
(1)组成:下列关于过氧乙酸的说法,正确的是 (填字母)。
a.属于有机物
b.H、O原子个数比为2:1
c.碳元素的质量分数最大
(2)变化:过氧乙酸不稳定,能分解为乙酸(CH3COOH)和氧气。写出该反应的化学方程式: 。
(3)制备:实验室中用如图1所示装置制备过氧乙酸,反应原理为CH3COOH+H2O2
CH3COOOH+H2O。

①浓硫酸的作用是 。
②该反应须控制在40℃左右进行,可用 对三颈烧瓶进行加热。
(4)拓展:除过氧乙酸外,NaClO等含氯消毒剂也可有效灭活新冠病毒。利用如图2所示装置电解饱和NaCl溶液可制取少量NaClO消毒液。电解过程中,a极区生成Cl2,b极区生成气体单质M和NaOH。
①气体M具有可燃性,其化学式为 。
②Cl2与NaOH反应生成NaClO、NaCl和H2O,该反应的化学方程式为 。
(1)组成:下列关于过氧乙酸的说法,正确的是 (填字母)。
a.属于有机物
b.H、O原子个数比为2:1
c.碳元素的质量分数最大
(2)变化:过氧乙酸不稳定,能分解为乙酸(CH3COOH)和氧气。写出该反应的化学方程式: 。
(3)制备:实验室中用如图1所示装置制备过氧乙酸,反应原理为CH3COOH+H2O2
| 浓硫酸 |
| △ |

①浓硫酸的作用是 。
②该反应须控制在40℃左右进行,可用 对三颈烧瓶进行加热。
(4)拓展:除过氧乙酸外,NaClO等含氯消毒剂也可有效灭活新冠病毒。利用如图2所示装置电解饱和NaCl溶液可制取少量NaClO消毒液。电解过程中,a极区生成Cl2,b极区生成气体单质M和NaOH。
①气体M具有可燃性,其化学式为 。
②Cl2与NaOH反应生成NaClO、NaCl和H2O,该反应的化学方程式为 。
15.在钢铁工业推进碳减排、碳捕集的过程中,化学发挥了重要作用。
(1)“焦炭炼钢”是先将铁精矿(Fe2O3)和焦炭同时加入高炉,鼓入热空气,充分反应后得到生铁,再将生铁转移至炼钢炉中炼制得钢。
①高炉炼铁的主要反应原理是在高温下, 夺取了Fe2O3里的氧将铁还原出来。
②某钢铁厂每年需要向高炉中加入120万吨的焦炭,若加入的焦炭全部转化为CO2,则该钢铁厂每年排放CO2的质量为 万吨。
(2)为了实现CO2的捕集利用,我国研制出一种多功能复合催化剂(含NaFe3O4),能将CO2转化为汽油,转化步骤如下:
CO2
CO
(CH2)n
汽油
①步骤Ⅰ除生成CO外,还生成另一种氧化物。该氧化物的化学式是 。
②下列说法错误的是 (填字母)。
a.所得汽油中含有C、H两种元素
b.NaFe3O4中O为﹣2价,Fe为+3价
c.上述转化不仅有利于CO2减排,还可以减轻人类对化石能源的需求
(3)一种以“氢能炼钢”替代“焦炭炼钢”的工艺流程如图所示。
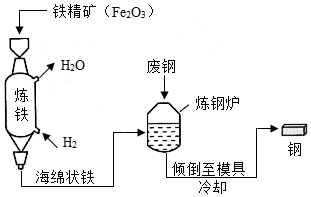
①高温下,用H2炼铁时反应的化学方程式为 。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有 。
③从物质组成的角度,说明向炼钢炉中加入废钢的目的: 。
(1)“焦炭炼钢”是先将铁精矿(Fe2O3)和焦炭同时加入高炉,鼓入热空气,充分反应后得到生铁,再将生铁转移至炼钢炉中炼制得钢。
①高炉炼铁的主要反应原理是在高温下, 夺取了Fe2O3里的氧将铁还原出来。
②某钢铁厂每年需要向高炉中加入120万吨的焦炭,若加入的焦炭全部转化为CO2,则该钢铁厂每年排放CO2的质量为 万吨。
(2)为了实现CO2的捕集利用,我国研制出一种多功能复合催化剂(含NaFe3O4),能将CO2转化为汽油,转化步骤如下:
CO2
H2 |
| 步骤Ⅰ |
H2 |
| 步骤Ⅱ |
| 步骤Ⅲ |
①步骤Ⅰ除生成CO外,还生成另一种氧化物。该氧化物的化学式是 。
②下列说法错误的是 (填字母)。
a.所得汽油中含有C、H两种元素
b.NaFe3O4中O为﹣2价,Fe为+3价
c.上述转化不仅有利于CO2减排,还可以减轻人类对化石能源的需求
(3)一种以“氢能炼钢”替代“焦炭炼钢”的工艺流程如图所示。

①高温下,用H2炼铁时反应的化学方程式为 。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有 。
③从物质组成的角度,说明向炼钢炉中加入废钢的目的: 。
16.碳酸氢钠是一种应用广泛的盐,化学小组对其进行了探究。
(1)NaHCO3可称为钠盐或碳酸氢盐,它是由Na+和 (填离子符号)构成,医疗上能用于治疗胃酸(含有盐酸)过多症,反应的化学方程式为 。
【提出问题】实验室中如何制取少量NaHCO3?
【查阅资料】
材料一:侯氏制碱的原理:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O。
材料二:研究发现,NaHCO3溶于水时吸收热量,Na2CO3溶于水时放出热量。
【实验制备】根据侯氏制碱原理设计如图1所示装置制取NaHCO3。
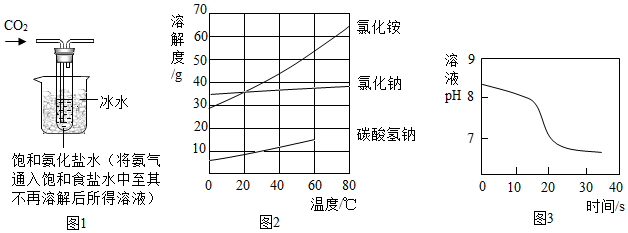
反应结束后,将试管中的混合物过滤洗涤,低温烘干得白色固体。
(2)烧杯中冰水的作用是 。
(3)能进一步确认该白色固体是NaHCO3的实验方案是 (须用到的仪器和药品:试管、温度计、水)。
(4)如图2中碳酸氢钠的溶解度在60℃后无数据的原因可能是 。
【性质探究】
常温下,取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图3所示。
【查阅资料】
材料三NaHCO3溶于水后,少量的HCO3﹣能同时发生如下变化:
变化①:HCO3﹣+H2O→H2CO3+OH﹣;
变化②:HCO3﹣→CO32﹣+H+。
材料四:溶液的酸碱性与溶液中H+和OH﹣数目的相对大小有关。常温下,当单位体积溶液中OH﹣的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液显 (填“酸”“碱”或“中”)性,结合材料三、四从微观角度说明原因: 。
(6)根据本实验,下列说法错误的是 (填字母)。
a.pH<6.68时生成的无色气体为CO2
b.从0~30s,单位体积溶液中H+数目不断增大
c.不能用CaCl2溶液鉴别Na2CO3和NaHCO3溶液
(1)NaHCO3可称为钠盐或碳酸氢盐,它是由Na+和 (填离子符号)构成,医疗上能用于治疗胃酸(含有盐酸)过多症,反应的化学方程式为 。
【提出问题】实验室中如何制取少量NaHCO3?
【查阅资料】
材料一:侯氏制碱的原理:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3
| △ |
材料二:研究发现,NaHCO3溶于水时吸收热量,Na2CO3溶于水时放出热量。
【实验制备】根据侯氏制碱原理设计如图1所示装置制取NaHCO3。

反应结束后,将试管中的混合物过滤洗涤,低温烘干得白色固体。
(2)烧杯中冰水的作用是 。
(3)能进一步确认该白色固体是NaHCO3的实验方案是 (须用到的仪器和药品:试管、温度计、水)。
(4)如图2中碳酸氢钠的溶解度在60℃后无数据的原因可能是 。
【性质探究】
常温下,取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图3所示。
【查阅资料】
材料三NaHCO3溶于水后,少量的HCO3﹣能同时发生如下变化:
变化①:HCO3﹣+H2O→H2CO3+OH﹣;
变化②:HCO3﹣→CO32﹣+H+。
材料四:溶液的酸碱性与溶液中H+和OH﹣数目的相对大小有关。常温下,当单位体积溶液中OH﹣的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液显 (填“酸”“碱”或“中”)性,结合材料三、四从微观角度说明原因: 。
(6)根据本实验,下列说法错误的是 (填字母)。
a.pH<6.68时生成的无色气体为CO2
b.从0~30s,单位体积溶液中H+数目不断增大
c.不能用CaCl2溶液鉴别Na2CO3和NaHCO3溶液
查看全部题目