下载高清试卷
【2020-2021学年上海市杨浦区民办兰生复旦中学九年级(上)期中化学试卷】-第1页
试卷格式:2020-2021学年上海市杨浦区民办兰生复旦中学九年级(上)期中化学试卷.PDF
试卷热词:最新试卷、2021年、上海试卷、杨浦区试卷、化学试卷、九年级上学期试卷、期中试卷、初中试卷

扫码查看解析
试卷题目
1.下列变化属于化学变化的是( )
- A. 树根“变”根雕
- B. 玉石“变”印章
- C. 水果“变”果汁
- D. 葡萄“变”美酒
2.常州博物馆启用了“真空充氮杀虫灭菌消毒机”来处理和保护文物。即将文物置于该机器内,三天后氮气浓度可达99.99%;再密闭三天左右,好氧菌、厌氧菌和丝状霉菌都被杀灭。下列有关氮气说法错误的是( )
- A. 氮气还能用于灯泡填充气
- B. 通常情况下氮气的化学性质很活泼
- C. 氮气不能供给呼吸
- D. 高浓度氮气可抑制菌类的生长
3.上海市垃圾分类实行的“四分类”标准,废荧光灯管属于( )
- A.

- B.

- C.

- D.

4.以下变化中,氧元素由化合态全部变为游离态都是( )
- A. 分离液态空气制取氧气
- B. 铁丝燃烧
- C. 电解水
- D. 双氧水制取氧气
5.根据分析证明:健康人的头发每克约含铁130mg、锌167~172mg、铝5mg、硼7mg等。这里的铁、锌、铝、硼是指( )
- A. 分子
- B. 原子
- C. 元素
- D. 单质
6.(多选)物质的俗名、化学式一致的是( )
- A. 水:H2O2
- B. 熟石灰:CaO
- C. 胆矾:CuSO4•5H2O
- D. 水银:Hg
7.下列选项符合图示从属关系的是( )
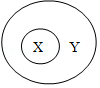
| A | B | C | D | |
| X | 金属 | 溶液 | 纯净物 | 化合反应 |
| Y | 单质 | 乳浊液 | 化合物 | 氧化反应 |

- A. A
- B. B
- C. C
- D. D
8.下列有关2molH2O2的解释正确的是( )
- A. 含有2molO2
- B. 与质量为36克水含有相同数量的氢原子
- C. 该物质的摩尔质量为68g/mol
- D. 共含有约1.204×1024个氧原子
9.下列物质放入水中能形成无色溶液的是( )
- A. 高锰酸钾
- B. 硝酸钾
- C. 碳酸钙
- D. 胆矾
10.计算一定质量的纯净物所含的微粒个数,下列量没有用处的是( )
- A. 微粒大小
- B. 微粒的质量
- C. 阿伏加德罗常数
- D. 摩尔质量
11.氮化硅(Si3N4)是一种高温陶瓷材料,硬度大、熔点高、化学性质稳定。有电子、军事和核工业等方面有着广泛的应用,若Si3N4中Si显+4价,则下列物质中的N的化合价与氮化硅中N的化合价相同的是( )
- A. NH3
- B. N2
- C. N2O3
- D. HNO3
12.氮化硅(Si3N4)是一种高温陶瓷材料,硬度大、熔点高、化学性质稳定。有电子、军事和核工业等方面有着广泛的应用,下列关于氮化硅(Si3N4)的说法正确的是( )
- A. 氯化硅是由三个硅原子与四个氧原子构成
- B. 1mol氮化硅的质量与10mol氮气质量相等
- C. 氮化硅中硅元素与氮元素的质量比为3:2
- D. 70克氮化硅中含有硅元素30克
13.氮化硅(Si3N4)是一种高温陶瓷材料,硬度大、熔点高、化学性质稳定。有电子、军事和核工业等方面有着广泛的应用,某生成氮化硅(Si3N4)反应的化学方程为:3SiCl4+4NH3═Si3N4+12HCl,下列说法不正确的是( )
- A. 该反应既不是化合反应,也不是分解反应
- B. 该反应中NH3与HCl物质的量之比为1:3
- C. 3克四氯化硅与4克氨气可以恰好完全反应
- D. 反应后生成物分子总个数比反应前增加了
14.推理是化学学习中常用的思维方法,下列推理正确的是( )
- A. 纯净物中往往只含有一种分子,则由同种分子构成的物质是纯净物
- B. 混合物中至少含有两种物质,则混合物中至少含有两种元素
- C. 化学变化伴随有能量变化,则有能量变化的变化一定是化学变化
- D. 均一稳定的混合物是溶液,水均一稳定,则水属于溶液
15.实验设计不合理的是( )
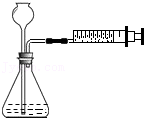 |  | 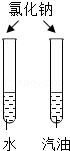 | 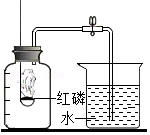 |
| A、检查装置气密性 | B、证明MnO2的催化作用 | C、探究同种物质在不同溶剂中的溶解性 | D、探究空气中氧气的体积分数 |
- A. A
- B. B
- C. C
- D. D
16.溶解度曲线是溶解度表示方法之一。曲线上任意一点表示的是( )
- A. 溶液达到饱和时溶解的溶质的质量
- B. 一定温度和一定质量的溶剂里溶解的溶质的质量
- C. 该温度时,100 g 溶剂里溶解的溶质的质量
- D. 该温度时,溶液处于饱和状态
17.加热氯酸钾和高锰酸钾混合物一段时间后,试管内剩余固体种类不可能是( )
- A. 5种
- B. 4种
- C. 3种
- D. 2种
18.下列实验现象的记录,正确的是( )
- A. 过氧化氢溶液和二氧化锰制氧气时产生大量气体,黑色固体逐渐消失
- B. 碳酸钙和稀盐酸反应时产生大量气泡,白色固体逐渐消失
- C. 向硫酸铜溶液中逐渐滴加氢氧化钠溶液,白色沉淀逐渐增加
- D. 向一定量的生石灰中加水,放出热量,产生大量白烟
19.将8.0g铜与碳的混合物在氧气中充分灼烧后,冷却,称量,发现反应后的固体质量仍为8.0g,则原混合物中铜的物质的量为( )
- A. 0.01mol
- B. 0.02mol
- C. 0.05mol
- D. 0.1mol
20.下列实验基本操作中正确的是( )
- A.
 吸取液体
吸取液体 - B.
 倾倒液体
倾倒液体 - C.
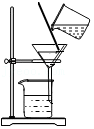 过滤
过滤 - D.
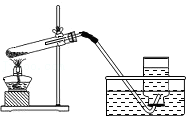 实验室制氧气
实验室制氧气
21.打开一瓶盐汽水,有大量二氧化碳气体逸出,相关分析正确的是( )
- A. 盐汽水中只有二氧化碳一种溶质,逸出后剩余汽水中不含二氧化碳
- B. 打开汽水瓶,因为温度升高,二氧化碳溶解度变小导致气体逸出
- C. 打开汽水瓶盖,因为瓶内气压减小,导致气体逸出,形成当时条件下二氧化碳的不饱和溶液
- D. 该盐汽水打开瞬间,是当时条件下二氧化碳的饱和溶液,氯化钠的不饱和溶液
22.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如表所示。表中a、b、c、d分别表示相应物质的质量分数,下列数据正确的是( )
| 甲 | 乙 | 丙 | 丁 | |
| 反应前 | 70% | 14% | 6% | 10% |
| 反应中 | a | 7% | 18% | b |
| 反应后 | 54% | c | 30% | d |
- A. a=56%
- B. b=10%
- C. c=0
- D. d=10%
23.40℃时,甲、乙物质饱和溶液降温至20℃时,对此过程判断一定正确的是( )
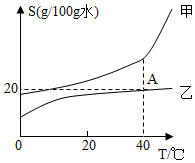

- A. 现象:有析出晶体,甲溶液析出固体质量>乙溶液析出固体质量
- B. 溶解度:溶解度都变小,20℃时S甲=S乙
- C. 溶液状态:都为饱和溶液,甲溶质的质量分数>乙溶质的质量分数
- D. 溶剂变化:溶剂的质量不变,甲溶液中溶剂质量>乙溶液中溶剂质量
24.常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌。如图横坐标x表示N物质的质量,纵坐标y表示烧杯中的某物理量(见表)。下列实验与图象对应关系合理的是( )
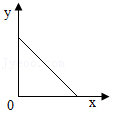
| M | N(x) | y | |
| A | 水 | 氧化钙 | 溶质的质量 |
| B | 水 | 氢氧化钠 | 溶液的温度 |
| C | 饱和石灰水 | 氧化钙 | 溶液中溶质的质量 |
| D | 饱和硫酸铜溶液 | 胆矾 | 溶液的质量 |

- A. A
- B. B
- C. C
- D. D
25.利用所学化学知识完成下列填空。写出下列操作所用的主要仪器或用品的名称:
(1)取少量二氧化锰倒入试管中 ;
(2)夹持点燃的镁条 ;
(3)量取5.6mL水 ;
(4)盛放稀硫酸的试剂瓶 ;
(5)粗盐提纯实验中每一步都要用到的玻璃仪器 。
(1)取少量二氧化锰倒入试管中 ;
(2)夹持点燃的镁条 ;
(3)量取5.6mL水 ;
(4)盛放稀硫酸的试剂瓶 ;
(5)粗盐提纯实验中每一步都要用到的玻璃仪器 。
26.用化学用语表示下列物质或微粒:
(1)60个碳原子 ;
(2)n个氮分子 ;
(3)硝酸 ;
(4)碳酸氢铵中氢元素显正一价 。
(1)60个碳原子 ;
(2)n个氮分子 ;
(3)硝酸 ;
(4)碳酸氢铵中氢元素显正一价 。
27.在学过的反应中选择合适的,写出符合下列条件的化学方程式:
(1)银白色固体反应后变成白色固体: 。
(2)银白色固体反应后变成黑色固体: 。
(3)液体颜色由紫色变成红色: 。
(4)液体颜色由红色变为无色: 。
(1)银白色固体反应后变成白色固体: 。
(2)银白色固体反应后变成黑色固体: 。
(3)液体颜色由紫色变成红色: 。
(4)液体颜色由红色变为无色: 。
28.用A代替“大于”,B代替“小于”,C代替“等于”,D代替“无法判断”,请分别选用“A”、“B”、“C”或“D”填空。
(1)沸点:在同温同压下,氧气 氮气;
(2)微粒直径大小:分子 原子;
(3)50mL酒精与150mL水充分混合:溶液的体积 200mL;
(4)碳元素的质量分数:葡萄糖(C6H12O6) 醋酸(C2H4O2)。
(1)沸点:在同温同压下,氧气 氮气;
(2)微粒直径大小:分子 原子;
(3)50mL酒精与150mL水充分混合:溶液的体积 200mL;
(4)碳元素的质量分数:葡萄糖(C6H12O6) 醋酸(C2H4O2)。
29.如图所示为电解水的实验装置图,请你根据图回答下列问题:
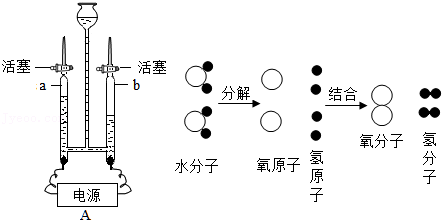
(1)图1中与电源负极相连的b管处产生的现象是: 。检验a管处产生的气体方法是 。该实验得出结论:水是由 组成的。
(2)根据图2,可以了解有关该变化过程的一个微观信息是 。
(3)理论上其中一个电极产生5mL气体时,另一个电极产生的气体体积可能是 ,该实验所得正极气体与负极气体的质量比是 ,说说你求出两种气体质量比的依据是 。
(4)由于氧气在水中的溶解性比氢气略大,所以电解刚开始时,正极收集到气体的体积与负极气体之比略 1:2(填大于、小于、等于),但是随着反应进行,收集到的正极气体与负极气体的体积比越来越接近1:2,可能是原因是 和 。
(5)水是重要的自然资源,与生活生产关系密切,生活中常用的直饮水,生产中采用“活性炭+超滤膜+紫外线”组合工艺,其中活性炭的作用是 ,紫外线相当于自来水生产中氯气或二氧化氯的作用,其作用是 。
(6)下列物质中,即不是溶液,也不是乳浊液是的 。(填序号)
A.医用酒精 B.油水混合物 C.石灰乳 D.纯净水

(1)图1中与电源负极相连的b管处产生的现象是: 。检验a管处产生的气体方法是 。该实验得出结论:水是由 组成的。
(2)根据图2,可以了解有关该变化过程的一个微观信息是 。
(3)理论上其中一个电极产生5mL气体时,另一个电极产生的气体体积可能是 ,该实验所得正极气体与负极气体的质量比是 ,说说你求出两种气体质量比的依据是 。
(4)由于氧气在水中的溶解性比氢气略大,所以电解刚开始时,正极收集到气体的体积与负极气体之比略 1:2(填大于、小于、等于),但是随着反应进行,收集到的正极气体与负极气体的体积比越来越接近1:2,可能是原因是 和 。
(5)水是重要的自然资源,与生活生产关系密切,生活中常用的直饮水,生产中采用“活性炭+超滤膜+紫外线”组合工艺,其中活性炭的作用是 ,紫外线相当于自来水生产中氯气或二氧化氯的作用,其作用是 。
(6)下列物质中,即不是溶液,也不是乳浊液是的 。(填序号)
A.医用酒精 B.油水混合物 C.石灰乳 D.纯净水
30.如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请回答下列问题。
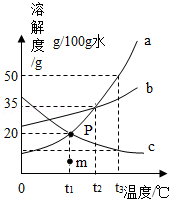
(1)图P点的含义为 。
(2)t2℃时,23克c的饱和溶液中含有3克c,则此时c的溶解度是 。
(3)t2℃时,将等质量的a、b、c三种物质的饱和溶液分别降温到t1℃时,所得溶液中各项关系符合b>a>c的是 。(填序号)
A.溶解度 B.溶剂质量 C.溶液质量 D.溶质的质量分数
(4)三种物质的饱和溶液的溶质质量分数关系为b>a≥c时的温度为t,则t的取值范围是 。
(5)t1℃时,a、b、c溶液的溶质质量分数相等均为x%,其中一定是不饱和溶液的是 ,x%的取值范围是 。
(6)t2℃时,向两只分别盛有20克a和20克c固体的烧杯中,各加入100g水,充分溶解后,能形成不饱和溶液的物质是 ,其不饱和溶液的质量为 克。
(7)采用一种操作方法,将上述(6)中某个烧杯内的剩余固体全部溶解,变为不饱和溶液,下列说法正确的是 。(填写序号)
A.可降低温度到t1℃B.可以恒温加溶剂50克 C.以恒温蒸发10克水 D.不断升高温度
(8)若需由一份150克a物质与12克c物质形成的混合物中提纯a,应采用 结晶法,具体操作是向混合物中加入 克t3℃的热水,使样品完全溶解后,再蒸发去 克水后冷却到t1℃时过滤,此时得到最多的纯净物a物质。

(1)图P点的含义为 。
(2)t2℃时,23克c的饱和溶液中含有3克c,则此时c的溶解度是 。
(3)t2℃时,将等质量的a、b、c三种物质的饱和溶液分别降温到t1℃时,所得溶液中各项关系符合b>a>c的是 。(填序号)
A.溶解度 B.溶剂质量 C.溶液质量 D.溶质的质量分数
(4)三种物质的饱和溶液的溶质质量分数关系为b>a≥c时的温度为t,则t的取值范围是 。
(5)t1℃时,a、b、c溶液的溶质质量分数相等均为x%,其中一定是不饱和溶液的是 ,x%的取值范围是 。
(6)t2℃时,向两只分别盛有20克a和20克c固体的烧杯中,各加入100g水,充分溶解后,能形成不饱和溶液的物质是 ,其不饱和溶液的质量为 克。
(7)采用一种操作方法,将上述(6)中某个烧杯内的剩余固体全部溶解,变为不饱和溶液,下列说法正确的是 。(填写序号)
A.可降低温度到t1℃B.可以恒温加溶剂50克 C.以恒温蒸发10克水 D.不断升高温度
(8)若需由一份150克a物质与12克c物质形成的混合物中提纯a,应采用 结晶法,具体操作是向混合物中加入 克t3℃的热水,使样品完全溶解后,再蒸发去 克水后冷却到t1℃时过滤,此时得到最多的纯净物a物质。
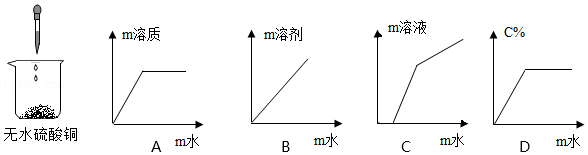
31.向如图所示的烧杯中逐滴加水,各种量的变化所加水的质量变化正确的是 。(填序号)

32.向装有一定量饱和石灰水的烧杯中加入少量生石灰,请在如图绘制溶液质量与溶液中溶质质量分数随时间变化的曲线: 、 ,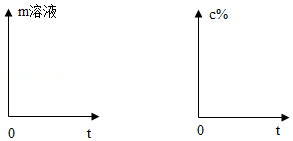

33.如图是A物质(不含结晶水)的溶解度曲线,N点表示t3℃时A物质的 (填“饱和”或“不饱和”)溶液。
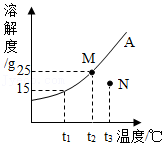

34.如图甲、乙、丙、丁是M、N两点代表的溶液相互转化的途径路线图。(用→表示转化方向)

其中,采用“先将N点溶液降温至M点对应的温度后,然后再加入 ”,这一措施来实现甲图中N→M转化的途径,请在乙、丙、丁中任寻一个,写出实现M→N转化的措施。选择序号: ,对应措施 。

其中,采用“先将N点溶液降温至M点对应的温度后,然后再加入 ”,这一措施来实现甲图中N→M转化的途径,请在乙、丙、丁中任寻一个,写出实现M→N转化的措施。选择序号: ,对应措施 。
35.某同学用如图1装置对质量守恒定律进行验证,反应前称出装置连药品总质量,然后将气球内大量大理石倒入锥形瓶中与稀盐酸充分反应后,再称量:
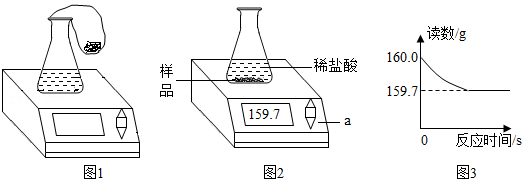
(1)观察到的现象有 ,天平示数无明显改变,粗略验证了质量守恒定律。
(2)由质量守恒定律可知,化学反应前后,一定改变的是 ,可能改变的是 。(填序号)。
①原子种类 ②物质种类 ③分子种类 ④元素种类 ⑤原子数目 ⑥物质总质量 ⑦分子数目 ⑧各元素化合价
该同学将锥形瓶口气球取下后,利用该装置测定大理石纯度,称量10.0g样品放入50.0g的锥形瓶中,再加入过量的稀盐酸100g(如图2)立即开始记录读数(如图3)。
回答下列问题:
(3)反应生成二氧化碳的物质的量是 mol。
(4)大理石样品中碳酸钙的质量分数是多少?(保留0.01)根据化学方程式计算。
(5)反应后锥形瓶中剩余溶液质量为 克。
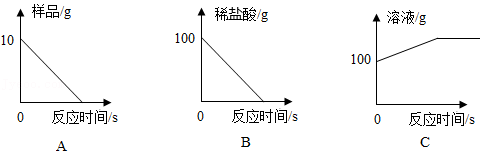
(6)根据锥形瓶中的反应绘制的下列图象正确的是 。(填序号)
(7)若实验中逸出的气体质量比理论值偏多,可能的原因是 。
(8)若实验中逸出的气体质量比理论值偏少,可能的原因是 。

(1)观察到的现象有 ,天平示数无明显改变,粗略验证了质量守恒定律。
(2)由质量守恒定律可知,化学反应前后,一定改变的是 ,可能改变的是 。(填序号)。
①原子种类 ②物质种类 ③分子种类 ④元素种类 ⑤原子数目 ⑥物质总质量 ⑦分子数目 ⑧各元素化合价
该同学将锥形瓶口气球取下后,利用该装置测定大理石纯度,称量10.0g样品放入50.0g的锥形瓶中,再加入过量的稀盐酸100g(如图2)立即开始记录读数(如图3)。
回答下列问题:
(3)反应生成二氧化碳的物质的量是 mol。
(4)大理石样品中碳酸钙的质量分数是多少?(保留0.01)根据化学方程式计算。
(5)反应后锥形瓶中剩余溶液质量为 克。
(6)根据锥形瓶中的反应绘制的下列图象正确的是 。(填序号)

(7)若实验中逸出的气体质量比理论值偏多,可能的原因是 。
(8)若实验中逸出的气体质量比理论值偏少,可能的原因是 。
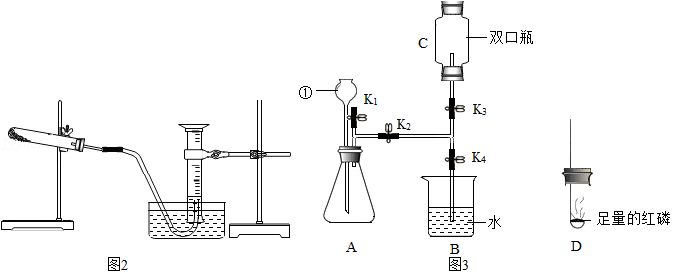
36.实验室利用如图1装置制取氧气,并检验氧气的性质。
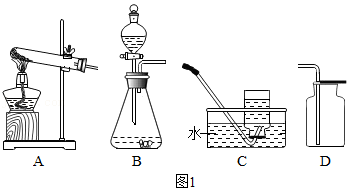
(1)如果用氯酸钾制取较纯净的氧气时,制取装置应该选择的仪器是 (填序号),反应的化学方程式为 。
(2)利用上述装置制取氧气时,判断是否收集满的方法是 。
(3)某研究性学习小组利用所学知识进行了下列实验研究。利用某氯酸钾样品(杂质不参与反应)分解制取氧气,并测定氯酸钾的质量分数,实验结束时如图2所示(导管出口高于液面)。
①测量收集到气体体积必须包括的几个步骤:
a.调整量筒内外液面高度使之相同;
b.使试管和量筒的气体都冷却到室温;
c.读取量筒内气体的体积。
这三步操作的正确顺序是 (填写步骤代号)。
②测量收集到的气体体积时,应使量筒内外液面相平,如图所示液面位置,使量筒内外液面高度相同的方法是 。
③本实验过程中,将导管放入装满水的量筒的时机为 。
a.加热前,还没有气泡产生时
b.加热一会儿,气泡连续均匀产生时
c.加热后,移开酒精灯时
(4)如果用过氧化氢分解制取氧气,反应的化学方程式为 。B瓶中锥形瓶放入的固体的作用是 ,B装置中使用分液漏斗不使用长颈漏斗的原因是 。C的收集方法称为 法,适合于收集 的气体。
(5)如图3装置,连接好仪器,用于制取氧气以及验证氧气的性质(双口瓶上下部开口)。
①检查好装置气密性良好后,打开弹簧夹K2、K3,关闭K1、K4,用C装置收集的气体的方法是 (填选项字母)。
a.排水法 b.向下排空气法 c.向上排空气法
②检验C中收集满气体的方法是 。
③C中收集满氧气后,打开弹簧夹K1、K4,关闭K2、K3,点燃D中燃烧匙内的过量的红磷后,立即伸入C装置中并把塞子塞紧,观察到红磷燃烧的现象是 ,待红磷熄灭,C装置冷却后,打开K3观察到的现象是 。
④写出燃烧匙中的反应方程式 ,其中打开K1的目的是 。

(1)如果用氯酸钾制取较纯净的氧气时,制取装置应该选择的仪器是 (填序号),反应的化学方程式为 。
(2)利用上述装置制取氧气时,判断是否收集满的方法是 。
(3)某研究性学习小组利用所学知识进行了下列实验研究。利用某氯酸钾样品(杂质不参与反应)分解制取氧气,并测定氯酸钾的质量分数,实验结束时如图2所示(导管出口高于液面)。

①测量收集到气体体积必须包括的几个步骤:
a.调整量筒内外液面高度使之相同;
b.使试管和量筒的气体都冷却到室温;
c.读取量筒内气体的体积。
这三步操作的正确顺序是 (填写步骤代号)。
②测量收集到的气体体积时,应使量筒内外液面相平,如图所示液面位置,使量筒内外液面高度相同的方法是 。
③本实验过程中,将导管放入装满水的量筒的时机为 。
a.加热前,还没有气泡产生时
b.加热一会儿,气泡连续均匀产生时
c.加热后,移开酒精灯时
(4)如果用过氧化氢分解制取氧气,反应的化学方程式为 。B瓶中锥形瓶放入的固体的作用是 ,B装置中使用分液漏斗不使用长颈漏斗的原因是 。C的收集方法称为 法,适合于收集 的气体。
(5)如图3装置,连接好仪器,用于制取氧气以及验证氧气的性质(双口瓶上下部开口)。
①检查好装置气密性良好后,打开弹簧夹K2、K3,关闭K1、K4,用C装置收集的气体的方法是 (填选项字母)。
a.排水法 b.向下排空气法 c.向上排空气法
②检验C中收集满气体的方法是 。
③C中收集满氧气后,打开弹簧夹K1、K4,关闭K2、K3,点燃D中燃烧匙内的过量的红磷后,立即伸入C装置中并把塞子塞紧,观察到红磷燃烧的现象是 ,待红磷熄灭,C装置冷却后,打开K3观察到的现象是 。
④写出燃烧匙中的反应方程式 ,其中打开K1的目的是 。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解