下载高清试卷
【2020-2021学年上海市徐汇区九年级(上)期中化学试卷】-第1页
试卷格式:2020-2021学年上海市徐汇区九年级(上)期中化学试卷.PDF
试卷热词:最新试卷、2021年、上海试卷、徐汇区试卷、化学试卷、九年级上学期试卷、期中试卷、初中试卷

扫码查看解析
试卷题目
1.1个铅(Pb)原子质量是34.419×10﹣26kg,一个碳﹣12原子质量是1.993×10﹣26kg,则铅原子的相对原子质量是( )
- A. 68.6
- B. 207.2
- C. 413.0
- D. 823.2
2.下列物质的化学式书写正确的是( )
- A. 五氧化二氮﹣﹣NO
- B. 氧化铁﹣﹣FeO
- C. 硫酸钠﹣﹣Na2SO4
- D. 氯化镁﹣﹣MgCl
3.下列物质的用途,主要利用其物质化学性质的是( )
- A. 铜用于制作导线
- B. 干冰用于人工降雨
- C. 氧气用于医疗急救
- D. 活性炭用于冰箱除味剂
4.下列说法正确的是( )
- A. 物质的量就是摩尔
- B. 摩尔质量就是物质的质量
- C. 物质的量相同则构成物质的微粒个数相同
- D. 物质的量可以计量小颗粒物体的个数
5.下列变化中,氧元素由游离态变成化合态的是( )
- A. 木炭在氧气中燃烧
- B. 工业上分离空气制氧气
- C. 氯酸钾和二氧化锰混合加热
- D. 电解水
6.下列变化中,属于化学变化的是( )
- A.

- B.
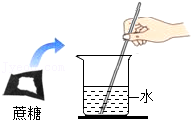
- C.

- D.
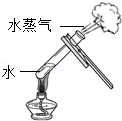
7.氨气(NH3)是没有颜色、有刺激性气味的气体,密度比空气小,极易溶于水。下列是实验室收集气体的几种装置,为防止污染环境,你认为最合理装置是( )
- A.
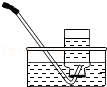
- B.

- C.
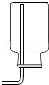
- D.
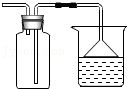
8.三种不同的原子如图,下列由分子构成的物质中属于单质的( )
- A.
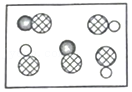
- B.

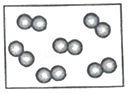
- C.
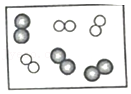
- D.
9.某物质中只含有一种元素,则该物质( )
- A. 一定是单质
- B. 一定是混合物
- C. 一定是纯净物
- D. 一定不是化合物
10.关于原子、分子叙述错误的是( )
- A. 分子都是由原子构成的
- B. 分子和原子都在不停运动
- C. 分子和原子在化学变化中都能够再分
- D. 分子和原子都是构成物质的微粒
11.从分子、原子角度对下面一些现象和变化的解释,合理的是( )
- A. 花香四溢 分子很小,质量也很小
- B. 热胀冷缩 温度变化,分子或原子大小发生变化
- C. 滴水成冰 温度降低,分子间隔变小,停止运动
- D. 食品变质 分子发生变化,分子性质发生变化
12.下图实验操作中正确的是( )
- A.
 吸取液体药品
吸取液体药品 - B.
 量取液体的读数
量取液体的读数 - C.
 固体药品的取用
固体药品的取用 - D.
 熄灭酒精灯
熄灭酒精灯
13.规范的操作是实验成功的前提,实验操作正确的是( )
- A. 蒸发操作时,蒸发皿必须放在石棉网上,用酒精灯外焰加热
- B. 取少量液体试剂时,滴管伸入试剂瓶内液体中,挤压胶头吸液
- C. 用试管夹夹持试管给液体加热时,需要移动试管,以防受热不均匀液体冲出
- D. 实验结束后,剩余的试剂都应放回原试剂瓶
14.下列说法正确的是( )
- A. 过氧化氢中含有氧气,加热时就可以放出氧气
- B. 木炭在氧气中燃烧现象是:发出白光,生成二氧化碳
- C. 工业上制氧气的原理是利用了空气中各组分的沸点不同
- D. 氧气易溶于水,故鱼虾能在水中生存
15.利用如图装置验证了空气中氧气的含量。下列叙述不正确的是( )
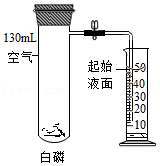

- A. 实验前需检查装置气密性
- B. 白磷的作用是消耗试管中的氧气
- C. 白磷熄灭、试管冷却后再打开止水夹
- D. 最终量筒中液面约降至40mL刻度线处
16.如图所示,关于电解水实验叙述错误的是( )
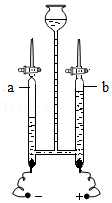

- A. 管a中的气体是氢气
- B. 管b中的气体能使燃着的木条燃烧得更旺
- C. 电解水的实验证明水是由氢氧两种元素组成的
- D. 电解水生成的氢气与氧气的质量比是 2:1
17.莽草酸是生产“达菲”的关键原料,其化学式为C7H10O5,下列叙述正确的是( )
- A. 1个莽草酸分子中含有22个原子
- B. 莽草酸分子是由碳、氢、氧三种元素组成
- C. 氧元素质量分数最小
- D. 莽草酸中碳、氢、氧三种元素的质量比为7:10:5
18.比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推理不合理的是( )
| 序号 | 化学反应事实 | 影响化学反应的因素 |
| A | 铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧 | 反应物浓度 |
| B | 碳在常温下不与氧气发生反应,而在点燃时能与氧气反应 | 反应温度 |
| C | 过氧化氢在常温下缓慢分解,而在加入二氧化锰后迅速分解 | 催化剂 |
| D | 铝片在空气中很难燃烧,铝粉在空气中较易燃烧 | 反应物的种类 |
- A. A
- B. B
- C. C
- D. D
19.依据以下所知的某物质的一组数据,能计算出该物质摩尔质量的是( )
- A. 物质的量和体积
- B. 体积和质量
- C. 微粒个数和物质的量
- D. 一个分子的实际质量
20.不能证明物质X含有碳、氢、氧三种元素的是( )
- A. X加热分解产生碳和水
- B. X在氧气中燃烧生成二氧化碳和水
- C. 乙烯(C2H4)和水在催化剂作用下只生成X
- D. 1molX 与 3mol氧气恰好完全反应生成3mol水和2mol二氧化碳
21.(多选)关于化学变化的说法,正确的是( )
- A. 分子不一定发生变化
- B. 原子一定不发生变化
- C. 元素的种类一定发生变化
- D. 元素的化合价可能发生变化
22.(多选)相对原子质量是以碳原子(碳﹣12)质量的
为标准,若改为一个原子质量的
为标准计算相对原子质量,不会发生改变的是( )
| 1 |
| 12 |
| 1 |
| 24 |
- A. 氧原子的相对原子质量
- B. 二氧化碳的式量
- C. 6.02×1023个H2分子的质量
- D. 水中氢氧元素的质量比
23.(多选)对于相同质量的二氧化硫和三氧化硫来说,下列关系正确的是( )
- A. 含氧原子的个数比为2:3
- B. 含硫元素的质量比是5:4
- C. 含氧元素的质量比为5:6
- D. 含硫原子的个数比为1:1
24.(多选)在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示。下列说法中正确的是( )


- A. 该反应为化合反应
- B. 丙一定为该反应的催化剂
- C. 该反应中,乙、丁的质量变化之比为8:1
- D. 该反应中,甲、乙的质量变化之比为2:7
25.工业中合成SO3的反应:2SO2+O2
2SO3.一定条件下,在一密闭容器内投入 SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为 g)如表所示。说法错误的是( )
| 加热 |
| 甲 | 乙 | 丙 | 丁 | |
| t1 | 100 | 5 | 80 | 5 |
| t2 | 60 | 55 | a | b |
| t3 | 40 | c | d | 5 |
- A. 丁物质一定是V2O5
- B. d=15
- C. 丙物质是O2
- D. t3时,生成乙75g
26.空气是宝贵的自然资源,如图以空气等为原料合成尿素[CO(NH2)2]的流程(部分产物略去)。请按要求回答相关问题:
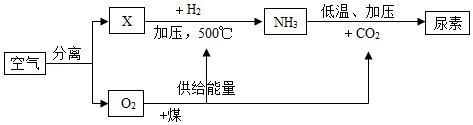
(1)分离空气的常用方法有以下两种。
Ⅰ.将液态空气气化,首先分离出X气体,则X的化学式是 。则沸点:X O2(选填“高于”、“等于”、“低于”),由图可知X可以在一定条件下转化成NH3,请用化学方程式表示其转化过程 。
Ⅱ.分子筛分离。分子筛是一种内部分布有均匀微小孔径的固体,通过特制的分子筛把空气中的氧分子吸入孔穴而与其它分子分离,则分子大小:X O2(选填“大于”、“等于”、“小于”)。
(2)尿素[CO(NH2)2]是目前使用量较大的一种化学氮肥。尿素中N元素的百分含量为 (精确到0.1%)。
(3)相同条件下气体体积之比等于分子数之比,则空气中氧气与氮气的体积比为
,则空气中氧气与氮气的质量比为 。
(4)结合流程和所学知识可以预测:化学反应中发生物质变化的同时一定还伴随有 变化(选填“状态”、“能量”、“原子”、“压强”)。

(1)分离空气的常用方法有以下两种。
Ⅰ.将液态空气气化,首先分离出X气体,则X的化学式是 。则沸点:X O2(选填“高于”、“等于”、“低于”),由图可知X可以在一定条件下转化成NH3,请用化学方程式表示其转化过程 。
Ⅱ.分子筛分离。分子筛是一种内部分布有均匀微小孔径的固体,通过特制的分子筛把空气中的氧分子吸入孔穴而与其它分子分离,则分子大小:X O2(选填“大于”、“等于”、“小于”)。
(2)尿素[CO(NH2)2]是目前使用量较大的一种化学氮肥。尿素中N元素的百分含量为 (精确到0.1%)。
(3)相同条件下气体体积之比等于分子数之比,则空气中氧气与氮气的体积比为
| 1 |
| 4 |
(4)结合流程和所学知识可以预测:化学反应中发生物质变化的同时一定还伴随有 变化(选填“状态”、“能量”、“原子”、“压强”)。
27.生活与化学密切相关,生活中处处有化学,请你根据所学化学知识回答下列问题:
(1)生活中用生石灰(CaO)做干燥剂的理由是 (用化学方程式表示)。
(2)硫酸铜晶体(化学式为CuSO4•5H2O)可用作纺织品媒染剂、农业杀虫剂。硫酸铜晶体的摩尔质量是 。25g硫酸铜晶体的物质的量是 ,含铜原子 个。
(1)生活中用生石灰(CaO)做干燥剂的理由是 (用化学方程式表示)。
(2)硫酸铜晶体(化学式为CuSO4•5H2O)可用作纺织品媒染剂、农业杀虫剂。硫酸铜晶体的摩尔质量是 。25g硫酸铜晶体的物质的量是 ,含铜原子 个。
28.对比归纳是学习化学的重要方法。请你参与下列探究活动并回答问题:
实验一:探究影响硫燃烧剧烈程度的因素。
实验二:铁丝在氧气中反应
实验一:探究影响硫燃烧剧烈程度的因素。
 | 如图,分别将硫在空气和氧气中燃烧。 (1)硫在氧气里燃烧的现象是 ,化学方程式为 ;(2)硫在氧气里燃烧比在空气里燃烧更剧烈,说明了影响硫燃烧剧烈程度的因素是 。 |
实验二:铁丝在氧气中反应
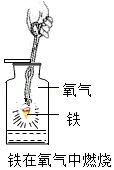 | (3)做铁丝在氧气中燃烧的实验时,集气瓶里,放入少量的水的作用是 ;(4)如果实验中不见铁丝燃烧,从铁丝的角度分析导致失败的原因可能是 ,应对实验做相对应的改进为 ;(5)改进后,试验成功了。可以观察到的现象是 ,放出大量的热,生成一种 色的固体,化学方程式为 。 |
29.化学是一门以实验为基础的科学,请结合图示回答问题:

(1)图中①仪器的名称是 。
(2)实验室用氯酸钾和二氧化锰的固体混合物制取氧气,反应的化学方程式为 ,应选择的发生装置 (填字母,下同),若要收集比较纯净的氧气可选择的装置是 ,现有0.1mol氯酸钾和二氧化锰混合,加热一段时间后,剩余固体中氯元素的质量为3.55g,判断氯酸钾分解程度是 。
A.完全分解
B.部分分解
C.没有分解
D.无法确定
(3)检查装置A的气密性的方法是 ;看到 现象,说明气密性良好。
(4)实验室用双氧水和二氧化锰制取氧气,反应的化学方程式为 ;若选用D装置收集氧气,气体应从 端(填a或b)进入。

(1)图中①仪器的名称是 。
(2)实验室用氯酸钾和二氧化锰的固体混合物制取氧气,反应的化学方程式为 ,应选择的发生装置 (填字母,下同),若要收集比较纯净的氧气可选择的装置是 ,现有0.1mol氯酸钾和二氧化锰混合,加热一段时间后,剩余固体中氯元素的质量为3.55g,判断氯酸钾分解程度是 。
A.完全分解
B.部分分解
C.没有分解
D.无法确定
(3)检查装置A的气密性的方法是 ;看到 现象,说明气密性良好。
(4)实验室用双氧水和二氧化锰制取氧气,反应的化学方程式为 ;若选用D装置收集氧气,气体应从 端(填a或b)进入。
30.科学家开采得到一种“可燃冰”样品,取95.6克样品放置在密闭容器内,该样品迅速转化为甲烷气体(CH4)和水,将甲烷气体分离并完全燃烧(反应的化学方程式为:CH4+2O2
CO2+2H2O),得到35.2克二氧化碳,试计算:
(1)35.2克二氧化碳的物质的量为 。
(2)根据化学方程式计算该天然气合物样品中甲烷的质量。
(3)样品中甲烷的质量分数。(计算结果精确到0.1%)
| 点燃 |
(1)35.2克二氧化碳的物质的量为 。
(2)根据化学方程式计算该天然气合物样品中甲烷的质量。
(3)样品中甲烷的质量分数。(计算结果精确到0.1%)
31.学习小组对碱式碳酸铜[化学式为Cu2(OH)2CO3]的性质进行探究,并进行相关实验。

①探究分解产物,装置如图一所示(省略夹持仪器):
(1) ;
(2)碱式碳酸铜受热分解的产物有CuO、CO2、 。
(3)B中反应的化学方程式为 。
(4)C中反应的化学方程式为 。
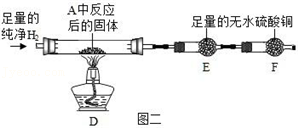
②用氢气还原装置A中反应后的固体并检验产物,装置如图二所示(F中的无水硫酸铜用于吸收空气中的水蒸气)。
查阅资料可得:H2+CuO
Cu+H2O;CuO是黑色的,Cu是红色固体。
Ⅰ.D中观察到固体变红
Ⅱ.实验开始时,先通入氢气,再点燃酒精灯
(5)Ⅲ.E中观察到白色固体变蓝,该现象能否证明氢气和氧化铜反应生成了水?理由是 ,F装置的作用是 。
③学习小组还利用图二装置定量测定水的组成(玻璃管中为纯净氧化铜),并测定了如表的四个数据(单位:g)。
(6)利用表格中数据,列式表示水中氢、氧原子的物质的量之比 (不要求化简)。

①探究分解产物,装置如图一所示(省略夹持仪器):
| 实验步骤 | 现象 | 分析和结论 |
| 1.组装装置,连接导管a、b,微热试管。 | (1)________。 | 说明整套装置不漏气。 |
| Ⅱ.加入药品和试剂,点燃酒精灯。 | A中固体出现黑色,B中白色固体变蓝,C中石灰水变浑浊。 | (2)碱式碳酸铜受热分解的产物有CuO、CO2、________。 (3)B中反应的化学方程式为 ________。 (4)C中反应的化学方程式为________。 |
(1) ;
(2)碱式碳酸铜受热分解的产物有CuO、CO2、 。
(3)B中反应的化学方程式为 。
(4)C中反应的化学方程式为 。
②用氢气还原装置A中反应后的固体并检验产物,装置如图二所示(F中的无水硫酸铜用于吸收空气中的水蒸气)。

查阅资料可得:H2+CuO
| △ |
Ⅰ.D中观察到固体变红
Ⅱ.实验开始时,先通入氢气,再点燃酒精灯
(5)Ⅲ.E中观察到白色固体变蓝,该现象能否证明氢气和氧化铜反应生成了水?理由是 ,F装置的作用是 。
③学习小组还利用图二装置定量测定水的组成(玻璃管中为纯净氧化铜),并测定了如表的四个数据(单位:g)。
| 反应前质量 | 反应后质量 | |
| 装置D | a | b |
| 装置E | c | d |
(6)利用表格中数据,列式表示水中氢、氧原子的物质的量之比 (不要求化简)。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解