下载高清试卷
【2020-2021学年天津市南开区九年级(上)期末化学试卷】-第1页
试卷格式:2020-2021学年天津市南开区九年级(上)期末化学试卷.PDF
试卷热词:最新试卷、2021年、天津试卷、南开区试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷

扫码查看解析
试卷题目
1.下列属于化学变化的是( )
- A. 干冰升华
- B. 胆矾研碎
- C. 空气液化
- D. 铁钉生锈
2.下列气体与空气混合后遇明火,可能发生爆炸的是( )
- A. 甲烷
- B. 氮气
- C. 氧气
- D. 二氧化碳
3.将少量下列物质分别放到水中,充分搅拌,不能得到溶液的是( )
- A. 蔗糖
- B. 氯化钠
- C. 面粉
- D. 高锰酸钾
4.某反应:MnO2+H2SO4+H2O2═MnSO4+O2↑+2X,则X的化学式是( )
- A. SO2
- B. H2
- C. H2O
- D. H2SO3
5.下列物质的分类中不正确的是( )
- A. 氧化物:干冰
- B. 单质:液氧
- C. 碱:碳酸钠
- D. 混合物:合金
6.如图所示的实验操作中,正确的是( )
- A.
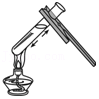 加热液体
加热液体 - B.
 滴加液体
滴加液体 - C.
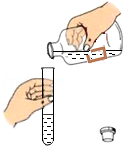 倾倒液体
倾倒液体 - D.
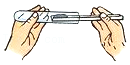 取用固体粉末
取用固体粉末
7.人体内含量最高的金属元素是( )
- A. 铁
- B. 锌
- C. 钾
- D. 钙
8.下列有关实验现象的描述正确的是( )
- A. 硫在空气中燃烧发出明亮的蓝紫色火焰
- B. 木炭在氧气中燃烧发出白光,生成黑色固体
- C. 铁丝伸入盛有氧气的集气瓶中剧烈燃烧,火星四射
- D. 将通入足量二氧化碳后的石蕊溶液加热,溶液由红色变为紫色
9.下列关于化学反应2X+Y═2Z的叙述,不正确的是( )
- A. Z一定是化合物
- B. 若ag X与bg Y充分反应,生成Z的质量可能为(a+b)g
- C. 若X和Y的相对分子质量分别为m和n,则Z的相对分子质量为(m+n)
- D. 在反应中X、Y、Z三种物质的粒子数目比为2:1:2
10.由两种元素组成的某合金6g与足量的稀硫酸充分反应后,生成0.2g氢气。下列说法不合理的是( )
- A. 合金中的元素可能是Fe和Cu
- B. 所得溶液中的溶质可能是硫酸镁、硫酸铝和硫酸
- C. 合金中的元素可能是Zn和Fe
- D. 所得溶液中的溶质可能是硫酸镁和硫酸
11.下列有关说法正确的是( )
- A. 通常铝制品很耐腐蚀,是因为铝的化学性质不活泼
- B. 钢的性能优良,所以钢是很纯的铁
- C. 洗涤剂能洗掉餐具上的油污,因为洗涤剂能溶解油污形成溶液
- D. 化学反应伴随着能量变化,燃料燃烧时一定放出热量
12.(多选)为了验证Fe、Ag、Cu三种金属的活动性顺序,下列选用的药品可行的是( )
- A. 硫酸亚铁溶液、铜、银
- B. 硫酸铜溶液、铁、银
- C. 银、铜、铁、盐酸
- D. 铜、硫酸亚铁溶液、硝酸银溶液
13.(多选)下列实验方案正确的是( )
- A. 用水鉴别氯化钠、氢氧化钠和硝酸铵三种固体
- B. 用稀盐酸鉴别铁粉、木炭粉末
- C. 用蒸发的方法除去氯化钠溶液中混有的少量泥沙
- D. 用点燃的方法除去二氧化碳中混有的少量一氧化碳
14.(多选)工业用盐中含有的亚硝酸钠(NaNO2)是一种有毒物质,利用氯化铵溶液可使亚硝酸钠转化为无毒物质。该反应分两步进行:
①NaNO2+NH4Cl═NaCl+NH4NO2;
②NH4NO2═N2↑+2H2O。
下列叙述正确的是( )
①NaNO2+NH4Cl═NaCl+NH4NO2;
②NH4NO2═N2↑+2H2O。
下列叙述正确的是( )
- A. 反应①为置换反应,反应②为分解反应
- B. 利用氯化铵溶液处理亚硝酸钠最终转化为氯化钠、氮气和水
- C. 上述反应所涉及的物质中,氮元素的化合价有三种
- D. 若转化69g亚硝酸钠可产生14g氮气
15.将一定质量的甲醇与4.4g氧气混合于密闭容器内,在一定条件下,发生如下反应:8CH3OH+xO2
mCO2+nCO+16H2O,当反应物完全耗尽且全部转化为生成物时,有3.6g水生成。下列说法正确的是( )
| 一定条件 |
- A. 2m+n的和为8
- B. x的值为12
- C. 反应中生成二氧化碳的质量为3.3g
- D. 若将1.1g碳与4.4g氧气混合于另一密闭容器内,充分反应后容器中的气体为二氧化碳
16.化学与我们的生活有着密切的联系。现有①活性炭②二氧化碳③金刚石④二氧化硫,选择适当的物质填空(填序号)。
(1)可用来裁玻璃的是 。
(2)绿色植物进行光合作用吸收的是 。
(3)能导致酸雨的气体是 。
(4)可用于冰箱除味剂的是 。
(1)可用来裁玻璃的是 。
(2)绿色植物进行光合作用吸收的是 。
(3)能导致酸雨的气体是 。
(4)可用于冰箱除味剂的是 。
17.在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
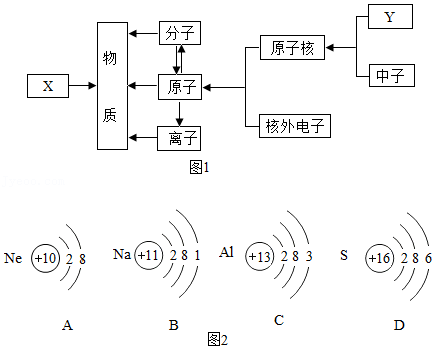
(1)如图1所示,X是 ;Y是 。
(2)从宏观角度看,汞由 组成;从微观角度看,汞由 构成。
(3)根据原子结构示意图2,回答有关问题。
①图2中具有相对稳定结构的原子是 (填字母序号)。
②在某金属单质与硫单质反应过程中,硫原子得到2个电子形成硫离子。下列说法正确的是 (填字母序号)。
A、硫离子属于阳离子
B、与金属单质Al可生成Al3S2
C、硫离子的质子数与核外电子数相等
D、“S”既可以表示1个硫原子,也可以表示硫元素
(4)按要求写出相应物质的化学式:
①写出一种常见的酸 。
②写出一种含三种元素的可溶性盐 。
③写出一种难溶性盐 。
④写出一种难溶性碱 。

(1)如图1所示,X是 ;Y是 。
(2)从宏观角度看,汞由 组成;从微观角度看,汞由 构成。
(3)根据原子结构示意图2,回答有关问题。
①图2中具有相对稳定结构的原子是 (填字母序号)。
②在某金属单质与硫单质反应过程中,硫原子得到2个电子形成硫离子。下列说法正确的是 (填字母序号)。
A、硫离子属于阳离子
B、与金属单质Al可生成Al3S2
C、硫离子的质子数与核外电子数相等
D、“S”既可以表示1个硫原子,也可以表示硫元素
(4)按要求写出相应物质的化学式:
①写出一种常见的酸 。
②写出一种含三种元素的可溶性盐 。
③写出一种难溶性盐 。
④写出一种难溶性碱 。
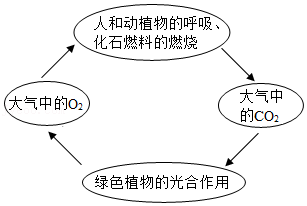
18.化学就在我们身边,请用所学化学知识回答下列问题。
(1)碳海绵是已知最轻的固体材料,由碳元素组成,具有多孔结构,弹性好,可处理海上石油泄漏,碳海绵具有很强的 性。
(2)用学科观点分析碳循环,其中正确的是 (填字母序号)。
A、变化观:每个人都在参与碳循环
B、守恒观:碳循环过程中各元素守恒,且化合价不变
C、平衡观:碳循环有利于维持大气中氧气和二氧化碳含量的相对稳定
D、微粒观:绿色植物的作用是使自然界中的氧原子总数增加
(3)二氧化碳是一种宝贵的资源。固定和利用二氧化碳的一个成功范例是:在高温高压下,CO2和NH3可以合成尿素[CO(NH2)2],同时生成水。该反应的化学方程式为 。
(4)取一定质量的碳酸钙,高温加热一段时间后,得到氧化钙和碳酸钙的固体混合物,其中碳、氧元素质量比为3:14,则该固体混合物中氧化钙和碳酸钙的质量比为 。
(1)碳海绵是已知最轻的固体材料,由碳元素组成,具有多孔结构,弹性好,可处理海上石油泄漏,碳海绵具有很强的 性。
(2)用学科观点分析碳循环,其中正确的是 (填字母序号)。
A、变化观:每个人都在参与碳循环
B、守恒观:碳循环过程中各元素守恒,且化合价不变
C、平衡观:碳循环有利于维持大气中氧气和二氧化碳含量的相对稳定
D、微粒观:绿色植物的作用是使自然界中的氧原子总数增加
(3)二氧化碳是一种宝贵的资源。固定和利用二氧化碳的一个成功范例是:在高温高压下,CO2和NH3可以合成尿素[CO(NH2)2],同时生成水。该反应的化学方程式为 。
(4)取一定质量的碳酸钙,高温加热一段时间后,得到氧化钙和碳酸钙的固体混合物,其中碳、氧元素质量比为3:14,则该固体混合物中氧化钙和碳酸钙的质量比为 。

19.写出下列反应的化学方程式:
(1)碳不充分燃烧 。
(2)锌与稀硫酸反应 。
(3)氢氧化钠溶液与硫酸铜溶液反应 。
(1)碳不充分燃烧 。
(2)锌与稀硫酸反应 。
(3)氢氧化钠溶液与硫酸铜溶液反应 。
20.X、Y、Z是中学化学常见的物质,它们之间有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去)。

(1)甲图中,若X、Y的组成元素完全相同,Z为气体单质。Y转化为Z的化学方程式为 。
(2)甲图中,若Y、Z的组成元素完全相同,X为固体单质。Z转化为Y时反应吸热,则该反应的化学方程式为 。
(3)乙图中,若三种物质中均含有氧元素;Y为难溶于水的白色固体,Z转化为Y的化学方程式为 。

(1)甲图中,若X、Y的组成元素完全相同,Z为气体单质。Y转化为Z的化学方程式为 。
(2)甲图中,若Y、Z的组成元素完全相同,X为固体单质。Z转化为Y时反应吸热,则该反应的化学方程式为 。
(3)乙图中,若三种物质中均含有氧元素;Y为难溶于水的白色固体,Z转化为Y的化学方程式为 。
21.如表是甲和乙在不同温度时的溶解度,根据此表回答:
(1)从表中数据可以看出,两种物质的溶解度受温度影响变化较大的是 。
(2)在30℃时,100g水中加入50g甲,充分搅拌后得到的溶液质量为 g。
(3)现有40℃时,甲、乙两种物质的饱和溶液各100g,将这两种溶液分别降温到20℃,所得溶液中溶质的质量甲 乙(填“>”“<”或“=”)。
(4)某同学取甲、乙中的一种物质,按图示进行实验。下列有关说法不正确的是 (填字母序号)。

A、烧杯中加入的是乙
B、w的值可能为50
C、②、④烧杯中溶液的溶质质量分数一定相等
D、③、④烧杯中溶液的溶质质量相等
(5)气体的溶解度也有一定的变化规律。打开汽水瓶盖时,汽水会自动喷出来。说明压强越小,CO2的溶解度越 。
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | |
| 溶解度/g | 甲 | 30 | 33 | 35 | 38 | 41 |
| 乙 | 21 | 31 | 45 | 65 | 88 | |
(1)从表中数据可以看出,两种物质的溶解度受温度影响变化较大的是 。
(2)在30℃时,100g水中加入50g甲,充分搅拌后得到的溶液质量为 g。
(3)现有40℃时,甲、乙两种物质的饱和溶液各100g,将这两种溶液分别降温到20℃,所得溶液中溶质的质量甲 乙(填“>”“<”或“=”)。
(4)某同学取甲、乙中的一种物质,按图示进行实验。下列有关说法不正确的是 (填字母序号)。

A、烧杯中加入的是乙
B、w的值可能为50
C、②、④烧杯中溶液的溶质质量分数一定相等
D、③、④烧杯中溶液的溶质质量相等
(5)气体的溶解度也有一定的变化规律。打开汽水瓶盖时,汽水会自动喷出来。说明压强越小,CO2的溶解度越 。
22.我区某校同学利用图示装置进行实验,请据图回答问题。
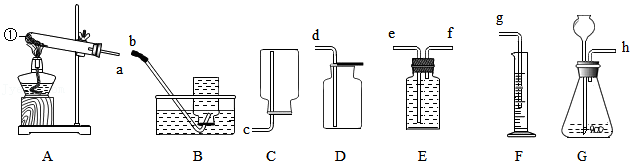
(1)写出仪器①的名称 。
(2)甲同学用加热氯酸钾和二氧化锰混合物的方法制取并通过排水量来测定所收集到氧气的体积,整套实验装置接口的正确连接顺序为a→ → →g,反应的化学方程式为 。
(3)实验室用大理石和稀盐酸制取并收集二氧化碳,应选用的装置为 (填大写字母序号),反应的化学方程式为 。

(1)写出仪器①的名称 。
(2)甲同学用加热氯酸钾和二氧化锰混合物的方法制取并通过排水量来测定所收集到氧气的体积,整套实验装置接口的正确连接顺序为a→ → →g,反应的化学方程式为 。
(3)实验室用大理石和稀盐酸制取并收集二氧化碳,应选用的装置为 (填大写字母序号),反应的化学方程式为 。
23.化学实验室常需配制一定溶质质量分数的溶液。
(1)实验室配制溶液有如下步骤:(已知20℃时氯化钾的溶解度是34g)
①计算:20℃时,将67g的氯化钾饱和溶液稀释为20%,需加水 mL。
②量取:用量筒量取水倒入烧杯中,提供的量筒规格有10mL、20mL、50mL,应该选择 mL的量筒。
③混匀:用搅拌,使溶液混合均匀。
(2)根据如图溶解度曲线及所学知识,判断下列说法正确的是 。
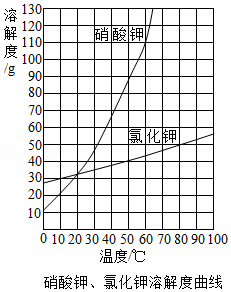
A.已知40℃时,硝酸钾的溶解度是64g,表示100g硝酸钾饱和溶液中含64g硝酸钾
B.温度越高,配制成的氢氧化钙饱和溶液浓度越大
C.硝酸钾中混有少量氯化钾,可用冷却热饱和溶液的方法提纯
D.60℃时,将等质量的硝酸钾、氯化钾两种物质分别配制成饱和溶液,硝酸钾需要水的质量大于氯化钾
(1)实验室配制溶液有如下步骤:(已知20℃时氯化钾的溶解度是34g)
①计算:20℃时,将67g的氯化钾饱和溶液稀释为20%,需加水 mL。
②量取:用量筒量取水倒入烧杯中,提供的量筒规格有10mL、20mL、50mL,应该选择 mL的量筒。
③混匀:用搅拌,使溶液混合均匀。
(2)根据如图溶解度曲线及所学知识,判断下列说法正确的是 。

A.已知40℃时,硝酸钾的溶解度是64g,表示100g硝酸钾饱和溶液中含64g硝酸钾
B.温度越高,配制成的氢氧化钙饱和溶液浓度越大
C.硝酸钾中混有少量氯化钾,可用冷却热饱和溶液的方法提纯
D.60℃时,将等质量的硝酸钾、氯化钾两种物质分别配制成饱和溶液,硝酸钾需要水的质量大于氯化钾
24.金属在生产生活中有广泛应用。
(1)汽车电路中的导线一般为铜芯线,这是利用了金属铜的延展性和 性。
(2)将铜锌合金与铜片相互刻画,在铜片表面留下明显划痕,说明铜锌合金的硬度 铜的硬度(填“大于”或“小于”)。
(3)铁粉可作食品脱氧剂,其保鲜原理与铁生锈相同,铁生锈的条件是与 接触。
(4)向一定量的硝酸银、硝酸铝和硝酸铜的混合溶液中加入一定量的锌,溶液质量与加入锌的质量关系如图所示。

①A点所发生反应的化学方程式为 。
②B点对应的溶液中含有的溶质为 (填化学式)。
③当加入锌的质量为m3g时,过滤后,得到的固体中含有 (填化学式)。
(5)一氧化碳具有还原性,常用于冶炼金属。某同学取20g氧化铁粉末与一氧化碳反应一段时间后,称量剩余固体的质量为15.2g,则该反应中生成的CO2的质量为 g。
(1)汽车电路中的导线一般为铜芯线,这是利用了金属铜的延展性和 性。
(2)将铜锌合金与铜片相互刻画,在铜片表面留下明显划痕,说明铜锌合金的硬度 铜的硬度(填“大于”或“小于”)。
(3)铁粉可作食品脱氧剂,其保鲜原理与铁生锈相同,铁生锈的条件是与 接触。
(4)向一定量的硝酸银、硝酸铝和硝酸铜的混合溶液中加入一定量的锌,溶液质量与加入锌的质量关系如图所示。

①A点所发生反应的化学方程式为 。
②B点对应的溶液中含有的溶质为 (填化学式)。
③当加入锌的质量为m3g时,过滤后,得到的固体中含有 (填化学式)。
(5)一氧化碳具有还原性,常用于冶炼金属。某同学取20g氧化铁粉末与一氧化碳反应一段时间后,称量剩余固体的质量为15.2g,则该反应中生成的CO2的质量为 g。
25.乙醇(化学式为C2H5OH)俗称酒精,可以用于消毒。按要求计算:
(1)乙醇分子中C、H原子个数比为 (填最简整数比)。
(2)乙醇的相对分子质量为 。
(3)9.2g乙醇中碳元素的质量为 g。
(1)乙醇分子中C、H原子个数比为 (填最简整数比)。
(2)乙醇的相对分子质量为 。
(3)9.2g乙醇中碳元素的质量为 g。
26.某碳酸钠样品中含有氯化钠及不溶性杂质(不溶于水,也不参加反应),现取10g该样品加入73g稀盐酸,恰好完全反应,收集到2.2g的气体(假设生成的气体全部逸出),过滤得1g不溶物。计算:
(1)所用盐酸的质量分数;
(2)反应后得到的不饱和溶液中溶质的质量分数(计算结果精确到0.1%)。
(1)所用盐酸的质量分数;
(2)反应后得到的不饱和溶液中溶质的质量分数(计算结果精确到0.1%)。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解