下载高清试卷
【2019年江苏省扬州市中考化学试卷】-第1页
试卷格式:2019年江苏省扬州市中考化学试卷.PDF
试卷热词:最新试卷、2019年、江苏试卷、扬州市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.6月5日为世界环境日。下列行为有利于保护环境的是( )
- A. 绿色低碳出行

- B. 大量使用农药
- C. 露天焚烧垃圾
- D. 乱扔废旧电池
2.下列过程涉及化学变化的是( )
- A. 干冰升华
- B. 氧气液化
- C. 氢气燃烧
- D. 矿石粉碎
3.下列物质的俗名与化学式对应关系正确的是( )
- A. 干冰:O2

- B. 纯碱:CaCO3

- C. 食盐:NaCl

- D. 烧碱:Na2SO4
4.下列金属中,金属活动性最强的是( )
- A. 钾

- B. 铁

- C. 铜

- D. 金
5.下列物质由分子构成的是( )
- A. 金刚石
- B. 铁
- C. 氯化钠
- D. 氧气
6.下列溶液显碱性的是( )
- A. 酸雨
- B. 食醋
- C. NaOH溶液
- D. 盐酸
7.水是人类不可缺少的宝贵资源。我国的"节水标志"是( )
- A.

- B.

- C.

- D.

8.下列物质能为人们生命活动提供所需能量的是( )
- A. N2
- B. CO2
- C. 淀粉
- D. 氯化钠
9.配制50g溶质质量分数为15%的氯化钠溶液,不需要用到的仪器是( )
- A. 集气瓶
- B. 烧杯
- C. 玻璃棒
- D. 量筒
10.2KI+H2SO4+O3=O2+M+K2SO4+H2O中M的化学式是( )
- A. H2
- B. KOH
- C. HI
- D. I2
11.下列属于复合肥的是( )
- A. NH4NO3
- B. KNO3
- C. K2SO4
- D. NaNO3
12.下列反应属于分解反应的是( )
- A. 2H2+O2 2H2O
点燃 
- B. Zn+H2SO4=ZnSO4+H2↑
- C. 2KClO3 2KCl+3O2↑
MnO2 △ 
- D. KOH+HCl=KCl+H2O
13.维生素D2的化学式为C28H44O,下列关于维生素D2的说法正确的是( )
- A. 碳元素的质量分数最大
- B. 含有3个原子
- C. 相对分子质量是73g
- D. H、O元素质量比为44:1
14.下列实验方案能达到目的是( )
- A. 用稀盐酸和BaCl2溶液检验Na2SO4溶液中是否含有H2SO4
- B. 用肥皂水鉴别蒸馏水与CaCl2溶液
- C. 用足量NaOH溶液除去CO2气体中的少量HCl
- D. 用澄清石灰水检验Na2CO3溶液中是否含有K2CO3
15.下列有关物质性质与用途对应关系正确的是( )
- A. CO2能与水反应,可用于灭火
- B. 铜有金属光泽,可用于制造电线
- C. 常温下N2很稳定,可用作粮食保护气
- D. 石墨具有导电性,可用于生产铅笔芯
16.某反应前后分子变化的微观示意图如图。下列说法正确的是( )
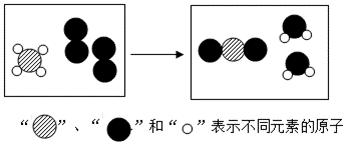

- A. 反应物中没有单质

- B. 图中共表示3种物质
- C. 反应后元素种类增多
- D. 反应前后原子个数不变
17.1800年,人类电解水获得成功。某同学利用如图所示装置进行该实验时,发现左、右两侧试管内气体体积比略大于2:1。下列说法错误的是( )

已知:①相同条件下,气体的体积比等于气体的分子个数比;
②常温常压时,1L水可溶解0.031L O2、0.57L O3。

已知:①相同条件下,气体的体积比等于气体的分子个数比;
②常温常压时,1L水可溶解0.031L O2、0.57L O3。
- A. 水在通电时能发生化合反应
- B. 实验中若加入少量NaOH溶液,则导电性增强
- C. 从实验结果可以确定,相同条件下,H2在水中的溶解度比O2的小
- D. 若右侧试管内产生少量O3 ,也会使左右两侧试管内气体体积比略大于2:1
18.(多选)工业上,利用溶液X(溶质为CuCl2和HCl)在50℃时与Cu反应制作电路。CuCl2消耗后,HCuCl2经处理又能转化为CuCl2,流程如图.下列说法错误的是( )

已知:①反应I CuCl2+Cu+2HCl=2HCuCl2
②反应Ⅱ2HCuCl2+H2O2=2CuCl2+2H2O

已知:①反应I CuCl2+Cu+2HCl=2HCuCl2
②反应Ⅱ2HCuCl2+H2O2=2CuCl2+2H2O
- A. 反应I和Ⅱ涉及的元素中仅Cu、O元素的化合价发生了变化
- B. 反应Ⅱ中生成的CuCl2质量与溶液X中CuCl2质量一定相同
- C. 工业上,每溶解6.4kgCu时,外界只需提供34kg10%的双氧水就能使生成的HCuCl2全部转化为CuCl2
- D. 若由Cu、CuCl、CuCl2中的若干种组成的10.66g混合物中,铜元素为6.4g,则该混合物中一定含CuCl2
19.(多选)实验室用KClO3和MnO2制O2 , 反应后分离KCl和MnO2(难溶于水)。下列图示装置能达到实验目的是( )
- A.
 用此装置制取O2
用此装置制取O2 - B.
 用此装置收集O2
用此装置收集O2 - C.
 用此装置过滤
用此装置过滤 - D.
 用此装置蒸发滤液
用此装置蒸发滤液
20.由氯化钡废液(杂质为FeCl3及微量NaCl)制备产品BaC12•2H2O的流程如图。

(1)氯化钡废液属于 (填“纯净物”或“混合物”)。FeCl3中铁元素的化合价是 。
(2)煅烧石灰石制取生石灰的化学方程式为 ,生石灰变成熟石灰的过程是 过程(填“吸热”或“放热”),石灰水能使紫色石蕊试液变 色。石灰石和熟石灰中常用于改良酸性土壤的是 。
(3)用95%乙醇(C2H6O)洗涤滤渣可除微量NaCl。C2H6O由 种元素组成,是 化合物(填“有机”或“无机”)。C2H6O在O2中完全燃烧生成CO2和 。2个CO2分子可用化学符号表示为 。煤、氢气、乙醇三种燃料中,最清洁的是 。
表:每次结晶时,温度对产品纯度和产率的影响
(4)结合流程和表回答:工业上选择25℃而不选择5℃进行冷却结晶的主要原因是①滤液多次循环后,25℃与5℃结晶产品的总产率基本相同;
② 。

(1)氯化钡废液属于 (填“纯净物”或“混合物”)。FeCl3中铁元素的化合价是 。
(2)煅烧石灰石制取生石灰的化学方程式为 ,生石灰变成熟石灰的过程是 过程(填“吸热”或“放热”),石灰水能使紫色石蕊试液变 色。石灰石和熟石灰中常用于改良酸性土壤的是 。
(3)用95%乙醇(C2H6O)洗涤滤渣可除微量NaCl。C2H6O由 种元素组成,是 化合物(填“有机”或“无机”)。C2H6O在O2中完全燃烧生成CO2和 。2个CO2分子可用化学符号表示为 。煤、氢气、乙醇三种燃料中,最清洁的是 。
表:每次结晶时,温度对产品纯度和产率的影响
| 冷却结晶的温度/℃ | 产品的纯度/% | 产品的产率/% |
| 5 | 99 | 72 |
| 25 | 99 | 60 |
(4)结合流程和表回答:工业上选择25℃而不选择5℃进行冷却结晶的主要原因是①滤液多次循环后,25℃与5℃结晶产品的总产率基本相同;
② 。
21.以MnO2为原料制备MnSO4•H2O的工业流程如图。

已知:①沉淀时的化学方程式为
7MnSO4+7Na2CO3+11H2O=MnCO3•6Mn(OH)2•5H2O↓+7Na2SO4+6CO2↑
②MnSO4•H2O和MnSO4•5H2O易溶于水,难溶于乙醇。
③MnSO4的溶解度曲线如图1所示。

(1)溶解时,为控制80℃,在实验室可用水浴加热如图2。水浴加热需要的玻璃仪器有酒精灯、 、 。水浴加热的优点有 。能加快溶解的方法有 (写一种)。
(2)除铁时需要搅拌,搅拌的作用是 。
(3)过滤I所得滤液的溶质主要是Na2SO4和 。过滤时,玻璃棒的作用是 。
(4)酸溶时,MnCO3•6Mn(OH)2•5H2O与足量稀硫酸反应的化学方程式为 。
(5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4•H2O的实验方案:将MnSO4溶液转移至蒸发皿中, ,在高于40℃时趁热过滤, ,100℃烘干得MnSO4•H2O。

已知:①沉淀时的化学方程式为
7MnSO4+7Na2CO3+11H2O=MnCO3•6Mn(OH)2•5H2O↓+7Na2SO4+6CO2↑
②MnSO4•H2O和MnSO4•5H2O易溶于水,难溶于乙醇。
③MnSO4的溶解度曲线如图1所示。

(1)溶解时,为控制80℃,在实验室可用水浴加热如图2。水浴加热需要的玻璃仪器有酒精灯、 、 。水浴加热的优点有 。能加快溶解的方法有 (写一种)。
(2)除铁时需要搅拌,搅拌的作用是 。
(3)过滤I所得滤液的溶质主要是Na2SO4和 。过滤时,玻璃棒的作用是 。
(4)酸溶时,MnCO3•6Mn(OH)2•5H2O与足量稀硫酸反应的化学方程式为 。
(5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4•H2O的实验方案:将MnSO4溶液转移至蒸发皿中, ,在高于40℃时趁热过滤, ,100℃烘干得MnSO4•H2O。
22.实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下。
溶解 向石灰石样品中加入适量盐酸,至反应完全。
除铁 加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀 向滤液中补充氨水,通入CO2,反应一段时间。
分离 过滤、洗涤、干燥得高纯CaCO3。
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为 、 。判断样品已完全反应的实验现象是 。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、 、 ;过滤所得滤渣的主要成分为 。
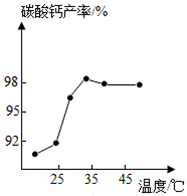
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是 、 。(已知:
×100%)
(4)分离时,若向过滤所得滤液中加入 (填化学式)并加热,则可回收NH3。
(5)该实验中可以循环利用的物质有H2O和 。
(6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石多少吨?(写出计算过程,保留一位小数。)
溶解 向石灰石样品中加入适量盐酸,至反应完全。
除铁 加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀 向滤液中补充氨水,通入CO2,反应一段时间。
分离 过滤、洗涤、干燥得高纯CaCO3。
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为 、 。判断样品已完全反应的实验现象是 。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、 、 ;过滤所得滤渣的主要成分为 。
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是 、 。(已知:
| 产品的实际质量 |
| 产品的理论质量 |
(4)分离时,若向过滤所得滤液中加入 (填化学式)并加热,则可回收NH3。
(5)该实验中可以循环利用的物质有H2O和 。
(6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石多少吨?(写出计算过程,保留一位小数。)

23.日常生活、社会发展都与化学密切相关。
(1)3D打印机根据不同需求,使用不同材料,如铝合金、聚乙烯、碳纤维增强复合材料。其中属于金属材料的是 ,属于合成材料的是 ,属于复合材料的是 。

(2)《本草纲目》记载,杨桃具有去风热、生津止渴等功效。
①杨桃的主要成分是水,还含有糖类和蛋白质等。葡萄糖和蛋白质中属于有机高分子化合物的是 ,能在人体内分解生成氨基酸的是 。葡萄糖由 三种元素组成。
②经测定酸杨桃的pH为1.35,甜杨桃的pH为1.81,其中酸性较强的是 。(填"酸杨桃"或"甜杨桃")
③酸杨桃中矿质元素含量如表2。人体缺少 元素易得佝偻病,缺少 元素易得贫血症。如表所列元素中,属于微量元素的是 、 。
表:每克酸杨桃中矿质元素的含量
(1)3D打印机根据不同需求,使用不同材料,如铝合金、聚乙烯、碳纤维增强复合材料。其中属于金属材料的是 ,属于合成材料的是 ,属于复合材料的是 。

(2)《本草纲目》记载,杨桃具有去风热、生津止渴等功效。
①杨桃的主要成分是水,还含有糖类和蛋白质等。葡萄糖和蛋白质中属于有机高分子化合物的是 ,能在人体内分解生成氨基酸的是 。葡萄糖由 三种元素组成。
②经测定酸杨桃的pH为1.35,甜杨桃的pH为1.81,其中酸性较强的是 。(填"酸杨桃"或"甜杨桃")
③酸杨桃中矿质元素含量如表2。人体缺少 元素易得佝偻病,缺少 元素易得贫血症。如表所列元素中,属于微量元素的是 、 。
表:每克酸杨桃中矿质元素的含量
| 矿质元素 | K | Ca | Zn | Fe |
| 含量/mg | 0.389 | 0.587 | 0.049 | 0.070 |
24.MgO在医药建筑等行业应用广泛。硫酸镁和木炭高温煅烧的产物为MgO(固体)、SO2、CO2、CO、硫蒸气。
(1)工业上,SO2的任意排放会引起的环境问题是 。化石燃料燃烧是产生SO2的主要原因,下列做法能减少SO2排放的是 (填字母)。
a.开发新能源替代化石燃料 b.向高空排放SO2
(2)在高温、催化剂条件下,CO和H2可化合成燃料甲醇(CH3OH),该反应中CO和H2的分子个数比为 。若CO和H2中混有H2S气体,H2S会与催化剂中的Cu在高温下发生置换反应,其中一种产物为CuS,该反应的化学方程式为 。
(3)利用如图装置对硫酸镁和木炭进行高温煅烧,并对产生的四种气体进行分步吸收或收集。
已知:常温下,硫为固体;SO2、CO2均能与NaOH溶液反应。

①装置B、C中的溶液分别是 、 。(填字母)
a、NaOH溶液
b、KMnO4溶液
②装置B、C的作用分别是 、 。
③装置D的作用是 。
④若将装置A中的固体隔绝空气加热至500℃,就会变成蒸气,其中有一种相对分子质量为128的气体。该气体的化学式为 。
(1)工业上,SO2的任意排放会引起的环境问题是 。化石燃料燃烧是产生SO2的主要原因,下列做法能减少SO2排放的是 (填字母)。
a.开发新能源替代化石燃料 b.向高空排放SO2
(2)在高温、催化剂条件下,CO和H2可化合成燃料甲醇(CH3OH),该反应中CO和H2的分子个数比为 。若CO和H2中混有H2S气体,H2S会与催化剂中的Cu在高温下发生置换反应,其中一种产物为CuS,该反应的化学方程式为 。
(3)利用如图装置对硫酸镁和木炭进行高温煅烧,并对产生的四种气体进行分步吸收或收集。
已知:常温下,硫为固体;SO2、CO2均能与NaOH溶液反应。

①装置B、C中的溶液分别是 、 。(填字母)
a、NaOH溶液
b、KMnO4溶液
②装置B、C的作用分别是 、 。
③装置D的作用是 。
④若将装置A中的固体隔绝空气加热至500℃,就会变成蒸气,其中有一种相对分子质量为128的气体。该气体的化学式为 。
查看全部题目