下载高清试卷
【2019年江苏省南通市中考化学试卷】-第4页
试卷格式:2019年江苏省南通市中考化学试卷.PDF
试卷热词:最新试卷、2019年、江苏试卷、南通市试卷、化学试卷、九年级试卷、中考试卷、初中试卷

扫码查看解析
试卷题目
1.2018年10月,南通被授予“国家森林城市”称号。为了使南通这座江风海韵森林城变得天更蓝、水更清、景更美,下列做法应该禁止的是( )
- A. 工业废水直接排入河流
- B. 加强对烟花爆竹燃放管理
- C. 生产生活垃圾分类放置
- D. 鼓励对旧金属回收再利用
2.乙烯(C2H4)是最重要的石油化工产品。乙烯属于( )
- A. 盐
- B. 碱
- C. 氧化物
- D. 有机物
3.下列实验操作正确的是( )
- A.
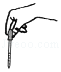 滴加试剂
滴加试剂 - B.
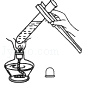 加热液体
加热液体 - C.
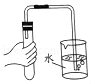 检查气密性
检查气密性 - D.
 闻气体气味
闻气体气味
4.下列说法正确的是( )
- A. 合金中一定不含有非金属元素
- B. 空气是由氮气、氧气两种气体组成的混合物
- C. 维生素是为人类机体活动提供能量的营养物质
- D. 金刚石和石墨是由碳元素组成的不同的单质
5.下列有关物质的性质与用途具有对应关系的是( )
- A. 铝具有导电性,可用于制饮具
- B. 活性炭具有吸附性,可用于净化水
- C. 盐酸具有挥发性,可用于除铁锈
- D. 浓硫酸具有腐蚀性,可用作干燥剂
6.氧气是生命活动的必需气体。下列关于氧气的性质、制备说法正确的是( )
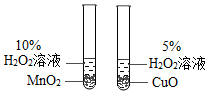

- A. 保持氧气化学性质的最小粒子是氧分子
- B. 可用向下排空气法或排水法收集氧气
- C. 铁丝在氧气中剧烈燃烧,生成Fe2O3
- D. 利用如图装置可比较MnO2和CuO对H2O2分解的影响
7.我国科学家屠呦呦因研制出青蒿素(C15H22O5)和双氢青蒿素(C15H24O5)而荣获了诺贝尔奖。下列说法正确的是( )
- A. 青蒿素和双氢青蒿素分子的构成一定不同
- B. C、H、O三种元素均为人体必需的微量元素
- C. 青蒿素中碳元素和氢元素的质量比为15:22
- D. 青蒿素与水发生化合反应可生成双氢青蒿素
8.KNO3、NaNO3、NaCl三种物质的溶解度曲线如图所示,下列说法正确的是( )
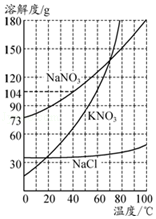

- A. KNO3的溶解度比NaCl大
- B. 将KNO3饱和溶液降温,溶液中KNO3的质量分数不变
- C. KNO3饱和溶液中含少量NaCl,可通过降温结晶的方法提纯
- D. 将100g 40℃的NaNO3饱和溶液降温至0℃,析出31g晶体
9.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 比较铜和银的金属活动性 | 将铜片和银片放入硫酸亚铁溶液中 |
| B | 鉴别甲烷和氢气 | 分别点燃从导管放出的气体,在火焰上方各罩一个内壁涂有澄清石灰水的烧杯 |
| C | 测定NaOH溶液的pH | 用玻璃棒蘸取溶液滴到湿润的pH试纸上,把试纸显示的颜色与标准比色卡对照 |
| D | 除去CO2中混有的HCl气体 | 将混合气体缓缓通过装有NaOH溶液的洗气瓶 |
- A. A
- B. B
- C. C
- D. D
10.称取mg CaC2O4•H2O(相对分子质量为146,其中氧元素的化合价为﹣2)置于氮气流中加热,残留固体质量随温度的变化如图所示(图中各点对应固体均为纯净物),其中A→B发生反应:CaC2O4•H2O
CaC2O4+H2O。下列说法正确的是( )

| △ |

- A. CaC2O4中碳元素的化合价为+2
- B. m=8.2
- C. C→D发生反应的化学方程式为CaC2O4CaCO3+CO↑
△ - D. F点对应固体的化学式为Ca(OH)2
11.2019年为“元素周期表年”,元素周期表是学习和研究化学的重要工具。
(1)原子序数为1~18的元素在元素周期表中的位置如下表所示(图1)。

①Al属于 (填“金属”或“非金属”)元素,其原子的核电荷数为 。
②Na原子的结构示意图为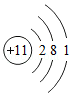 ,则钠离子的核外电子数为 。
,则钠离子的核外电子数为 。
③周期表中磷元素的有关信息为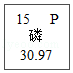 ,图中“30.97”所表示的含义是 。
,图中“30.97”所表示的含义是 。
(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价﹣物质类别”关系图(图2)。
①写出物质X的化学式: 。
②写出由物质Y转化为CuSO4的化学反应方程式: 。
(1)原子序数为1~18的元素在元素周期表中的位置如下表所示(图1)。

①Al属于 (填“金属”或“非金属”)元素,其原子的核电荷数为 。
②Na原子的结构示意图为
 ,则钠离子的核外电子数为 。
,则钠离子的核外电子数为 。③周期表中磷元素的有关信息为
 ,图中“30.97”所表示的含义是 。
,图中“30.97”所表示的含义是 。(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价﹣物质类别”关系图(图2)。
①写出物质X的化学式: 。
②写出由物质Y转化为CuSO4的化学反应方程式: 。
12.氧化镁在医药等行业应用广泛。实验室以菱镁矿(主要成分为MgCO3,含少量FeCO3等)为原料制备高纯氧化镁的实验流程如下:
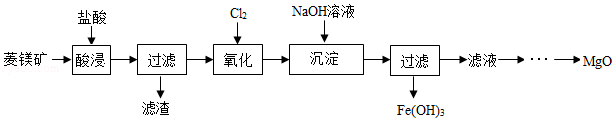
(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、 。MgCO3与盐酸反应的化学方程式为 。
(2)“氧化”过程中。FeCl2转化为FeCl3,该反应属于基本反应类型中的 。
(3)“沉淀”时需严格控制NaOH溶液的用量,其目的是 。
(4)“滤液”中的溶质主要是MgCl2和 。

(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、 。MgCO3与盐酸反应的化学方程式为 。
(2)“氧化”过程中。FeCl2转化为FeCl3,该反应属于基本反应类型中的 。
(3)“沉淀”时需严格控制NaOH溶液的用量,其目的是 。
(4)“滤液”中的溶质主要是MgCl2和 。
13.燃料的发现和利用提高了人类生活的质量,推动了人类文明的进步。
(1)将煤隔绝空气加强热,得到焦炭、煤气等,该过程属于 (填“物理”或“化学”)变化。煤与高温水蒸气反应生成CO和H2.在300℃、1.5MPa、催化剂存在的条件下,CO和H2可转变为液体燃料甲醇(CH3OH)。写出CO与H2反应成甲醇的化学方程式: 。
(2)焦炭(主要成分是碳)是高炉炼铁的重要原料。炼铁高炉内发生的主要化学反应如图1所示,其中反应②体现了焦炭的 性。
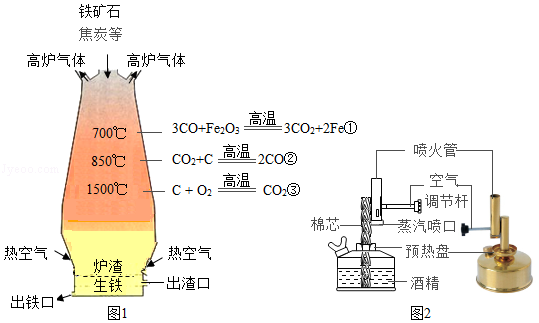
(3)乙醇可作为酒精灯、酒精喷灯的燃料。某铜质酒精喷灯的结构如图2所示。使用酒精喷灯时,先在预热盘中注入酒精并点燃,一段时间后,调节空气调节杆,即可点燃酒精喷灯。结合燃烧的条件回答:点燃预热盘中酒精的目的是 。
(4)氢气的制取和储存越来越受到人们的关注。
①最理想的制氢方法:在合适的催化剂作用下,利用太阳光使水分解。该制氢过程 (填“吸收”和“放出”)能量,生成的氢气与氧气在相同条件下的体积之比为 。
②我国稀土资源丰富,某种稀土储氢材料(用M表示)的储氢原理可表示为M+3H2
LaNi5H6.M的化学式为 。
(1)将煤隔绝空气加强热,得到焦炭、煤气等,该过程属于 (填“物理”或“化学”)变化。煤与高温水蒸气反应生成CO和H2.在300℃、1.5MPa、催化剂存在的条件下,CO和H2可转变为液体燃料甲醇(CH3OH)。写出CO与H2反应成甲醇的化学方程式: 。
(2)焦炭(主要成分是碳)是高炉炼铁的重要原料。炼铁高炉内发生的主要化学反应如图1所示,其中反应②体现了焦炭的 性。

(3)乙醇可作为酒精灯、酒精喷灯的燃料。某铜质酒精喷灯的结构如图2所示。使用酒精喷灯时,先在预热盘中注入酒精并点燃,一段时间后,调节空气调节杆,即可点燃酒精喷灯。结合燃烧的条件回答:点燃预热盘中酒精的目的是 。
(4)氢气的制取和储存越来越受到人们的关注。
①最理想的制氢方法:在合适的催化剂作用下,利用太阳光使水分解。该制氢过程 (填“吸收”和“放出”)能量,生成的氢气与氧气在相同条件下的体积之比为 。
②我国稀土资源丰富,某种稀土储氢材料(用M表示)的储氢原理可表示为M+3H2
| 1.5×105Pa |
14.我国海水晒盐的历史悠久。学习小组对粗盐进行提纯,并利用氯化钠进行实验探究。
Ⅰ.粗盐的提纯
粗盐中含有不溶性泥沙、可溶性CaCl2、MgCl2等杂质。学习小组设计了如下方案提纯粗盐: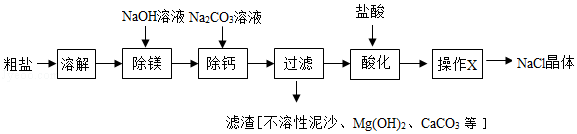
(1)用化学方程式表示Na2CO3溶液的作用: 。
(2)“过滤”中玻璃棒的作用为 ;“操作X”的名称为 。
Ⅱ.探究氨盐水与二氧化碳的反应
步骤1 取50mL浓氨水于锥形瓶中,加入NaCl晶体至不再溶解,制得氨盐水。
步骤2 向烧瓶中加入20mL氨盐水和约16g干冰,塞紧瓶盖,振荡、静置。一段时间后溶液中析出细小晶体,过滤、用冷水洗涤晶体并低温干燥。
【提出问题】晶体的成分是什么?
【实验探究1】①经甲同学检验,晶体中不含铵盐。甲同学的实验操作及现象是 。
②乙同学取晶体少许,加入稀硝酸,晶体溶解并产生无色气体,再滴加几滴AgNO3溶液,未见明显现象,说明晶体中不含有 离子。
【提出猜想】晶体的成分为Na2CO3或NaHCO3或两者的混合物。
【查阅资料】Na2CO3受热不分解;
NaHCO3受热易分解:2NaHCO3
Na2CO3+H2O+CO2↑。
【实验探究2】称取m1 g晶体,利用如图装置(夹持仪器略)探究晶体的成分。
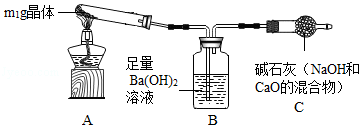
【实验现象】反应一段时间后,试管口凝结了少量小液滴,Ba(OH)2溶液变浑浊。
【实验分析】①晶体中一定含有 (填化学式)。
②将晶体加热至残留固体的质量不再改变,测得残留固体的质量为m2 g.若m1:m2= ,说明晶体为NaHCO3。
【拓展延伸】①氨盐水与二氧化碳反应所得铵盐的用途为 。
②丙同学认为通过测定装置B中沉淀的质量,经计算分析也可确定晶体的组成。请对丙同学的观点进行评价: 。
Ⅰ.粗盐的提纯
粗盐中含有不溶性泥沙、可溶性CaCl2、MgCl2等杂质。学习小组设计了如下方案提纯粗盐:

(1)用化学方程式表示Na2CO3溶液的作用: 。
(2)“过滤”中玻璃棒的作用为 ;“操作X”的名称为 。
Ⅱ.探究氨盐水与二氧化碳的反应
步骤1 取50mL浓氨水于锥形瓶中,加入NaCl晶体至不再溶解,制得氨盐水。
步骤2 向烧瓶中加入20mL氨盐水和约16g干冰,塞紧瓶盖,振荡、静置。一段时间后溶液中析出细小晶体,过滤、用冷水洗涤晶体并低温干燥。
【提出问题】晶体的成分是什么?
【实验探究1】①经甲同学检验,晶体中不含铵盐。甲同学的实验操作及现象是 。
②乙同学取晶体少许,加入稀硝酸,晶体溶解并产生无色气体,再滴加几滴AgNO3溶液,未见明显现象,说明晶体中不含有 离子。
【提出猜想】晶体的成分为Na2CO3或NaHCO3或两者的混合物。
【查阅资料】Na2CO3受热不分解;
NaHCO3受热易分解:2NaHCO3
| △ |
【实验探究2】称取m1 g晶体,利用如图装置(夹持仪器略)探究晶体的成分。

【实验现象】反应一段时间后,试管口凝结了少量小液滴,Ba(OH)2溶液变浑浊。
【实验分析】①晶体中一定含有 (填化学式)。
②将晶体加热至残留固体的质量不再改变,测得残留固体的质量为m2 g.若m1:m2= ,说明晶体为NaHCO3。
【拓展延伸】①氨盐水与二氧化碳反应所得铵盐的用途为 。
②丙同学认为通过测定装置B中沉淀的质量,经计算分析也可确定晶体的组成。请对丙同学的观点进行评价: 。
15.二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加SO2可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量≤259mg/L。
(1)SO2作为食品添加剂须严格控制用量的原因是 。
(2)为检测某国产葡萄酒SO2中的含量是否符合国家标准,进行如下实验:
步骤1 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(该指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈 色。
②向10g 30%的H2O2溶液中加入 g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。
(1)SO2作为食品添加剂须严格控制用量的原因是 。
(2)为检测某国产葡萄酒SO2中的含量是否符合国家标准,进行如下实验:
步骤1 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(该指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈 色。
②向10g 30%的H2O2溶液中加入 g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。
查看全部题目