下载高清试卷
【2021-2022学年江苏省泰州市姜堰区九年级(上)期末化学试卷】-第1页
试卷格式:2021-2022学年江苏省泰州市姜堰区九年级(上)期末化学试卷.PDF
试卷热词:最新试卷、2022年、江苏试卷、泰州市试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷
扫码查看解析
试卷题目
1.变化无处不在。生活中的下列现象属于化学变化的是( )
- A. 食物腐败
- B. 汽油挥发
- C. 滴水成冰
- D. 轮胎爆炸
2.日常生活中水溶液随处可见。下列物质放入水中能形成溶液的是( )
- A. 泥土
- B. 植物油
- C. 面粉
- D. 蔗糖
3.2021年世界环境日中国主题是“人与自然和谐共生”。下列做法不符合这一理念的是( )
- A. 坚持绿色出行
- B. 野外焚烧垃圾
- C. 教科书循环使用
- D. 废旧电池回收处理
4.下列为同学们在“粗盐的初步提纯”实验中进行的操作,正确的是( )
- A.

- B.
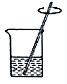
- C.
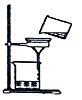
- D.

5.阅读下列信息,并据此完成第5~6题。
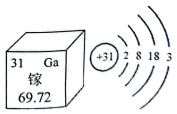
大量研究发现,镓元素对诊查头颈部癌症很有用处。如图是镓元素在周期表中的部分信息及镓原子的结构示意图。
氮化镓(GaN)是研制微电子器件、光电子器件的新型半导体材料,硬度大、熔点高、极稳定,可以通过以下反应获得:2Ga+2NH3
2GaN+3H2。
下列说法不正确的是( )
大量研究发现,镓元素对诊查头颈部癌症很有用处。如图是镓元素在周期表中的部分信息及镓原子的结构示意图。
氮化镓(GaN)是研制微电子器件、光电子器件的新型半导体材料,硬度大、熔点高、极稳定,可以通过以下反应获得:2Ga+2NH3
| 高温 |

下列说法不正确的是( )
- A. 镓元素是一种金属元素
- B. 镓原子的原子核中有31个质子
- C. 镓原子在化学反应中容易失去电子
- D. 镓原子的相对原子质量为69.72g
6.阅读下列信息,并据此完成第5~6题。
大量研究发现,镓元素对诊查头颈部癌症很有用处。如图是镓元素在周期表中的部分信息及镓原子的结构示意图。
氮化镓(GaN)是研制微电子器件、光电子器件的新型半导体材料,硬度大、熔点高、极稳定,可以通过以下反应获得:2Ga+2NH3
2GaN+3H2。

上述获得氮化镓的反应属于( )
大量研究发现,镓元素对诊查头颈部癌症很有用处。如图是镓元素在周期表中的部分信息及镓原子的结构示意图。
氮化镓(GaN)是研制微电子器件、光电子器件的新型半导体材料,硬度大、熔点高、极稳定,可以通过以下反应获得:2Ga+2NH3
| 高温 |

上述获得氮化镓的反应属于( )
- A. 化合反应
- B. 分解反应
- C. 置换反应
- D. 以上均不正确
7.下列有关实验分析正确的是( )
- A. 碳酸氢铵受热闻到刺激性气味,说明碳酸氢铵中含有氨分子
- B. 面粉、蔗糖灼烧后都变黑,说明它们是相同的物质
- C. 石蜡可以在空气中燃烧,说明可用石蜡测定空气中氧气的含量
- D. 煮沸的食盐水比煮沸的水温度高,说明食盐水稀溶液的沸点比水高
8.有关合金的叙述:①合金中至少含两种金属②合金中的元素以化合物的形式存在③合金中一定含有金属④合金一定是混合物⑤生铁是含杂质较多的铁合金(比钢多)⑥生铁可完全溶解在稀盐酸中。其中正确的是( )
- A. ①②③④⑤⑥
- B. ①②
- C. ①③④⑤
- D. ③④⑤
9.防控新冠肺炎期间,可以用“来苏水”进行杀菌消毒,其主要成分之一是对甲基苯酚(C7H8O)。下列叙述正确的是( )
- A. 对甲基苯酚由碳、氢、氧三种元素组成
- B. 对甲基苯酚中氢元素的质量分数最大
- C. 对甲基苯酚中碳、氢、氧元素的质量比为7:8:1
- D. 对甲基苯酚由7个碳原子、8个氢原子、1个氧原子构成
10.下列各组归纳完全正确的是( )
| A.化学与生活 | B.化学与安全 |
| ①用煮沸的方法降低水的硬度 ②用洗洁精溶解衣服上的油污 | ①进入溶洞前做灯火试验 ②室内着火打开门窗 |
| C.化学与健康 | D.化学与发现 |
| ①人体缺钙会导致侏儒症 ②人体缺铁会导致贫血 | ①门捷列夫发表元素周期表 ②拉瓦锡发现空气的成分 |
- A. A
- B. B
- C. C
- D. D
11.推理是化学学习的一种方法,以下推理正确的是( )
- A. 单质中只含有一种元素,因此由一种元素组成的纯净物一定是单质
- B. 同种元素的质子数相同,因此质子数相同的微粒一定是同种元素
- C. 离子是带电的原子或原子团,因此带电的粒子一定是离子
- D. 同种分子构成的物质一定是纯净物,因此纯净物一定是由同种分子构成
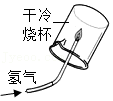
12.如图是某同学设计的实验,由此得出的结论合理的是( )
- A.
 由图实验可得二氧化锰是过氧化氢分解的催化剂
由图实验可得二氧化锰是过氧化氢分解的催化剂 - B.
 由图实验可得水由氢元素、氧元素组成
由图实验可得水由氢元素、氧元素组成 - C.
 由图实验可得二氧化碳能与水发生化学反应
由图实验可得二氧化碳能与水发生化学反应 - D.
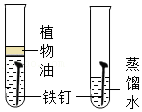 由图实验可得铁生锈是铁与氧气和水共同作用
由图实验可得铁生锈是铁与氧气和水共同作用
13.2021年6月17日,神舟十二号载人飞船成功发射升空。其中一种火箭推进剂在火箭发射过程中,发生反应的微观示意图如图,下列说法正确的是( )
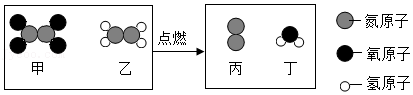

- A. 反应后原子个数减少
- B. 该反应的实质是原子的重新组合
- C. 该反应中所有元素的化合价都没有改变
- D. 参加反应的甲和乙的分子个数比为1:2
14.如图为KCl和Na2CO3的溶解度曲线,下列说法正确的是( )
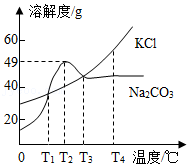

- A. T1℃时两物质溶液中溶质质量分数相等
- B. T2℃时将20g Na2CO3加入50g水中,充分搅拌得70g溶液
- C. 降低温度一定能使Na2CO3的饱和溶液变成不饱和溶液
- D. T2℃时两物质的饱和溶液升温到T3℃,所得溶液中溶质质量分数大小关系为:KCl=Na2CO3
15.下列有关实验所用的试剂或方法不正确的是( )
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 鉴别真假黄金 | 灼烧 |
| B | 鉴别氢氧化钠固体和硝酸铵固体 | 加水,观察现象 |
| C | 除去二氧化碳中少量的一氧化碳 | 点燃 |
| D | 除去氮气中少量的氧气 | 通过灼热的氧化铜 |
- A. A
- B. B
- C. C
- D. D
16.(1)宏微辨析,提升自我。
①小青进行电解水实验,该过程中发生变化的微粒为 (写化学用语,下同),为了增强水的导电性,他向水中加入氢氧化钠溶液,构成氢氧化钠的阳离子为 。
②小华发现铝盆失去了金属光泽,这是因为 (用化学方程式表示)。
(2)持续防疫,化学助力。
①上学时,佩戴口罩,口罩中活性炭起 作用。
②放学后,消毒杀菌。用于教室消毒的过氧乙酸化学性质不稳定,其分解的化学方程式为:2C2H4O3═2C2H4O2+X↑,则X的化学式为 。
①小青进行电解水实验,该过程中发生变化的微粒为 (写化学用语,下同),为了增强水的导电性,他向水中加入氢氧化钠溶液,构成氢氧化钠的阳离子为 。
②小华发现铝盆失去了金属光泽,这是因为 (用化学方程式表示)。
(2)持续防疫,化学助力。
①上学时,佩戴口罩,口罩中活性炭起 作用。
②放学后,消毒杀菌。用于教室消毒的过氧乙酸化学性质不稳定,其分解的化学方程式为:2C2H4O3═2C2H4O2+X↑,则X的化学式为 。
17.A~H是初中化学常见的物质。其中A是一种绿色固体,A在加热条件下可转化为B、C、D,C和E为组成元素相同的无色液体,E可以转化为C和F,D和F在一定条件下可以互相转化,G是应用最广泛的金属,H是蓝色溶液,G与H的反应是湿法冶金的先驱。
(1)A的化学式为 ;F的一种用途为 。
(2)E转化为C的化学方程式为 ;G与H反应的化学方程式为 。
(3)C和E化学性质不同的原因为 。
(4)A﹣H八种物质中,属于氧化物的有 种。
(1)A的化学式为 ;F的一种用途为 。
(2)E转化为C的化学方程式为 ;G与H反应的化学方程式为 。
(3)C和E化学性质不同的原因为 。
(4)A﹣H八种物质中,属于氧化物的有 种。
18.请结合如图回答问题。
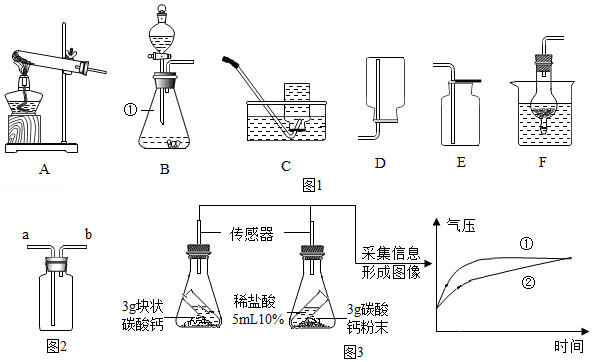
(1)标号①的仪器名称 。
(2)实验室用A装置制取氧气的化学方程式为 ,若要收集较纯净的氧气,应选择的收集装置为 (填装置序号),反应后回收二氧化锰的主要操作顺序为 (填序号)。
①干燥
②溶解
③过滤
④洗涤
(3)装置F可用来制备二氧化碳,其优点为 ,反应化学方程式为 ;若用图2装置收集二氧化碳,验满的方法为 。
(4)利用数据传感技术可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率(如图3),下列说法正确的是 。
a.碳酸钙粉末产生的CO2质量多
b.对比分析可知,曲线①表示块状碳酸钙与稀盐酸的反应
c.对比分析可知,其它条件相同时,碳酸钙粉末与稀盐酸反应速率更快

(1)标号①的仪器名称 。
(2)实验室用A装置制取氧气的化学方程式为 ,若要收集较纯净的氧气,应选择的收集装置为 (填装置序号),反应后回收二氧化锰的主要操作顺序为 (填序号)。
①干燥
②溶解
③过滤
④洗涤
(3)装置F可用来制备二氧化碳,其优点为 ,反应化学方程式为 ;若用图2装置收集二氧化碳,验满的方法为 。
(4)利用数据传感技术可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率(如图3),下列说法正确的是 。
a.碳酸钙粉末产生的CO2质量多
b.对比分析可知,曲线①表示块状碳酸钙与稀盐酸的反应
c.对比分析可知,其它条件相同时,碳酸钙粉末与稀盐酸反应速率更快
19.学习小组对甲烷还原氧化铁所得黑色粉末进行探究。
【提出问题】黑色粉末是什么?
【查阅资料】
Ⅰ.浓硫酸具有吸水性
Ⅱ.CO2能被NaOH溶液吸收,CO不能
Ⅲ.Fe3O4能与稀硫酸反应,无气体放出;但不与硫酸铜溶液反应
Ⅳ.在不同温度下,甲烷还原氧化铁的黑色粉末为Fe、Fe3O4中的一种或两种
(1)【做出猜想】猜想一:Fe;猜想二:Fe3O4;猜想三: 。
(2)【实验探究】
实验一:小组同学对黑色粉末进行如下探究。
实验二:小组同学另取黑色粉末进行如图实验。
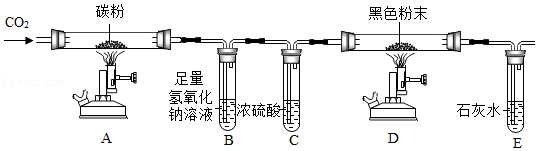
(3)实验开始时先点燃 处的酒精喷灯一段时间,理由为 。
(4)A处的方程式为 ,该反应过程中 热量(填“放出”或“吸收”)。
(5)实验观察到E中澄清石灰水变浑浊,反应化学方程式为 ,据此判断黑色粉末中含有 。
(6)此装置的不足之处为 。
【实验结论】猜想三正确。
(7)【反思交流】如果将装置B去掉,不能验证黑色固体的成分,理由为 。
【提出问题】黑色粉末是什么?
【查阅资料】
Ⅰ.浓硫酸具有吸水性
Ⅱ.CO2能被NaOH溶液吸收,CO不能
Ⅲ.Fe3O4能与稀硫酸反应,无气体放出;但不与硫酸铜溶液反应
Ⅳ.在不同温度下,甲烷还原氧化铁的黑色粉末为Fe、Fe3O4中的一种或两种
(1)【做出猜想】猜想一:Fe;猜想二:Fe3O4;猜想三: 。
(2)【实验探究】
实验一:小组同学对黑色粉末进行如下探究。
| 实验方案 | 实验现象 | 实验结论 |
| 取少量黑色粉末,滴加 溶液 | 黑色粉末中含有铁粉 |
实验二:小组同学另取黑色粉末进行如图实验。

(3)实验开始时先点燃 处的酒精喷灯一段时间,理由为 。
(4)A处的方程式为 ,该反应过程中 热量(填“放出”或“吸收”)。
(5)实验观察到E中澄清石灰水变浑浊,反应化学方程式为 ,据此判断黑色粉末中含有 。
(6)此装置的不足之处为 。
【实验结论】猜想三正确。
(7)【反思交流】如果将装置B去掉,不能验证黑色固体的成分,理由为 。
20.硫酸亚锡(SnSO4)广泛应用于电镀工业,易与氧气反应而变质。工业上用混有盐酸的SnCl2制取SnSO4的一种方案如图:
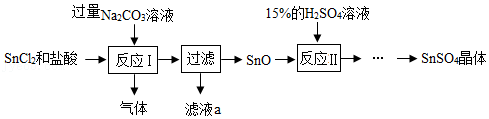
【查阅资料】
反应1发生的化学方程式为:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
SnCl2+Na2CO3═SnO↓+2NaCl+CO2↑
回答下列问题:
(1)SnCl2中Sn的化合价为 。
(2)滤液a中的溶质为 (填化学式)。
(3)获得SnSO4晶体的部分操作须隔绝空气进行的原因为 。
(4)Sn与稀盐酸反应生成SnCl2和一种单质,该反应的化学方程式为 。
(5)实验室用14.6%的盐酸来配制稀盐酸,主要实验步骤为:计算、 、稀释。用量筒量取14.6%的盐酸时仰视读数,则所配得稀盐酸的溶质质量分数 (填“偏大”“偏小”或“不变”)。
(6)取溶质质量分数为14.6%的盐酸50g与一定质量的Na2CO3粉末恰好完全反应,计算:(写出计算过程)
①生成二氧化碳的质量;
②反应后所得溶液中溶质的质量分数。(计算结果精确到0.1%)

【查阅资料】
反应1发生的化学方程式为:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
SnCl2+Na2CO3═SnO↓+2NaCl+CO2↑
回答下列问题:
(1)SnCl2中Sn的化合价为 。
(2)滤液a中的溶质为 (填化学式)。
(3)获得SnSO4晶体的部分操作须隔绝空气进行的原因为 。
(4)Sn与稀盐酸反应生成SnCl2和一种单质,该反应的化学方程式为 。
(5)实验室用14.6%的盐酸来配制稀盐酸,主要实验步骤为:计算、 、稀释。用量筒量取14.6%的盐酸时仰视读数,则所配得稀盐酸的溶质质量分数 (填“偏大”“偏小”或“不变”)。
(6)取溶质质量分数为14.6%的盐酸50g与一定质量的Na2CO3粉末恰好完全反应,计算:(写出计算过程)
①生成二氧化碳的质量;
②反应后所得溶液中溶质的质量分数。(计算结果精确到0.1%)
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解