下载高清试卷
【2021-2022学年江苏省南通市如皋市九年级(上)期末化学试卷】-第1页
试卷格式:2021-2022学年江苏省南通市如皋市九年级(上)期末化学试卷.PDF
试卷热词:最新试卷、2022年、江苏试卷、南通市试卷、化学试卷、九年级上学期试卷、期末试卷、初中试卷
扫码查看解析
试卷题目
1.下列有关水的说法正确的是( )
- A. 活性炭可将海水淡化
- B. 软水遇肥皂水易起浮渣
- C. 水汽化时分子间的间隔变大
- D. 水由氢分子和氧分子构成
2.“分类”是学习化学的重要思想。下列说法不正确的是( )
- A. 纯碱属于碱
- B. 碘酒是一种溶液
- C. C60属于单质
- D. 钛合金属于混合物
3.下列有关实验室制取氧气的实验操作或装置正确的是( )
- A.
 保存溶液
保存溶液 - B.
 装入固体
装入固体 - C.
 发生装置
发生装置 - D.
 收集装置
收集装置
4.下列有关物质的性质与用途具有对应关系的是( )
- A. 浓硫酸具有吸水性,可用作干燥剂
- B. 金刚石无色透明,可用于切割大理石
- C. 石墨质软且滑腻,可用于制作电极材料
- D. 氢氧化铝不溶于水,可用于治疗胃酸过多
5.下列有关金属的说法不正确的是( )
- A. 铁制品在潮湿的空气中易生锈
- B. 生铁的含碳量比钢的高
- C. 铁丝在氧气中燃烧生成氧化铁
- D. 锡铅合金的熔点比纯锡的低
6.某同学以蔗糖、食品级小苏打、柠檬酸、水等为原料自制汽水。下列说法不正确的是( )
- A. 蔗糖在溶液中以分子的形式存在
- B. 柠檬酸能使紫色石蕊溶液变为蓝色
- C. 汽水中有气泡主要是因为小苏打和柠檬酸反应生成了CO2
- D. 所制取汽水最好冷藏保存,是因为温度降低,气体在水中的溶解度增大
7.KNO3和KCl的溶解度曲线如图所示。下列说法正确的是( )
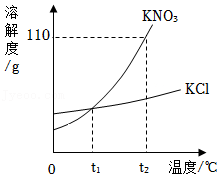

- A. KNO3的溶解度大于KCl的溶解度
- B. T2℃时,50gKNO3溶于50g水中,溶液质量为100g
- C. T1℃时,KNO3、KCl两溶液中溶质的质量分数一定相等
- D. 将T2℃时KCl的饱和溶液降温至T1℃,没有晶体析出
8.下列实验设计合理的是( )
- A.
 验证分子在不断运动
验证分子在不断运动 - B.
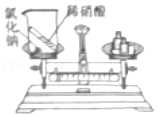 验证质量守恒定律
验证质量守恒定律 - C.
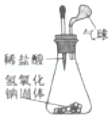 验证氢氧化钠与盐酸反应放热
验证氢氧化钠与盐酸反应放热 - D.
 鉴别NH4Cl溶液和NH4NO3溶液
鉴别NH4Cl溶液和NH4NO3溶液
9.下列实验操作能达到实验目的的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 比较银和铜的金属活动性 | 将银丝和铜丝分别浸入稀盐酸中 |
| B | 除去NaCl固体中混有的少量Na2CO3 | 溶解,加稀盐酸至无气泡产生,蒸发结晶 |
| C | 检验Na2CO3溶液中是否混有Na2SO4 | 取样,滴加氯化钡溶液,有白色沉淀产生 |
| D | 配制质量分数为5%的NaCl溶液 | 将5gNaCl固体加入100g水中,搅拌至完全溶解 |
- A. A
- B. B
- C. C
- D. D
10.取2.88g草酸亚铁(FeC2O4)在真空条件下加热至固体质量不再发生变化,固体质量随温度的变化如图所示(图中各点对应固体均为纯净物),所得气体中仅含CO和CO2。下列说法不正确的是( )
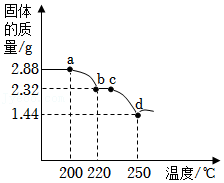

- A. a→b过程中发生的反应可能为FeC2O4FeCO3+CO↑
△ - B. c→d过程中,固体中铁元素的质量分数逐渐增大
- C. d点对应的固体为FeO
- D. 加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了Fe3C
11.宏观和微观相结合是认识物质结构与性质的重要方法。
(1)下表为四种元素原子的结构示意图。
①氢原子得到一个电子所形成的离子为 (填离子符号)。
②上表中x= 。钠原子在反应中易 (填“得到”或“失去”)电子。
③由上表中两种元素组成的一种化合物具有可燃性和毒性,常用作燃料。该化合物为 (填名称)。
(2)硫及其化合物的“化合价﹣物质类别”关系如图所示。
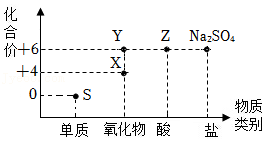
①物质Y的化学式为 。
②写出物质Z通过中和反应转化为Na2SO4的化学方程式: 。
(1)下表为四种元素原子的结构示意图。
| 元素名称 | 氢 | 碳 | 氧 | 钠 |
| 原子结构示意图 | 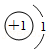 | 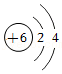 |  | 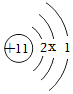 |
①氢原子得到一个电子所形成的离子为 (填离子符号)。
②上表中x= 。钠原子在反应中易 (填“得到”或“失去”)电子。
③由上表中两种元素组成的一种化合物具有可燃性和毒性,常用作燃料。该化合物为 (填名称)。
(2)硫及其化合物的“化合价﹣物质类别”关系如图所示。

①物质Y的化学式为 。
②写出物质Z通过中和反应转化为Na2SO4的化学方程式: 。
12.利用硫铁矿(主要成分为FeS2,含少量SiO2和CuS)制备绿矾晶体(FeSO4•7H2O)的实验流程如下(虚线处部分流程略去):
已知:SiO2不溶于水,不与稀硫酸反应。KSCN溶液遇Fe2(SO4)3变红,遇FeSO4不变色。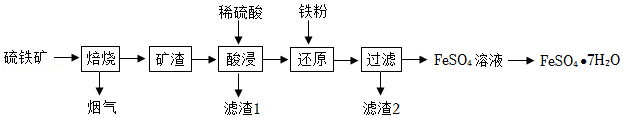
(1)“焙烧”时发生的反应主要为4FeS2+aO2
2Fe2O3+8SO2,则a= 。
(2)“酸溶”时,为使矿渣充分溶解,可采取的措施有 (任写一种),滤渣1的成分是 (填名称)。
(3)“还原”过程中,发生的反应为:①Fe+CuSO4═FeSO4+Cu,该反应属于基本反应类型中的 反应;② (用化学方程式表示)。
(4)证明“过滤”所得FeSO4溶液中不含Fe(SO4)3的实验方法是 (包括操作和现象)。
(5)已知FeSO4的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体):
若需从FeSO4溶液中结晶析出FeSO4•4H2O,应控制的结晶温度(T)的范围为 。
已知:SiO2不溶于水,不与稀硫酸反应。KSCN溶液遇Fe2(SO4)3变红,遇FeSO4不变色。

(1)“焙烧”时发生的反应主要为4FeS2+aO2
| 高温 |
(2)“酸溶”时,为使矿渣充分溶解,可采取的措施有 (任写一种),滤渣1的成分是 (填名称)。
(3)“还原”过程中,发生的反应为:①Fe+CuSO4═FeSO4+Cu,该反应属于基本反应类型中的 反应;② (用化学方程式表示)。
(4)证明“过滤”所得FeSO4溶液中不含Fe(SO4)3的实验方法是 (包括操作和现象)。
(5)已知FeSO4的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体):
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
若需从FeSO4溶液中结晶析出FeSO4•4H2O,应控制的结晶温度(T)的范围为 。
13.我国提出了“碳达峰”和“碳中和”目标。
I“碳”的排放与捕捉
(1)自然界中CO2的来源有 (任写一点),CO2的过度排放会造成 的加剧。
(2)用NaOH溶液喷淋“捕捉”空气中的CO2可达到消耗CO2的目的,写出该反应的化学方程式: 。
Ⅱ“碳”的转化与利用
(3)一种实现二氧化碳转化为重要原料二甲醚(C2H6O)的途径如下:
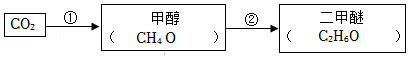
转化①是二氧化碳与一种常见单质反应生成甲醇和水,该单质为 (填化学式)。转化②是甲醇通过分解反应生成二甲醚和水,反应中生成的二甲醚和水的分子数之比为 。
(4)常温下,新型纳米材料MFe2Ox(M表示+2价的金属元素,3<x<4)能使工业废气中的CO2转化为C,转化流程如图所示,反应中元素M的化合价未发生变化。
①该反应中,CO2发生的是 (填“还原”或“氧化”)反应。

②MFe2Ox转化为MFe2Oy,铁元素的质量分数 (填“升高”或“降低”)。
I“碳”的排放与捕捉
(1)自然界中CO2的来源有 (任写一点),CO2的过度排放会造成 的加剧。
(2)用NaOH溶液喷淋“捕捉”空气中的CO2可达到消耗CO2的目的,写出该反应的化学方程式: 。
Ⅱ“碳”的转化与利用
(3)一种实现二氧化碳转化为重要原料二甲醚(C2H6O)的途径如下:

转化①是二氧化碳与一种常见单质反应生成甲醇和水,该单质为 (填化学式)。转化②是甲醇通过分解反应生成二甲醚和水,反应中生成的二甲醚和水的分子数之比为 。
(4)常温下,新型纳米材料MFe2Ox(M表示+2价的金属元素,3<x<4)能使工业废气中的CO2转化为C,转化流程如图所示,反应中元素M的化合价未发生变化。
①该反应中,CO2发生的是 (填“还原”或“氧化”)反应。

②MFe2Ox转化为MFe2Oy,铁元素的质量分数 (填“升高”或“降低”)。
14.某学习小组对镁及其化合物的性质进行实验探究。
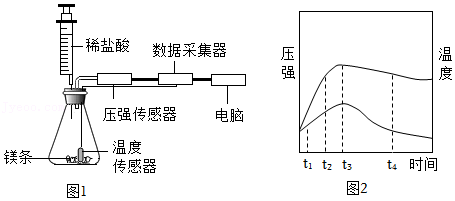
实验1 如图1所示,甲同学在锥形瓶中放入打磨过的镁条,将注射器中的稀盐酸推入瓶内,通过数字传感器测定瓶内的压强和温度,实验结果如图2所示。
[实验分析]
(1)写出镁条与盐酸反应的化学方程式 。
(2)图2中,t1、t2两个时刻产生氢气较快的时刻为 。
(3)图2中,t3~t4时段容器内压强逐渐减小的原因可能是 。
实验2 乙同学在试管中放入镁条,加入稀盐酸,充分反应后镁条有剩余,向溶液中滴入酚酞溶液,振荡后溶液显红色。
[提出猜想]猜想Ⅰ:氯化镁溶液使酚酞变红色;猜想Ⅱ:镁与热水反应使酚酞溶液变红色。
[实验验证]
(4)乙同学取氯化镁溶液,测得其pH值为6,说明猜想I (填“成立”或“不成立”)。
(5)为验证猜想Ⅱ,乙同学在滴有酚酞溶液的热水中放入打磨过的镁条,观察到溶液逐渐变浑浊且变为红色,镁条表面有气泡产生,经检验该气体为氢气。镁与热水反应的化学方程式为 。
(6)一段时间后,乙同学观察到溶液红色逐渐变淡,最后消失,他认为原因可能是温度降低导致Mg(OH)2的溶解度减小。请设计实验进行验证并简述实验过程(包括操作和可能的现象): 。
实验3 丙同学向镁条与稀盐酸反应后的溶液中通入氨气,观察到溶液变浑浊;过滤、洗净、低温烘干得白色固体;取一定量白色固体,充分加热,残留2.40g固体,将生成的气体用足量的AgNO3溶液吸收,生成5.74g沉淀。
[查阅资料]此白色固体为碱式氯化镁[Mgx(OH)yClz],其不落于水,能与酸反应,加热分解生成MgO、H2O和HCl。
(7)白色固体的化学式为 。
(8)若生成的气体未被AgNO3溶液完全吸收,则测得的Mgx(OH)yClz中y值将 (填“偏大”“偏小”或“不变”)。

实验1 如图1所示,甲同学在锥形瓶中放入打磨过的镁条,将注射器中的稀盐酸推入瓶内,通过数字传感器测定瓶内的压强和温度,实验结果如图2所示。
[实验分析]
(1)写出镁条与盐酸反应的化学方程式 。
(2)图2中,t1、t2两个时刻产生氢气较快的时刻为 。
(3)图2中,t3~t4时段容器内压强逐渐减小的原因可能是 。
实验2 乙同学在试管中放入镁条,加入稀盐酸,充分反应后镁条有剩余,向溶液中滴入酚酞溶液,振荡后溶液显红色。
[提出猜想]猜想Ⅰ:氯化镁溶液使酚酞变红色;猜想Ⅱ:镁与热水反应使酚酞溶液变红色。
[实验验证]
(4)乙同学取氯化镁溶液,测得其pH值为6,说明猜想I (填“成立”或“不成立”)。
(5)为验证猜想Ⅱ,乙同学在滴有酚酞溶液的热水中放入打磨过的镁条,观察到溶液逐渐变浑浊且变为红色,镁条表面有气泡产生,经检验该气体为氢气。镁与热水反应的化学方程式为 。
(6)一段时间后,乙同学观察到溶液红色逐渐变淡,最后消失,他认为原因可能是温度降低导致Mg(OH)2的溶解度减小。请设计实验进行验证并简述实验过程(包括操作和可能的现象): 。
实验3 丙同学向镁条与稀盐酸反应后的溶液中通入氨气,观察到溶液变浑浊;过滤、洗净、低温烘干得白色固体;取一定量白色固体,充分加热,残留2.40g固体,将生成的气体用足量的AgNO3溶液吸收,生成5.74g沉淀。
[查阅资料]此白色固体为碱式氯化镁[Mgx(OH)yClz],其不落于水,能与酸反应,加热分解生成MgO、H2O和HCl。
(7)白色固体的化学式为 。
(8)若生成的气体未被AgNO3溶液完全吸收,则测得的Mgx(OH)yClz中y值将 (填“偏大”“偏小”或“不变”)。
15.氯气(Cl2)广泛应用于杀菌、消毒及化工领域。
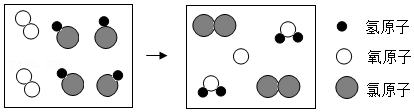
(1)氯气溶于水会产生次氯酸,常用于自来水厂消毒,该过程属于 (填“物理”或“化学”)变化。
(2)氯气在使用时,一般会产生氯化氢。工业上将HCl转化的一种途径如图所示,图中X代表的分子为 (填化学式)。
(3)实验室制备KClO3的反应为3Cl2+6KOH
5KCl+KClO3+3H2O。
①KClO3中钾元素和氧元素的质量比为 (填最简整数比)。
②将一定量的Cl2通入100g热的KOH溶液中,恰好完全反应时溶液质量增加14.2g。计算所用KOH溶液中溶质的质量分数。

(1)氯气溶于水会产生次氯酸,常用于自来水厂消毒,该过程属于 (填“物理”或“化学”)变化。
(2)氯气在使用时,一般会产生氯化氢。工业上将HCl转化的一种途径如图所示,图中X代表的分子为 (填化学式)。
(3)实验室制备KClO3的反应为3Cl2+6KOH
| △ |
①KClO3中钾元素和氧元素的质量比为 (填最简整数比)。
②将一定量的Cl2通入100g热的KOH溶液中,恰好完全反应时溶液质量增加14.2g。计算所用KOH溶液中溶质的质量分数。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解