下载高清试卷
【2021-2022学年北京市朝阳区九年级(上)月考化学试卷】-第1页
试卷格式:2021-2022学年北京市朝阳区九年级(上)月考化学试卷.PDF
试卷热词:最新试卷、2022年、北京试卷、朝阳区试卷、化学试卷、九年级试卷、月考试卷、初中试卷
扫码查看解析
试卷题目
1.下列实验操作一定能达到实验目的的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO2中的CO | 点燃 |
| B | 去除粗盐中难溶性杂质 | 溶解、过滤、蒸发 |
| C | 鉴别稀盐酸和NaCl溶液 | 分别滴加酚酞溶液 |
| D | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Cu分别放入AgNO3溶液中 |
- A. A
- B. B
- C. C
- D. D
2.某固体粉末可能由氢氧化钠、氢氧化钙、碳酸钠和碳酸钙中的一种或几种组成,进行如下实验:
①取少量固体加入足量的水,搅拌,有不溶物;
②过滤,向滤液中加入盐酸,有气泡产生。
下列对固体粉末成分的判断中,不正确的是( )
①取少量固体加入足量的水,搅拌,有不溶物;
②过滤,向滤液中加入盐酸,有气泡产生。
下列对固体粉末成分的判断中,不正确的是( )
- A. 一定有碳酸钠
- B. 可能有氢氧化钠
- C. 一定有碳酸钙
- D. 可能有氢氧化钙
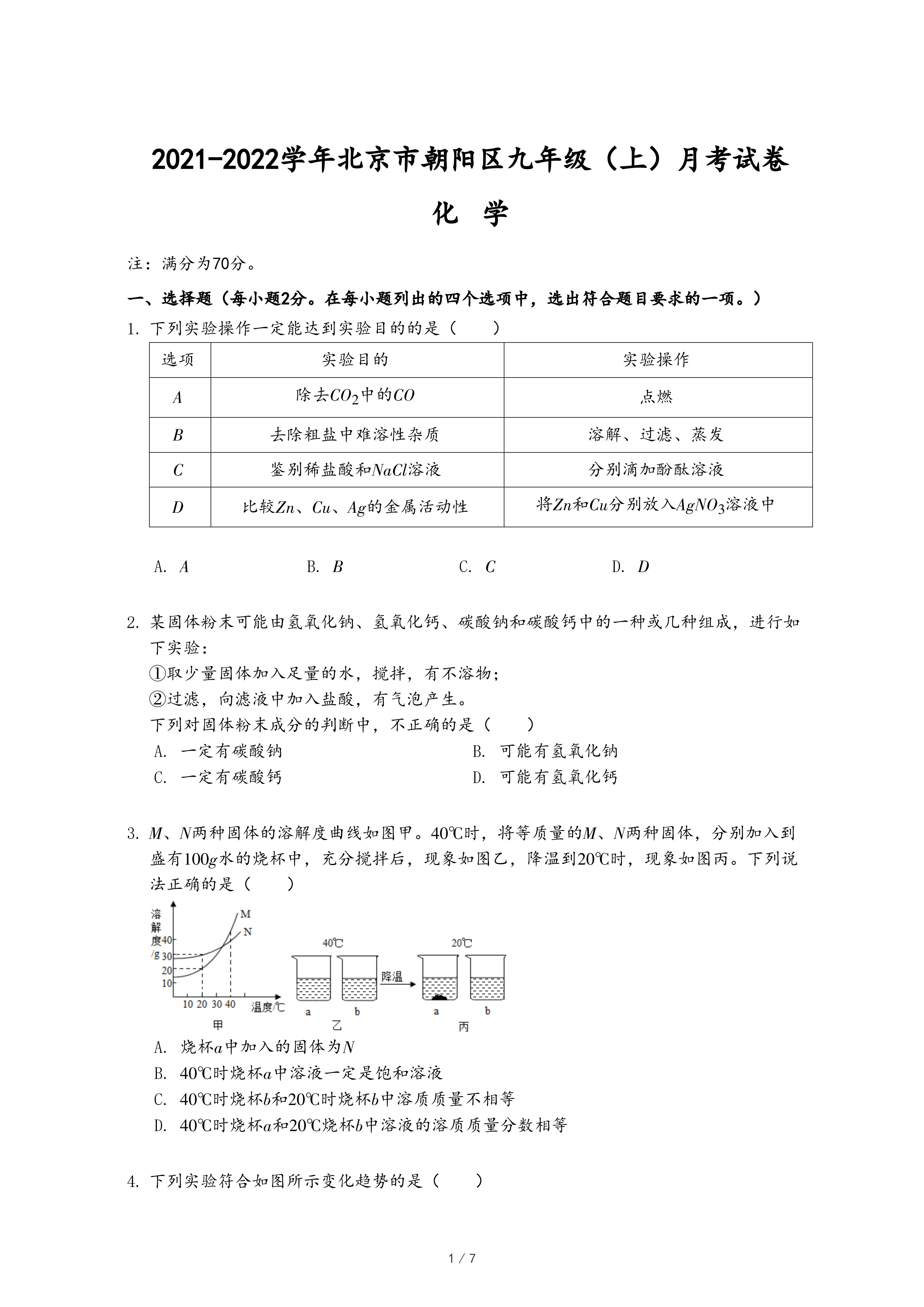
3.M、N两种固体的溶解度曲线如图甲。40℃时,将等质量的M、N两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图乙,降温到20℃时,现象如图丙。下列说法正确的是( )

- A. 烧杯a中加入的固体为N
- B. 40℃时烧杯a中溶液一定是饱和溶液
- C. 40℃时烧杯b和20℃时烧杯b中溶质质量不相等
- D. 40℃时烧杯a和20℃烧杯b中溶液的溶质质量分数相等
4.下列实验符合如图所示变化趋势的是( )
| 序号 | 实验 | 横坐标 | 纵坐标 |
| A | 向一定量氢氧化钠溶液中滴加稀硫酸 | 稀硫酸的质量 | 水的质量 |
| B | 加热一定量高锰酸钾固体 | 时间 | 剩余固体中氧元素的质量 |
| C | 向一定量饱和硝酸钾溶液中加水 | 加水的质量 | 溶质的质量分数 |
| D | 向一定量镁粉中加入稀盐酸 | 稀盐酸的质量 | 镁粉的质量 |

- A. A
- B. B
- C. C
- D. D
5.实验小组用传感器研究等量水或NaOH溶液分别吸收CO2的效果,实验装置及测定结果如图所示。下列说法不正确的是( )


- A. 曲线①是CO2溶解和CO2与水反应的综合结果
- B. 对比曲线①和②,可说明CO2能与NaOH反应
- C. NaOH溶液吸收CO2的效果比水好
- D. 若选用等量饱和石灰水进行实验,其曲线在①上方
6.葡萄的果肉和果皮中都含有丰富的营养物质。
(1)为使葡萄果实饱满、提高含糖量,在葡萄生长的中后期可适当施加硫酸钾、过磷酸钙等肥料,其中硫酸钾属于化学肥料中的 肥。
(2)用硫酸铜配制的农药波尔多液,可以防治葡萄生长中的病害。溶解硫酸铜时不宜用铁制容器,用化学方程式表示其原因: 。
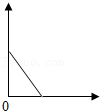
(3)食用葡萄前要清洗干净,如图是一种清洗的方法。
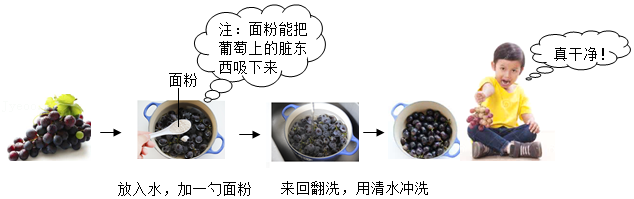
下列说法正确的是 (填序号)。
A. 面粉有利于去除葡萄皮上的脏东西
B. 清洗干净后,建议吃葡萄不吐葡萄皮
C. 葡萄富含糖类物质,糖尿病人不宜多食。
(1)为使葡萄果实饱满、提高含糖量,在葡萄生长的中后期可适当施加硫酸钾、过磷酸钙等肥料,其中硫酸钾属于化学肥料中的 肥。
(2)用硫酸铜配制的农药波尔多液,可以防治葡萄生长中的病害。溶解硫酸铜时不宜用铁制容器,用化学方程式表示其原因: 。
(3)食用葡萄前要清洗干净,如图是一种清洗的方法。

下列说法正确的是 (填序号)。
A. 面粉有利于去除葡萄皮上的脏东西
B. 清洗干净后,建议吃葡萄不吐葡萄皮
C. 葡萄富含糖类物质,糖尿病人不宜多食。
7.H2O2可作增氧剂。常温下,用4% H2O2溶液进行实验,研究pH对H2O2分解所得溶液中溶氧量的影响,测定结果如图。
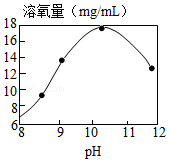
(1)H2O2分解的化学方程式为 。
(2)分析如图得到的结论是 。

(1)H2O2分解的化学方程式为 。
(2)分析如图得到的结论是 。
8.阅读下面科普短文。
石墨烯是一种由碳原子构成的碳纳米材料,一层层叠起来就是石墨,1mm厚的石墨大约包含300万层石墨烯。实际上石墨烯本来就存在于自然界中,只是难以剥离出单层结构。
石墨烯的制备方法之一是低温扩张法,把石墨粉、钠、液氨按照一定比例混合,在特定装置中进行剥离,然后用去离子水清洗至中性,再放入烘箱内烘干即得石墨烯。制得的石墨烯的比表面积越大,质量越好。科学家测定了烘干温度对制得的石墨烯的比表面积的影响如图1所示。
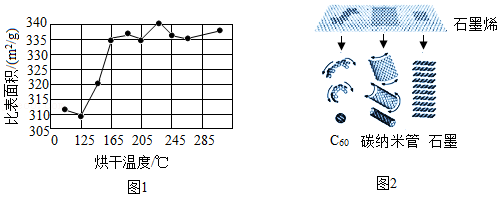
石墨烯具有强度高、透光率高、导电性强、韧性好的特点,是构成其它新型碳材料的基本组成单元,如图2所示。将含有石墨烯和碳纳米管两种纳米材料的水溶液低温环境下冻干,去除水分、保留骨架,制造出的一种超轻固体材料被称为“全碳气凝胶”,是迄今为止世界上最轻的材料。“全碳气凝胶”还是吸油能力最强的材料之一,吸收量可高达自身质量的900倍。
随着石墨烯制备方法的研发,石墨烯必将广泛应用到各领域中。
依据文章内容回答下列问题。
(1)石墨烯属于 (填“单质”或“化合物”)。
(2)“1mm厚的石墨大约包含300万层石墨烯”,说明构成物质的微粒具有的性质 。
(3)石墨烯可用于制作新能源电池,主要利用石墨烯的 性。
(4)由图1可知:制备石墨烯时最佳的烘干温度是 。
(5)下列说法正确的是 。
A. 自然界中不存在石墨烯
B. 石墨烯可以制备多种新型碳材料
C. 碳纳米管具有可燃性,充分燃烧生成二氧化碳
D. “全碳气凝胶”可处理海上石油泄漏
石墨烯是一种由碳原子构成的碳纳米材料,一层层叠起来就是石墨,1mm厚的石墨大约包含300万层石墨烯。实际上石墨烯本来就存在于自然界中,只是难以剥离出单层结构。
石墨烯的制备方法之一是低温扩张法,把石墨粉、钠、液氨按照一定比例混合,在特定装置中进行剥离,然后用去离子水清洗至中性,再放入烘箱内烘干即得石墨烯。制得的石墨烯的比表面积越大,质量越好。科学家测定了烘干温度对制得的石墨烯的比表面积的影响如图1所示。

石墨烯具有强度高、透光率高、导电性强、韧性好的特点,是构成其它新型碳材料的基本组成单元,如图2所示。将含有石墨烯和碳纳米管两种纳米材料的水溶液低温环境下冻干,去除水分、保留骨架,制造出的一种超轻固体材料被称为“全碳气凝胶”,是迄今为止世界上最轻的材料。“全碳气凝胶”还是吸油能力最强的材料之一,吸收量可高达自身质量的900倍。
随着石墨烯制备方法的研发,石墨烯必将广泛应用到各领域中。
依据文章内容回答下列问题。
(1)石墨烯属于 (填“单质”或“化合物”)。
(2)“1mm厚的石墨大约包含300万层石墨烯”,说明构成物质的微粒具有的性质 。
(3)石墨烯可用于制作新能源电池,主要利用石墨烯的 性。
(4)由图1可知:制备石墨烯时最佳的烘干温度是 。
(5)下列说法正确的是 。
A. 自然界中不存在石墨烯
B. 石墨烯可以制备多种新型碳材料
C. 碳纳米管具有可燃性,充分燃烧生成二氧化碳
D. “全碳气凝胶”可处理海上石油泄漏
9.《天工开物》中介绍了锌的冶炼方法:“炉甘石(ZnCO3)、煤炭饼装罐泥封”“其底铺薪,发火煅红”“冷淀毁罐取出”。反应区中发生的主要反应有:ZnCO3分解生成 ZnO 和另一种氧化物;ZnO与C反应生成Zn。
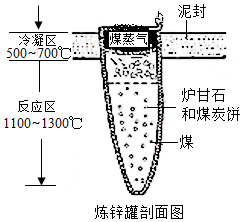
(1)反应区中ZnCO3分解的化学方程式为 。
(2)“冷淀”后方能“毁罐”取锌,从化学变化的角度分析其原因 。

(1)反应区中ZnCO3分解的化学方程式为 。
(2)“冷淀”后方能“毁罐”取锌,从化学变化的角度分析其原因 。
10.高锰酸钾主要用于化工、制药等工业。以软锰矿(主要成分MnO2)为原料生产高锰酸钾的流程如图所示。
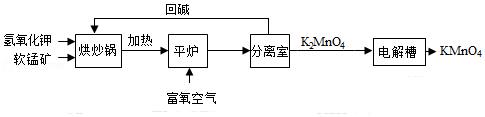
(1)在烘炒锅中进行原料混合,混合前应将软锰矿粉碎,其作用是 。
(2)平炉中发生反应生成K2MnO4和H2O,则参加反应的物质有 。
(3)电解槽中发生反应的化学方程式为2K2MnO4+2H2O
2KMnO4+2KOH+H2↑,该反应前后化合价发生变化的元素有 。

(1)在烘炒锅中进行原料混合,混合前应将软锰矿粉碎,其作用是 。
(2)平炉中发生反应生成K2MnO4和H2O,则参加反应的物质有 。
(3)电解槽中发生反应的化学方程式为2K2MnO4+2H2O
| 通电 |
11.对比归纳是学习化学的重要方法。请回答下列问题。
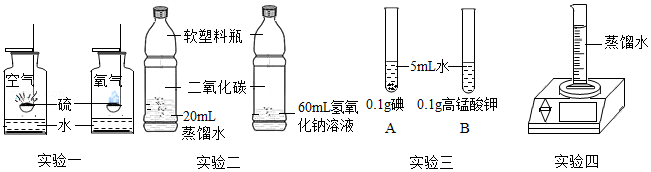
(1)实验一说明影响硫燃烧剧烈程度的因素是 。
(2)实验二用于证明二氧化碳和氢氧化钠能否反应,该实验设计不符合对比实验的基本原则,理由是 。
(3)实验三观察到A中固体几乎不溶,B中固体全部溶解,说明影响物质溶解性的因素是 。
(4)实验四中示数变小,从微粒的角度解释其原因是 。

(1)实验一说明影响硫燃烧剧烈程度的因素是 。
(2)实验二用于证明二氧化碳和氢氧化钠能否反应,该实验设计不符合对比实验的基本原则,理由是 。
(3)实验三观察到A中固体几乎不溶,B中固体全部溶解,说明影响物质溶解性的因素是 。
(4)实验四中示数变小,从微粒的角度解释其原因是 。
12.某实验小组用足量稀盐酸分别与等浓度的碳酸钠溶液和碳酸氢钠溶液反应,实验装置和测得数据如图所示。

(1)写出碳酸氢钠与稀盐酸反应的化学方程式: 。
(2)小组同学分析后,得出实验结论:相同条件下,两种碳酸盐和同样的稀盐酸反应时,碳酸氢钠产生气体的速率比碳酸钠要快。通过图象分析,你的理由是 ;除图象证据外,还可以通过比较相同时间内 (填写1点实验现象)的差异得出结论。

(1)写出碳酸氢钠与稀盐酸反应的化学方程式: 。
(2)小组同学分析后,得出实验结论:相同条件下,两种碳酸盐和同样的稀盐酸反应时,碳酸氢钠产生气体的速率比碳酸钠要快。通过图象分析,你的理由是 ;除图象证据外,还可以通过比较相同时间内 (填写1点实验现象)的差异得出结论。
13.利用下图装置进行实验(两支玻璃管内径相同).实验前K1、K2、K3均已关闭。
(1)实验1:锌与稀硫酸反应的化学方程式为 ;为使反应停止,Ⅲ中的操作是 。
(2)实验2:打开K2,右管中液面下降,原因是 ;计算空气中氧气体积分数的表达式为 (用h0、h1表示)。
| 实验装置 | 【实验1】制备气体 | 【实验2】测定空气中氧气含量 |
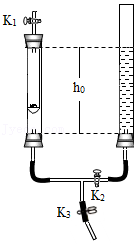 | 左管中带孔的燃烧匙盛有足量锌粒,右管盛有稀硫酸Ⅰ.打开K1和K2,使反应发生Ⅱ.在K1的导管口处收集气体Ⅲ.… | 左管中燃烧匙盛有足量白磷,右管盛有水Ⅰ.光照引燃白磷Ⅱ.待白磷熄灭,冷却,打开K2,至液面不再变化,右管中液体的高度为h1 |
(1)实验1:锌与稀硫酸反应的化学方程式为 ;为使反应停止,Ⅲ中的操作是 。
(2)实验2:打开K2,右管中液面下降,原因是 ;计算空气中氧气体积分数的表达式为 (用h0、h1表示)。
14.某小组同学利用如图所示装置探究了可燃物的燃烧条件。
已知:白磷的着火点40℃,棉花的着火点150℃。
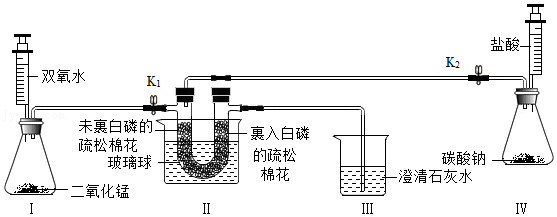
步骤①:将U型管放入冷水中,打开K1,关闭K2,向U型管中充入氧气。两端棉花都不燃烧。
步骤②:打开K2,关闭K1,向U型管中充入二氧化碳,观察到澄清石灰水变浑浊后,将U型管放入80℃热水中。两端棉花都不燃烧。
步骤③:…
步骤④:打开K2,关闭K1,向U型管中充入二氧化碳。燃烧着的棉花熄灭。
(1)步骤①的实验目的是 。
(2)步骤②中澄清石灰水的作用是 。
(3)步骤③的操作及现象是 。
(4)步骤④中燃着的棉花熄灭的原因是 。
已知:白磷的着火点40℃,棉花的着火点150℃。

步骤①:将U型管放入冷水中,打开K1,关闭K2,向U型管中充入氧气。两端棉花都不燃烧。
步骤②:打开K2,关闭K1,向U型管中充入二氧化碳,观察到澄清石灰水变浑浊后,将U型管放入80℃热水中。两端棉花都不燃烧。
步骤③:…
步骤④:打开K2,关闭K1,向U型管中充入二氧化碳。燃烧着的棉花熄灭。
(1)步骤①的实验目的是 。
(2)步骤②中澄清石灰水的作用是 。
(3)步骤③的操作及现象是 。
(4)步骤④中燃着的棉花熄灭的原因是 。
15.为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+H2O+Cu。
【进行实验】
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
实验2:取一定量的混合物,用1﹣2装置进行实验。
【解释与结论】
(1)配平化学方程式: C+ CuO
Cu+ CO2↑。
(2)实验1﹣2中,证明产生了CO2的现象是 。
(3)实验1的目的是 。
(4)实验2的结论是 。
【反思与评价】
(5)实验2没有进行质量比为1:14的实验,理由是 。
(6)为检验2﹣4的红色固体中是否含Cu2O,所需试剂是 。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+H2O+Cu。
【进行实验】
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
| 序号 | 1﹣1 | 1﹣2 |
| 装置 | 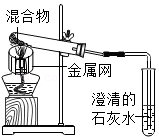 | 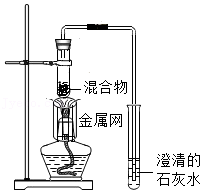 |
| 反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1﹣2装置进行实验。
| 序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
| 2﹣1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
| 2﹣2 | 1:10 | 混有很少量黑色物质 | |
| 2﹣3 | 1:11 | 混有极少量黑色物质 | |
| 2﹣4 | 1:12 | 无黑色物质 | |
| 2﹣5 | 1:13 | 混有较多黑色物质 | |
【解释与结论】
(1)配平化学方程式: C+ CuO
| 高温 |
(2)实验1﹣2中,证明产生了CO2的现象是 。
(3)实验1的目的是 。
(4)实验2的结论是 。
【反思与评价】
(5)实验2没有进行质量比为1:14的实验,理由是 。
(6)为检验2﹣4的红色固体中是否含Cu2O,所需试剂是 。
查看全部题目
相关试卷推荐
更多热门试卷
如何查看答案以及解析
扫描右侧二维码查看试卷答案解析以及视频讲解